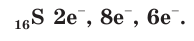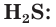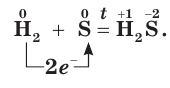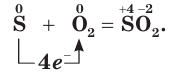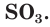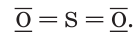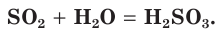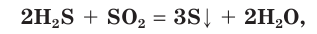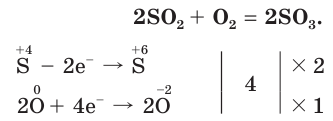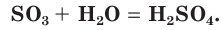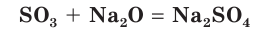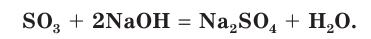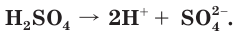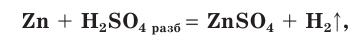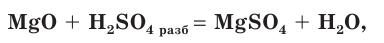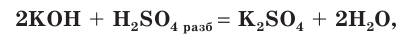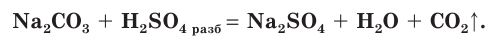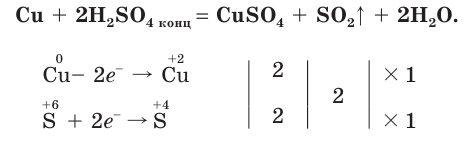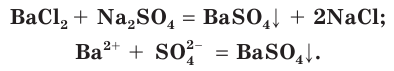Сера — элемент VIa группы 3 периода периодической таблицы Д.И. Менделеева. Относится к группе халькогенов — элементов VIa группы.
Сера — S — простое вещество имеет светло-желтый цвет. Использовалась еще до нашей эры в составе священных курений при религиозных обрядах.
- Сера. Химия серы и ее соединений
- Положение в периодической системе химических элементов
- Электронное строение серы
- Физические свойства и нахождение в природе
- Соединения серы
- Способы получения серы
- Химические свойства серы
- Сероводород
- Строение молекулы и физические свойства
- Способы получения сероводорода
- Химические свойства сероводорода
- Сульфиды
- Способы получения сульфидов
- Химические свойства сульфидов
- Оксиды серы
- Оксид серы (IV)
- Оксид серы (VI)
- Серная кислота
- Строение молекулы и физические свойства
- Способы получения
- Химические свойства
- Сернистая кислота
- Химические свойства
- Соли серной кислоты – сульфаты
- Сера в химии — классификация, получение, свойства, формулы и определения с примерами
- Сера в природе
- Строение атома серы
- Строение и физические свойства простых веществ
- Химические свойства серы
- Применение серы
- Оксид серы(IV) и оксид серы(VI)
- Оксид серы(VI)
- Серная кислота
- Строение молекулы серной кислоты
- Химические свойства серной кислоты
- Сульфаты — соли серной кислоты
- Соли серной кислоты
- Применение серной кислоты и сульфатов
- 📽️ Видео
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S, SO2.
Серу можно получить разложением пирита
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
- Реакции с неметаллами
На воздухе сера окисляется, образуя сернистый газ — SO2. Реагирует со многими неметаллами, без нагревания — только со фтором.
При нагревании сера бурно взаимодействует со многими металлами с образованием сульфидов.
Реакции с кислотами
При взаимодействии с концентрированными кислотами (при длительном нагревании) сера окисляется до сернистого газа или серной кислоты.
Реакции с щелочами
Сера вступает в реакции диспропорционирования с щелочами.
Реакции с солями
Сера вступает в реакции с солями. Например, в кипящем водном растворе сера может реагировать с сульфитами с образованием тиосульфатов.
Сероводород — H2S
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные ванны).
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Сероводород плохо диссоциирует в воде, является слабой кислотой. Реагирует с основными оксидами, основаниями с образованием средних и кислых солей (зависит от соотношения основания и кислоты).
KOH + H2S = KHS + H2O (гидросульфид калия, избыток кислоты)
Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.
Сероводород — сильный восстановитель (сера в минимальной степени окисления S 2- ). Горит в кислороде синим пламенем, реагирует с кислотами.
Качественной реакцией на сероводород является реакция с солями свинца, при котором образуется сульфид свинца.
Оксид серы — SO2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся спички).
В промышленных условиях сернистый газ получают обжигом пирита.
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота, распадающаяся на сернистый газ и воду.
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
С основными оксидами, основаниями образует соли сернистой кислоты — сульфиты.
Химически сернистый газ очень активен. Его восстановительные свойства продемонстрированы в реакциях ниже.
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства (понижать степень окисления).
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Диссоциирует в водном растворе ступенчато.
В реакциях с основными оксидами, основаниями образует соли — сульфиты и гидросульфиты.
H2SO3 + KOH = H2O + KHSO3 (соотношение кислота — основание, 1:1)
С сильными восстановителями сернистая кислота принимает роль окислителя.
Как и сернистый газ, сернистая кислота и ее соли обладают выраженными восстановительными свойствами.
Оксид серы VI — SO3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора (оксид ванадия — Pr, V2O5).
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Является кислотным оксидом, соответствует серной кислоте. При реакции с основными оксидами и основаниями образует ее соли — сульфаты и гидросульфаты. Реагирует с водой с образованием серной кислоты.
SO3 + 2KOH = K2SO4 + 2H2O (основание в избытке — средняя соль)
SO3 + KOH = KHSO4 + H2O (кислотный оксид в избытке — кислая соль)
SO3 — сильный окислитель. Чаще всего восстанавливается до SO2.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Химия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать

Сера. Химия серы и ее соединений
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии :
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в возбужденные энергетические состояния. Электронная конфигурация серы в первом возбужденном состоянии:
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления атома серы – от -2 до +4. Характерные степени окисления -2, 0, +4, +6.
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
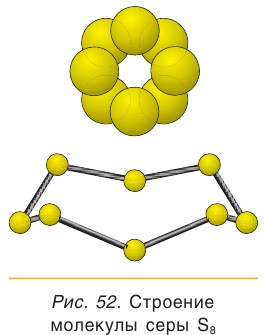
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета .
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны» . Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96 о С, а при обычной температуре превращающееся в ромбическую серу.
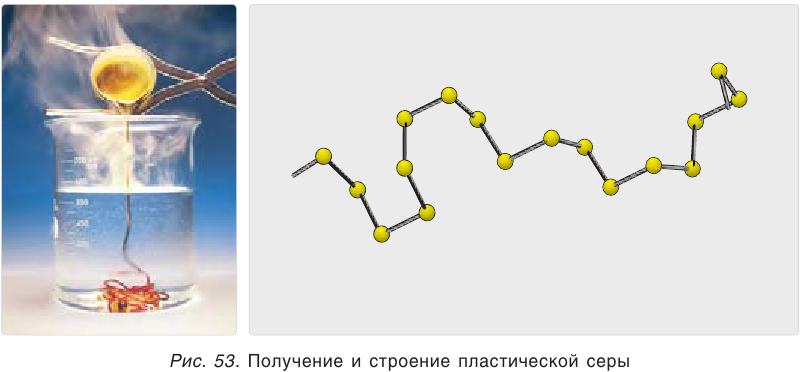
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO3 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара.
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем.
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами .
1.1. При горении серы на воздухе образуется оксид серы (IV) :
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2S + C → CS2
1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании.
Например , железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример : алюминий взаимодействует с серой с образованием сульфида алюминия:
1.5. С водородом сера взаимодействует при нагревании с образованием сероводорода:
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например , азотная кислота окисляет серу до серной кислоты:
Серная кислота также окисляет серу. Но, поскольку S +6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
Соединения хлора, например , бертолетова соль , также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов:
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например , сера реагирует с гидроксидом натрия:
При взаимодействии с перегретым паром сера диспропорционирует:
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют | |||||||||||||||||||||||||||||
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) | |||||||||||||||||||||||||||||
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | |||||||||||||||||||||||||||||||
| ZnS + 2HCl → ZnCl2 + H2S | ||||||||||||||||||||||||||||||||
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
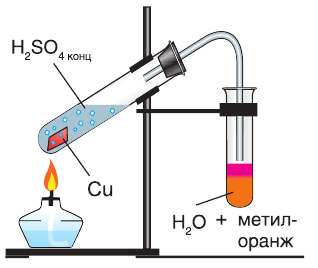
Например , взаимодействие меди с концентрированной серной кислотой:
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
Сернистый газ окисляют и другие окислители, например , озон или оксид азота (IV):
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
2. Серный ангидрид является типичным кислотным оксидом , взаимодействует с щелочами и основными оксидами.
Например , оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
Еще пример : оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель , так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями .
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например , сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
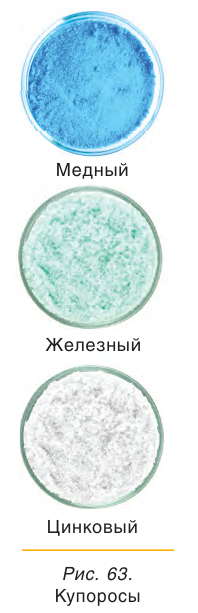
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Видео:Соединения серы. 9 класс.Скачать

Сера в химии — классификация, получение, свойства, формулы и определения с примерами
Содержание:
Сера — химический элемент и простое вещество:
Сера, так же как и кислород, является элементом VIA-группы периодической системы, она находится в третьем периоде. Рассмотрим свойства этого химического элемента и образуемых им простых веществ.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Сера в природе
Массовая доля серы в земной коре составляет около 0,05 %, она является распространенным элементом. В природе сера встречается как в виде самородной серы (рис. 49), так и в составе различных минералов и горных пород (рис. 50): сульфидов
Видео:8 класс. Составление уравнений химических реакций.Скачать

Строение атома серы
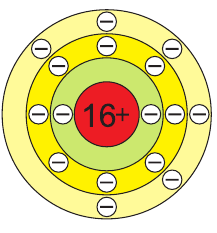
В атоме серы 16 электронов (рис. 51), из них 6 электронов — на внешнем электронном слое:
В соединениях с металлами и водородом сера обычно проявляет степень окисления, равную –2, например 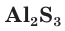
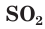
Видео:СЕРА | Химия 9 классСкачать

Строение и физические свойства простых веществ
Простое вещество сера существует в виде нескольких аллотропных модификаций, отличающихся составом и строением. Кристаллическая сера — твердое, легкоплавкое вещество желтого цвета. Кристаллическая сера имеет молекулярное строение — состоит из циклических молекул 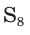
Сера в воде не растворяется и даже не смачивается ею. Если бросить в воду немного порошка серы, то частички серы не осядут на дно, а будут плавать на поверхности воды, образуя желтую пленку (рис. 54).
Химические свойства серы
Сера взаимодействует со многими простыми и сложными веществами, хотя ее реакционная способность ниже, чем у кислорода.
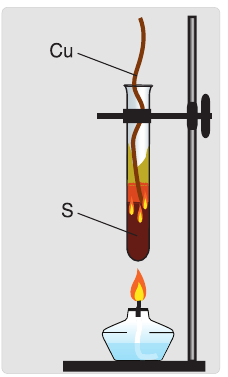
Сера реагирует со многими металлами, кроме золота и платины, проявляя при этом окислительные свойства, например (рис. 55):
Продуктами такого взаимодействия являются сульфиды металлов.
Реакция с серой является основой способа удаления и обезвреживания разлитой ртути, например, из разбитого термометра. Ртуть, которая попала в щели и другие труднодоступные места, засыпают порошком серы. Такой процесс называют демеркуризацией.
Окислительные свойства серы проявляются и в реакциях с некоторыми неметаллами. Сера взаимодействует с водородом при нагревании, образуя летучее соединение — сероводород
Сероводород — бесцветный газ с резким запахом тухлых яиц. Правильнее сказать, что это тухлые яйца пахнут сероводородом, так как этот газ образуется при гниении растительных и животных остатков. Сероводород ядовит. Поэтому его вдыхание может привести к тяжелому отравлению. Однако в небольших количествах сероводород оказывает целебное действие. Он содержится в водах некоторых минеральных источников.
Сера окисляется кислородом, проявляя при этом восстановительные свойства (рис. 56):
Применение серы
Больше половины добытой серы расходуется для получения серной кислоты, одного из самых важных химических продуктов. Нагреванием серы с каучуком получают резину. Как горючее вещество сера входит в состав черного пороха, спичечных головок. Широко применяется сера в сельском хозяйстве для борьбы с вредителями растений. В медицине серу используют для лечения кожных заболеваний.
Сера в соединениях с металлами и менее электроотрицательными элементами проявляет степень окисления –2, а в соединениях с более электроотрицательными элементами — +4 и +6.
Простое вещество сера существует в виде нескольких аллотропных модификаций.
Сера при взаимодействии с металлами, водородом и некоторыми неметаллами ведет себя как окислитель.
В реакции с кислородом сера является восстановителем.
Оксид серы(IV) и оксид серы(VI)
Сера образует с кислородом два оксида: оксид серы(IV), или сернистый газ, 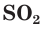
Оксид серы(IV) — это бесцветный газ с характерным запахом. Графическая формула его молекулы:
Оксид серы(IV) является кислотным оксидом, проявляя все соответствующие химические свойства: взаимодействует с водой, щелочами и осно Ђвными оксидами.
При растворении оксида серы(IV) в воде образуется слабая двухосновная сернистая кислота:
В этом легко убедиться по изменению окраски лакмуса с фиолетовой на красную в водном растворе оксида серы(IV). Сернистая кислота неустойчива и существует только в растворе. Соли этой кислоты называются сульфитами.
Сернистый газ обладает бактерицидным действием. Поэтому его широко используют для обработки овощехранилищ, плодов и фруктов, чтобы предотвратить их загнивание. Сернистый газ, как и соли сернистой кислоты, применяют для отбеливания соломы, шерсти, бумаги, тканей.
В оксиде серы(IV) сера находится в промежуточной степени окисления +4. Поэтому сернистый газ может проявлять как окислительные свойства, реагируя с восстановителями:
так и восстановительные свойства, взаимодействуя с сильными окислителями:
Реакция взаимодействия сернистого газа с сероводородом — один из важных процессов, протекающих в природе. При извержении вулканов выделяются SO2 и H2S, а при их взаимодействии образуется сера в виде кристаллов. На рисунке вы видите извержение вулкана Килауэа.
Оксид серы(VI)
Оксид серы(VI) SO3 представляет собой бесцветную жидкость, которая при температуре ниже 17 °С превращается в белое твердое вещество. Графическая формула его молекулы представлена на рисунке 58.
Это типичный кислотный оксид. Он реагирует с водой с выделением теплоты, образуя серную кислоту:
Оксид серы(VI) реагирует с основными оксидами:
Оксид серы(VI) применяется для промышленного получения серной кислоты.
Попадание оксидов серы в атмосферу при сжигании топлива приводит к образованию в облаках кислот и выпадению кислотных дождей. Они губительно действуют на все живое: разрушается почва, изменяется состав почвенных организмов, гибнут ценные виды рыб, исчезает растительность (см. рис.).
Оксид серы(IV) и оксид серы(VI) представляют собой типичные кислотные оксиды.
При взаимодействии с водой оксид серы(IV) и оксид серы(VI) образуют соответственно сернистую и серную кислоты.
Серная кислота
Серная кислота 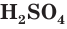
Строение молекулы серной кислоты
Модель молекулы серной кислоты представлена на рисунке 59. В молекуле 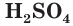
Связи 
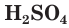
Физические свойства серной кислоты
Чистая серная кислота — бесцветная маслянистая нелетучая жидкость без запаха, примерно в 2 раза тяжелее воды. Она смешивается с водой в любых соотношениях. При приготовлении водных растворов серной кислоты выделяется большое количество теплоты, происходит разогревание смеси, которое может сопровождаться ее разбрызгиванием.
Помните!
Кислоту осторожно тонкой струйкой вливают в воду при непрерывном перемешивании раствора.
Обычно водный раствор серной кислоты с массовой долей 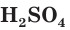
Концентрированная серная кислота используется как водоотнимающий агент, например для осушения газов (см. рис. слева).
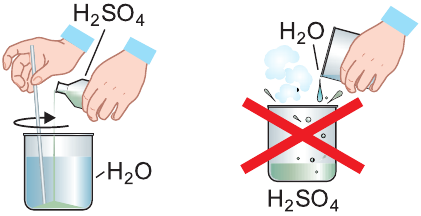
Она способна отнимать воду и у сложных веществ, в состав которых входят водород и кислород. Так, под действием концентрированной серной кислоты сахар обугливается и реакционная масса чернеет и вспучивается (см. рис. справа):
Химические свойства серной кислоты
Разбавленная серная кислота, как и соляная, проявляет все характерные для кислот свойства. Она изменяет окраску индикаторов: лакмус и метилоранж в растворе 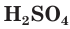
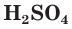
являясь окислителем за счет ионов водорода Н + .
Разбавленная серная кислота реагирует также с оксидами металлов:
Концентрированная серная кислота по своим свойствам отличается от разбавленной. Она является более сильным окислителем за счет атомов серы, имеющих степень окисления +6. Концентрированная 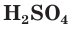
Продемонстрируем действие концентрированной серной кислоты на медь. При приливании концентрированной серной кислоты в пробирку с медью и нагревании смеси раствор окрашивается в серовато-синий цвет и наблюдается выделение газа 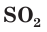
Железо, алюминий и некоторые другие металлы при обычных условиях не реагируют с концентрированной серной кислотой из-за образования защитной пленки на поверхности металла. Поэтому концентрированную серную кислоту можно хранить и перевозить в стальных цистернах (рис. 61).
Концентрированная серная кислота способна взаимодействовать с простыми веществами — неметаллами, а также со многими сложными, в том числе органическими соединениями. Серная кислота обугливает бумагу и древесину, разрушает одежду и кожу — это очень опасное вещество, способное вызывать труднозаживающие химические ожоги.
- Серная кислота — бесцветная, маслянистая жидкость. В водных растворах является сильным электролитом.
- Разбавленная серная кислота проявляет все характерные для кислот свойства: взаимодействует с металлами, стоящими в ряду активности до водорода, с выделением водорода; с оксидами металлов; с основаниями; с солями.
- При взаимодействии концентрированной серной кислоты с медью выделяется оксид серы(IV).
Сульфаты — соли серной кислоты
Серная кислота — один из главных продуктов химической промышленности. Об этом говорят и масштабы мирового производства, достигающие 200 млн т в год.
Соли серной кислоты
Как вы уже знаете из предыдущего параграфа, соли серной кислоты — сульфаты могут образовываться при ее взаимодействии с металлами, оксидами металлов, основаниями и солями.
Большинство сульфатов хорошо растворимы в воде. Растворимые сульфаты, главным образом сульфат магния, содержатся в морской воде и обуславливают ее горький вкус.
Многие сульфаты способны связывать воду, образуя кристаллогидраты. Кристаллогидраты солей серной кислоты часто называют купоросами, например: 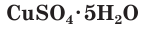
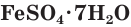
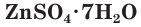
Плохо растворимы сульфаты металлов IIА-группы (кроме сульфатов бериллия и магния), меньше других растворим сульфат бария. При добавлении раствора соли бария, например хлорида бария 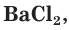
Поэтому для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
Применение серной кислоты и сульфатов
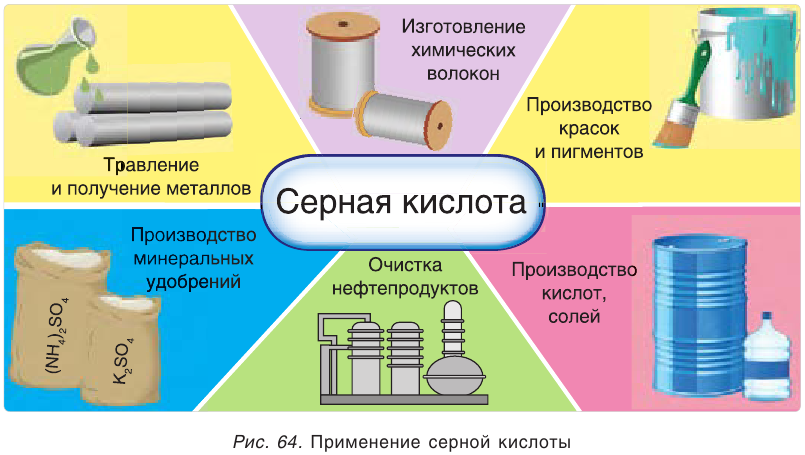
Серная кислота — один из важнейших продуктов, широко используемых в различных областях промышленности (рис. 64). Основными ее потребителями являются производства минеральных удобрений, соляной, уксусной и других кислот, моющих средств, взрывчатых веществ, красителей, лекарств. Серная кислота применяется также в металлургии, для очистки нефтепродуктов, в качестве электролита в кислотных аккумуляторах и т. д.
Соли серной кислоты используются в качестве минеральных удобрений, в строительстве, в медицине, для борьбы с вредителями растений, в производстве соды и стекла. Например, кристаллогидраты сульфата меди(II) 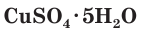
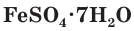
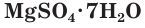
Природный гипс 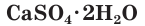
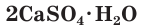
- Серная кислота — один из главных продуктов химической промышленности.
- Большинство сульфатов хорошо растворимы в воде.
- Для обнаружения серной кислоты и ее солей в водных растворах используют растворимые соли бария.
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Азот в химии
- Фосфор в химии
- Углерод в химии
- Кремний в химии
- Основания в химии
- Кислоты в химии
- Соли в химии
- Хлор в химии
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
📽️ Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Сера: химические свойства, аллотропия и её соединения #сера #химшкола #неметаллы #егэхимияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Решение цепочек превращений по химииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Сера - Самый ВОНЮЧИЙ Элемент на ЗЕМЛЕ!Скачать

9 класс § 28 "Кислородные соединения серы"Скачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Проклятая химическая реакция 😜 #shortsСкачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать