Сульфат бария BaSO4 — соль металла бария и серной кислоты. Белый, тяжелый, при сильном нагревании плавится и разлагается.
Не растворяется в воде. Малореакционноспособный.
Относительная молекулярная масса Mr = 233,39; относительная плотность для тв. и ж. состояния d = 4,5; tпл = 1580º C (разлагается).
- Способ получения
- Химические свойства
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Сульфат бария
- Содержание
- Получение
- Свойства
- Химические свойства
- Токсичность
- Применение
- Аналитическая химия
- Рентгеноконтрастное вещество
- Пигмент-наполнитель
- Другие применения
- 💥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. В результате взаимодействия хлорида бария и сульфата натрия образуется сульфат бария и хлорид натрия:
2. Гидроксид бария вступает в реакцию с разбавленной серной кислотой и образует сульфат бария и воду:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства
1. Сульфат бария реагирует с простыми веществами :
1.1. Сульфат бария взаимодействует с углеродом (коксом) при 1100 — 1200º С и образует сульфид бария, угарный газ или углекислый газ:
BaSO4 + 4C = BaS + 4CO
1.2. Хлорид бария вступает в реакцию с водородом при 900 — 1000º С с образованием сульфида бария и воды:
2. Сульфат бария вступает в реакцию со сложными веществами :
2.1. Сульфат бария взаимодействует с оксидами:
2.1.1. Сульфат в результате реакции с угарным газом при 600 — 800º С образует сульфид бария и углекислый газ:
BaSO4 + 4CO = BaS + 4CO2
2.2. Сульфат бария может реагировать с концентрированной серной кислотой. При этом сульфат бария образует гидросульфат бария:
3. Сульфат бария разлагается при температуре выше 1580º С, образуя оксид бария, оксид серы (IV) и кислород:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Please wait.
Видео:хлорид бария + сульфат натрияСкачать

We are checking your browser. gomolog.ru
Видео:8 класс. Составление уравнений химических реакций.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Качественная реакция на сульфит- и сульфат-ионыСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de3627a4fdc9752 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Качественная реакция на сульфат- и карбонат-ионы.Скачать

Сульфат бария
| Сульфат бария | |
|---|---|
 | |
 | |
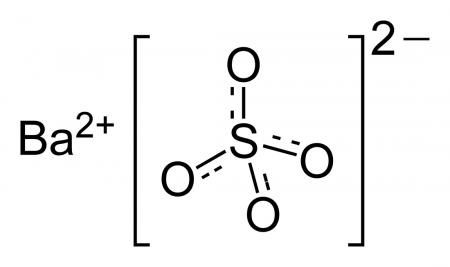
| Систематическое наименование | Сульфат бария |
| Хим. формула | BaSO4 |
| Рац. формула | BaSO4 |
| Состояние | твёрдый |
| Молярная масса | 233.43 г/моль |
| Плотность | 4.5 г/см³ |
| Температура | |
| • плавления | 1580 °C |
| • разложения | 2912 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость | |
| • в воде | 0,0002448 г/100 мл (20 °C) 0,000285 г/100 мл (30 °C) |
| Рег. номер CAS | 7727-43-7 |
| PubChem | 24414 |
| Рег. номер EINECS | 231-784-4 |
| SMILES | |
| RTECS | CR0600000 |
| ChEBI | 133326 |
| ChemSpider | 22823 |
| Токсичность | не токсичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Сульфат бария (сернокислый барий) — сернокислая соль бария. Химическая формула — BaSO4.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Содержание
- 1 Получение
- 2 Свойства
- 3 Химические свойства
- 4 Токсичность
- 5 Применение
- 5.1 Аналитическая химия
- 5.2 Рентгеноконтрастное вещество
- 5.3 Пигмент-наполнитель
- 5.4 Другие применения
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Получение
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами:
Последняя реакция используется также для получения пероксида водорода.
В промышленности большие объёмы сульфата бария получают из природного минерала тяжелого шпата, при этом исходное сырьё измельчается и декантируется.
Видео:составляем уравнения реацийСкачать

Свойства
Кристаллическое вещество — белый порошок или прозрачный кристалл, практически нерастворим в воде (растворимость 0,0015 г/л при 18 °C) и других растворителях. В природе встречается в виде минерала барита, который является основной бариевой рудой.
Видео:Качественная реакция ионов бария с серной кислотойСкачать

Химические свойства
Сульфат бария нерастворим в щелочах и большинстве кислот, однако растворим в хлорной воде, бромистоводородной и йодистоводородной кислотах, растворах гидрокарбонатов щелочных металлов.
Вступает во взаимодействие с концентрированной серной кислотой, которая переводит нерастворимый сульфат в хорошо растворимый гидросульфат бария:
При прокаливании с углём или коксом сульфат восстанавливается до сульфида:
BaSO4 + 4C → BaS + 4CO
При температурах выше 1600 °C разлагается:
2BaSO4 → 2BaO + 2SO2 + O2
Видео:Опыты по химии. Качественная реакция на сульфат-ионСкачать

Токсичность
Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
Видео:Уравнивание реакций горения углеводородовСкачать

Применение
Аналитическая химия
В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Рентгеноконтрастное вещество
Часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Пигмент-наполнитель
Сульфат бария является одной из составляющих смесей, используемых в качестве белых пигментов:
- Смесь сульфата бария с сульфидом цинка, получаемая взаимодействием растворов сульфида бария и сульфата цинка, — литопон.
- Мелкокристаллический сульфат бария, получаемый осаждением сульфатом натрия из раствора сульфида бария, — бланфикс (фр. Blanc fixe ).
Употребляется как клеевая краска, так как нерастворим в органических растворителях. Эти белила дешевле свинцовых, в отличие от них не токсичны и не темнеют от сероводорода.
Другие применения
Сульфат бария используется для различных промышленных целей:
- В качестве наполнителя для фото- и писчей бумаги, для линолеума и для некоторых лако-красочных материалов.
- Как белый наполнитель для пластмасс.
- В фотометрии: для окраски фотометрических шаров
- В электрохимической промышленности при изготовлении свинцовых аккумуляторов как расширитель активной массы отрицательного электрода.
- При производстве пасты для травления стекла.
- При производстве некоторых огнеупорных материалов.
- Протектор для рентгеновского излучения (бариевая штукатурка рентгеновских кабинетов).
- Добавление в продукцию Lego для обеспечения рентгеноконтрастности на случай, если ребёнок проглотит деталь (это был эксперимент, который закончился неудачно в 1996 году, из-за снижения прочности деталей и токсичности сульфата бария промышленного качества).
- Как основной компонент циммерита — обмазки брони немецких танков и САУ периода Второй мировой войны.
- В виде баритового концентрата при бурении скважин для утяжеления глинистых буровых растворов.
💥 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Хромат Бария - BaCrO4. Реакция Хромата Калия и Хлорида Бария. Реакция BaCl2 и K2CrO4.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Ионные уравнения реакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

9 класс. ОГЭ. Задание 23-24. ХЛОРИД БАРИЯ. часть 1.Скачать

Реакции ионного обменаСкачать






