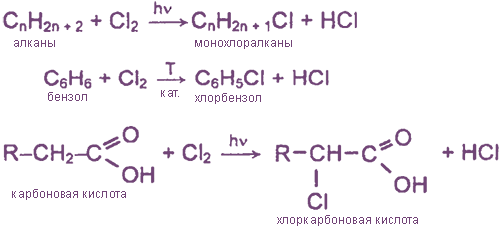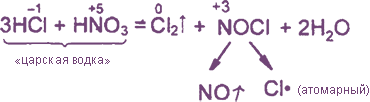Хлорид калия KCl — соль щелочного металла калия и хлороводородной кислоты. Белое вещество, плавится и кипит без разложения. Умеренно растворяется в воде.
Относительная молекулярная масса Mr = 74,55; относительная плотность для тв. и ж. состояния d = 1, 984; tпл = 770º C; tкип = 1430º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Физические свойства
- Способы получения
- Промышленный
- Лабораторные
- Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
- Диспропорционирование хлора в воде и водных растворах щелочей
- Взаимодействие хлора с органическими веществами
- Хлороводород и соляная кислота
- Газообразный хлороводород
- Физические и химические свойства
- Способы получения
- Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
- Химические свойства соляной кислоты
- Реакции с органическими соединениями
- Оксиды и оксокислоты хлора
- Все уравнения реакций хлора с калием
Видео:Взаимодействие хлора с калиемСкачать

Способ получения
1. Хлорид калия можно получить путем взаимодействия калия и разбавленной хлороводородной кислоты, образуются хлорид калия и газ водород:
2K + 2HCl = 2KCl + H2↑.
2. При комнатной температуре, в результате взаимодействия калия и хлора, образуется хлорид калия:
2K + Cl2 = 2KCl
3. Концентрированный раствор гидроксида калия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид калия, газ аммиак и вода:
4. Разбавленная хлороводородная кислота реагирует с гидроксидом калия . Взаимодействие хлороводородной кислоты с гидроксидом калия приводит к образованию хлорида калия и воды:
KOH + HCl = KCl + H2O
5. В результате взаимодействия сульфата калия и хлорида бария образуется сульфат бария и хлорид калия:
6. Карбонат калия взаимодействует с разбавленной соляной кислотой , образуя хлорид калия, углекислый газ и воду:
Видео:Взаимодействие хлора с калиемСкачать

Качественная реакция
Качественная реакция на хлорид калия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид калия образует нитрат калия и осадок хлорид серебра:
KCl + AgNO3 = KNO3 + AgCl↓
Видео:Взаимодействие хлора с железомСкачать

Химические свойства
1. Хлорид калия вступает в реакцию со многими сложными веществами :
1.1. Хлорид калия взаимодействует с кислотами :
Хлорид калия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата калия и газа хлороводорода:
1.2. Хлорид калия способен вступать в реакцию с многими солями :
1.2.1. Твердый хлорид калия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида калия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, сульфата калия, газа хлора и воды:
1.2.2. Хлорид калия взаимодействует с гидросульфатом калия при температуре 450–700º C . При этом образуются сульфат калия и хлороводородная кислота:
1.2.3. При взаимодействии концентрированного раствора хлорида калия и насыщенного перхлората натрия выделяются перхлорат калия и хлорид натрия:
KCl + NaClO4 = KClO4↓ + NaCl
Видео:Взаимодействие хлора с калиемСкачать

Физические свойства
Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Видео:Взаимодействие хлора с калиемСкачать

Лабораторные
Окисление конц. HCI различными окислителями:
Видео:Взаимодействие хлора с калиемСкачать

Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Видео:Получение ХЛОРА. Реакция СОЛЯНОЙ КИСЛОТЫ и ПЕРМАНГАНАТА КАЛИЯ. Химические опыты. Chemical experimentСкачать

Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Видео:Опыты по химии. Взаимодействие хлора с растворами бромида и йодида натрияСкачать

Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Видео:Самая лучшая подборка реакций с хлоратом калия! (химия)Скачать

Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Видео:8 класс. Составление уравнений химических реакций.Скачать

Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Видео:Калий и хлор - реакция взаимодействияСкачать

Газообразный хлороводород
Видео:Хлор. 9 класс.Скачать

Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Видео:Химия Неорганика 130 Взаимодействие хлора с калиемСкачать

Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Видео:130 Взаимодействие хлора с калиемСкачать

Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Видео:Получение хлората калия, бертолетовой соли из отбеливателя (химия)Скачать

Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Видео:Опыты по химии. Вытеснение йода и брома хлоромСкачать

Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Видео:Получение хлораСкачать

Все уравнения реакций хлора с калием
Хлор активно взаимодействует со щелочными металлами. Кусочек калия извлечем из керосина, на фильтровальной бумаге очистим его от керосина и оксидной пленки. Положим кусочек калия в железную ложку для сжигания веществ и осторожно нагреем. Калий загорается на воздухе. Опустим ложку с калием в сосуд с хлором. Калий энергично сгорает в атмосфере хлора.
Образуется белый дым хлорида калия.
Оборудование: цилиндр, тигельные щипцы, керамическая или стеклянная пластинка, горелка, скальпель, пинцет, ложка для сжигания веществ, фильтровальная бумага.
Техника безопасности. Соблюдать правила работы с ядовитыми газами. Опыт проводить только под тягой.
Постановка опыта и текст – к.п.н. Павел Беспалов.