Органическое вещество А, широко используемое в производстве синтетических волокон, состоит из трёх элементов. Оно содержит 13,79% водорода и 24,14% азота по массе. Вещество А проявляет основные свойства и образуется при полном восстановлении нитрила адипиновой (гександиовой) кислоты водородом. Определите молекулярную формулу вещества А и установите его структуру. Напишите уравнение получения вещества А описанным выше способом.
1) Определена молекулярная формула вещества A:
n(C) : n(H) : n(N) = ((100 – 13,79 – 24,14) / 12) : (13,79 / 1) : (24,14 / 14) = 3 : 8 : 1.
Простейшая формула – . Однако при одном атоме азота число атомов водорода не может быть чётным, следовательно, простейшую формулу надо умножить на 2.
Молекулярная формула – . Это подтверждается и тем, что вещество образуется при восстановлении нитрила адипиновой кислоты, содержащего 6 атомов углерода.
2) Вещество проявляет основные свойства, следовательно, это диамин. Судя по степени ненасыщенности, диамин – предельный.
Он образуется при восстановлении нитрила , следовательно, имеет неразветвлённый скелет, а аминогруппы находятся в крайних положениях. Вещество А – 1,6-диаминогексан (гексаметилендиамин):
3) Уравнение реакции гидрирования нитрила адипиновой кислоты:
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный: − правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества; − записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; Содержание
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  Восстановление нитриловВы будете перенаправлены на Автор24 Первичные амины могут быть получены из нитрилов либо путем каталитического гидрирования, либо путем восстановления различными восстанавливающими агентами, либо путем гидролиза. Аналогично получают амины из изонитрилов Видео:Проклятая химическая реакция 😜 #shortsСкачать  Особенности гидрирования и восстановления нитриловВосстановление нитрилов является удобным методом получения первичных аминов. Восстановление осуществляют водородом «в момент выделения». В качестве восстановителей используют цинк или олово с соляной или серной кислотой, натрий в абсолютном спирте (лучше в бутиловом или амиловый), а также алюмогидрид лития: При каталитическом восстановлении нитрилов в жидкой фазе — в ледяной уксусной кислоте в присутствии палладия (на сульфате бария) или в присутствии платины в уксусном ангидриде — первичные амины образуются с высокими выходами: При парофазном гидрировании алифатических нитрилов в присутствии никеля при 200-250 $^circ$ С главным продуктом реакции является вторичный амин, что обусловлено конденсацией первичного амина с промежуточным продуктом — альдимином. Например, при таком гидрировании ацетонитрила получают 60% диэтиламина, 20% этиламина и 20% триэтиламина: Готовые работы на аналогичную темуОднако следует заметить, что если данные реагенты смешивать в обратном порядке, т.е. при добавлять к нитрилу однин эквивалент алюмогидрида лития, то образуется не амин, а альдимин. При реакциях каталитического гидрирования нитрилов кроме первичных аминов обычно образуются значительные количество вторичных аминов. Для объяснения образования смеси первичных и вторичных аминов был предложен такой механизм реакции: Побочные реакции, приводящие к образованию вторичных аминов, можно практически полностью нивелировать, если процесс гидрирования проводить в присутствии большого количества аммиака, который смещает равновесие на стадии (3) влево. Видео:Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать  Гидролиз нитрилов до амидов кислотКонечным продуктом гидролиза нитрилов (который проводят в присутствии кислот или оснований) являются карбоновые кислоты. Первая стадия реакции — присоединение воды с образованием амида кислоты — в щелочной среде: При воздействии второй молекулы воды происходит гидролиз амида до карбоновой кислоты и аммиака. Проведение реакции в мягких условиях позволяет задержать ее на стадии образования амида. Реакция останавливается на этой стадии, если амид не гидролизуется в обычных и даже жестких условиях. Видео:Несколько опытов с МАЛОНОВОЙ КИСЛОТОЙСкачать  Восстановление и гидролиз изонитриловВосстановление изонитрилов. Восстановление изонитрилив во вторичные амины (в которых одна из групп, связанных с азотом, всегда метильная) проводят натрием в абсолютном спирте или каталитически: Гидролиз изонитрилов быстро происходит в разбавленных кислотах и приводит к образованию первичных аминов (как промежуточное соединение образуется формиламин, который гидролизуется дальше в амин и муравьиную кислоту): Изонитрил нагревают с водой до 180 $^circ$ С или обрабатывают водой на холоду в присутствии разбавленной минеральной кислоты (в присутствии концентрированных кислот реакция происходит со взрывом !). Видео:ЖЕЛЕЗО и его соединения для ЕГЭ ПОЛНОСТЬЮ | Самые завальные реакции | ЕГЭ по химии 2023Скачать  Расщепление третичных аминов бромцианами (реакция Брауна)Для получения вторичных аминов из третичных с успехом используют метод Брауна — воздействие на них бромцианов. Бромцианы (кристаллическое вещество, tпл. = 52 $^circ$ С, летучее и очень ядовитое (!) соединение) можно рассматривать как галогенангидрид циановой кислоты. Его получают действием брома на цианид калия или циановодород. С аммиаком и аминами бромциан реагирует с образованием цианамида, со спиртами — эфиров иминоугольной кислоты: При взаимодействии третичного амина с бромцианом образуется четвертичная соль, что при нагревании легко отщепляет алкилбромид и переходит в диалкилцианамид. В результате кислотного гидролиза диалкилцианамида и дальнейшего декарбоксилирования диалкилкарбаминовой кислоты (промежуточное соединение) образуется вторичный амин с почти количественным выходом: Как правило, в этой реакции вместе с бромом отщепляется наименьший радикал, образуя алкилбромид и диалкилцианамид, который далее превращается во вторичный амин, например: Видео:Лабораторная работа №4. Окислительно-восстановительные реакции. Основные окислители и восстановителиСкачать  Восстановление нитрила адипиновой кислоты водородом уравнение реакции
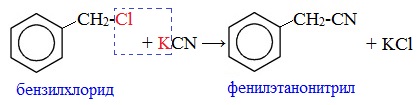
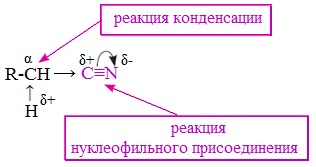
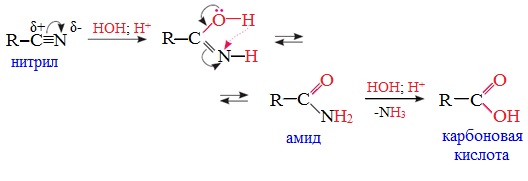
От других функциональных производных карбоновых кислот нитрилы отличаются отсутствием карбонильной группы. Общая формула нитрилов — R-С≡N НоменклатураАциклические соединения R-CN называют по названию углеводорода с соответствующим количеством углеродных атомов, включая углеродный атом группы -С≡N, к которому добавляют суффикс – нитрил . А также от названий ацильных остатков карбоновых кислот, к которым добавляется суффикс — нитрил : Названия нитрилов также можно образовывать из названий карбоновых кислот заменой окончания – карбоновая кислота на – карбонитрил : Способы получения1. Дегидратация амидов Нитрилы получают дегидратацией амидов при нагревании с сильными водоотнимающими средствами — оксидом фосфора (V) P2O5 или трихлороксидом фосфора POCl3: 2. Взаимодействие галогеналканов с цианидами щелочных металлов Нитрилы можно получить при взаимодействии галогеналканов с солями циановодородной кислоты: Характеристика реакционной способностиРеакционная способность нитрилов обусловлена наличием в их структуре цианогруппы -С≡N. Цианогруппа имеет линейное строение, атомы углерода и азота находятся в sp-гибридизации и образуют между собой полярную тройную связь, электронная плотность которой смещена к атому азота. Проявляя отрицательный индуктивный эффект (-I-эффект), цианогруппа смещает на себя электронную плотность с углеводородного радикала и тем самым увеличивает подвижность атомов водорода при α— углеродном атоме (СН-кислотность). По месту разрыва тройной связи нитрилы вступают в реакции нуклеофильного присоединения , за счет α-углеродных атомов для них характерны реакции конденсации. Химические свойства1. Гидролиз нитрилов При нагревании с водными растворами щелочей или кислот нитрилы гид-ролизуются с образованием карбоновых кислот. Гидролиз идет в две стадии. Вначале по месту разрыва кратной связи присоединяется одна молекула воды, в результате чего образуются амиды, которые могут быть выделены в индивидуальном состоянии. Дальнейший гидролиз амидов приводит к карбоновым кислотам: 2. Восстановление нитрилов При восстановлении нитрилов алюмогидридом лития (LiAlH4) или водородом в присутствии катализатора образуются первичные амины: Отдельные представители
Ацетонитрил используется для растворения масел, жиров, лаков, эфиров целлюлозы, различных синтетических полимеров и неорганических солей, используется в производстве витамина B1. Токсичен, всасывается через неповрежденную кожу, опасен при попадании в глаза.
Используют в производстве синтетического волокна (нитрон), бутадиен-нитрильного каучука, широко применяется в органическом синтезе.
Акрилонитрил необратимо связывается с белками, РНК и ДНК различных тканей. Опасен при вдыхании, ядовит при приёме внутрь — вплоть до летального исхода. Пары вызывают раздражение слизистых оболочек и кожи. Действует через неповреждённую кожу. При горении образуются ядовитые газы.
Малононитрил обладает высокой реакционной способностью, широко применяется в органическом синтезе для получения гетероциклических соединений. Используют в производстве витаминов B1 и B6, пестицидов, красителей. Его используют также как сшивающий агент для полимеров, добавку к смазочным маслам, стабилизирующую их вязкость, и комплексообразователь при извлечении золота.
Причиняет вред головному мозгу и сердцу, связанный с недостатком клеточного кислорода. 🌟 ВидеоАмиды. Получение. Все 7 реакций ЕГЭ.Скачать  10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать  Водород IA группа | Химия ЕГЭ, ЦТСкачать  Решение всех заданий 31 (неорганические цепочки) из сборника Добротина 2023 | Химия ЕГЭ УМСКУЛСкачать  59. НитросоединенияСкачать  5 самых завальных цепочек с реального ЕГЭ | Химия ЕГЭ 2022 | УмскулСкачать  Восстановление меди водородом из оксида меди (II)Скачать  Химия. ЕГЭ2021. ВодородСкачать  Разбор ЕГКР по химии, вариант 2 | ЕГЭ-2024Скачать  Полный разбор всех заданий демоверсии ЕГЭ 2024 по химииСкачать  Химия 11 класс (Урок№15 - Свойства оксидов неметаллов. Водородные соединения неметаллов.)Скачать  Адипиновая кислота. Практикум по органической химии | полная версияСкачать  Перекись водорода. Что будет, если..? или как получить хлор... в желудке.Скачать  ЛЕКЦИЯ 2. КИСЛОТЫСкачать  |
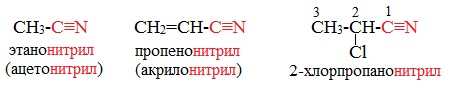

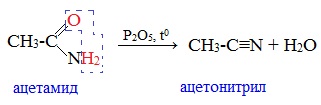
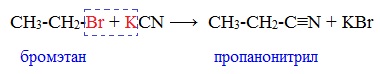
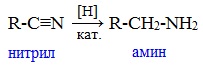
 Ацетонитрил СН3-С≡N — бесцветная жидкость со слабым эфирным запахом (т.кип.81,6 0 С), смешивается с водой, этиловым спиртом, диэтиловым эфиром, ацетоном, CCl4 и другими органическими растворителями.
Ацетонитрил СН3-С≡N — бесцветная жидкость со слабым эфирным запахом (т.кип.81,6 0 С), смешивается с водой, этиловым спиртом, диэтиловым эфиром, ацетоном, CCl4 и другими органическими растворителями. Акрилонитрил Н2С=СН-С≡N — бесцветная или бледно желтая жидкость с характерным запахом миндаля или вишневых косточек (т.кип.77,3 0 С), пары тяжелее воздуха. Растворяется в воде и многих органических растворителях.
Акрилонитрил Н2С=СН-С≡N — бесцветная или бледно желтая жидкость с характерным запахом миндаля или вишневых косточек (т.кип.77,3 0 С), пары тяжелее воздуха. Растворяется в воде и многих органических растворителях. Акрилонитрил относится к категории СДЯВ (сильнодействующих ядовитых веществ). Токсичное действие подобно цианидам.
Акрилонитрил относится к категории СДЯВ (сильнодействующих ядовитых веществ). Токсичное действие подобно цианидам. Малонодинитрил N≡С-СН2-С≡N — белое кристаллическое вещество (т.пл.32 0 С), малорастворим в воде, растворяется в органических растворителях. Малонодинитрил вступает в различные реакции конденсации с участием как цианогрупп, так и активной метиленовой группы.
Малонодинитрил N≡С-СН2-С≡N — белое кристаллическое вещество (т.пл.32 0 С), малорастворим в воде, растворяется в органических растворителях. Малонодинитрил вступает в различные реакции конденсации с участием как цианогрупп, так и активной метиленовой группы.