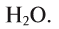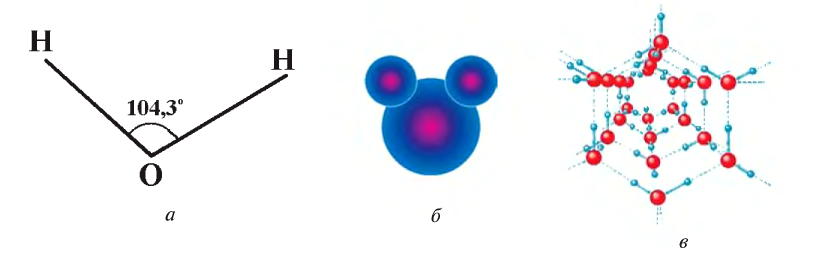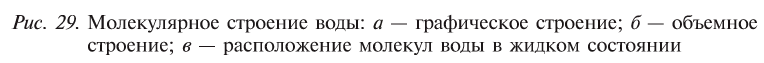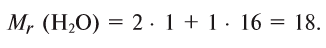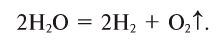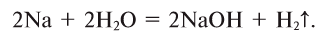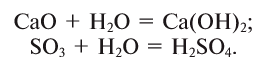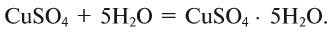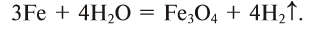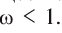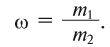Вода — строение молекулы, химические и физические свойства. Взаимодействие с простыми веществами (металлами и неметаллами), и со сложными веществами.
- Физические свойства
- Химические свойства
- Химические свойства воды. 6 основных типов химических реакций для воды.
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса с примерами
- Вода и её физические свойства
- Вода и её химические свойства
- Распространение воды в природе
- Меры по сохранению водных ресурсов от загрязнения
- Вода — один из лучших растворителей
- Понятие о растворах и их концентрациях
- Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
- 📺 Видео
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Видео:Химические свойства воды/часть 1/химия 8 классСкачать

Химические свойства воды. 6 основных типов химических реакций для воды.
Давайте вспомним все уже известные нам реакции, в которых участвует вода. Для этого вновь напишем уравнения встречавшихся ранее реакций и систематизируем их. Оказывается, вода – весьма активное в химическом отношении вещество.
1) Вода реагирует со многими металлами с выделением водорода:
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO (при сильном нагревании)
2) Электролиз. Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем.
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса с примерами
Содержание:
Вода ее элементный состав, молекулярное строение, формула и молярная масса:
Вода — одно из важнейших химических соединений, широко распространенное на земном шаре.
Вода — это сложное вещество, состоящее из двух атомов водорода и одного атома кислорода (рис. 29).
Молекулярная формула воды —
Относительная молекулярная масса воды равна сумме относительных атомных масс водорода и кислорода:
Следовательно, масса 1 моля воды — 18 г, а молярная масса воды — 18 г/моль.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Вода и её физические свойства
Чистая вода — прозрачная жидкость без цвета, вкуса и запаха. Вкус и запах воде придают растворенные в ней примеси. Многие физические свойства воды очень своеобразны. При соответствующих обстоятельствах они являются аномальными, т.е. отклоняются от привычных. Например, плотность воды при переходе из твердого состояния (лед) в жидкое не уменьшается, как у большинства веществ, а увеличивается (рис. 30). Плотность растет и при нагревании воды от 0°С до + 4°С, достигая своего максимума — 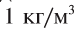
Еще одно свойство воды — это ее высокая теплоемкость (4,18 Дж/кг) (для сравнения: у песка —
0,79; известняка — 0,88; поваренной соли — 0,88; глицерина — 2,43; этилового спирта — 2,85). Поэтому вода в ночное время или при переходе от летнего сезона к зимнему медленно остывает, а в дневное время и при смене зимы летом так же медленно нагревается.
Вода замерзает при 0°С (при этой же температуре лед начинает таять) и превращается в пар (кипит) при 100°С.
Вода, являясь универсальным растворителем, растворяет многие органические и неорганические вещества.
Вода и её химические свойства
Молекулы воды очень устойчивы к нагреванию, но при температуре выше 1000°С пары воды начинают разлагаться на водород и кислород:
Реакционная способность воды очень велика.
Активные металлы, взаимодействуя с водой, выделяют из нее водород:
Рис. 30. Вода и лед
При взаимодействии с водой оксидов многих металлов и неметаллов образуются основания и кислоты:
Некоторые соли образуют с водой соединения, называемые кристаллогидратами:
Нагретое железо вступает в реакцию с парами воды:
Вода катализирует ряд химических процессов: при ее отсутствии «гремучий газ» не взрывается даже при высокой температуре, угарный газ не горит в кислороде, натрий и фосфор не окисляются на воздухе, не взаимодействуют с хлором и не происходит травления стекла фтористым водородом.
Распространение воды в природе
Три четверти поверхности земного шара покрыто водой в виде океанов, морей, озер, рек. Вода распространена в атмосфере в виде паров, на горных вершинах и полюсах — в виде ледников и снега. Существуют также подземные воды, увлажняющие почву и горные породы.
Объем Мирового океана составляет 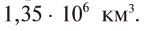
Вода имеет огромное значение в жизни растений, животных и людей. По современным представлениям, происхождение и развитие жизни на Земле было связано с морем. Вода — это среда, которая обеспечивает жизнедеятельность каждого организма посредством химических процессов, в ней протекающих. Кроме того, вода сама участвует в ряде биохимических процессов.
Аномальные физические свойства воды имеют важное значение в обеспечении жизненных процессов. Если бы плотность воды при переходе из жидкого состояния в твердое изменялась так же, как и у других веществ, то с приходом зимы поверхность воды, замерзая при 0°С, оседала бы ниже и уступала бы свое место более теплому слою, который также замерзал бы и оседал на дно. Таким образом вся вода превратилась бы в лед и многие формы жизни прекратили бы свое существование.
Но то, что вода при +4°С обладает максимальной плотностью, не дает происходить подобному явлению, так как обладающий меньшей плотностью лед остается на поверхности воды и предохраняет от замерзания более глубокие теплые слои.
Высокая теплоемкость воды также имеет большое значение для жизни на Земле. На нагревание воды необходимо затратить больше энергии, чем на нагревание любого другого вещества, т.е. вода, поглотившая тепло, нагревается при более низкой температуре, чем любая другая жидкость. Одна третья часть поглощаемой энергии Солнца расходуется на испарение воды Мирового океана и других водных бассейнов.
Вода выполняет специфическую роль терморегулятора и тем самым обеспечивает нормальную жизнедеятельность на поверхности Земли. Водные ресурсы земного шара могут быть как солеными, так и пресными, но все они имеют важное значение для промышленности.
Промышленность приспособлена для потребления в основном пресной воды. По имеющимся сведениям, в год на одного жителя планеты приходится в среднем 8000 л воды. Это количество воды используется как в бытовых, так в сельскохозяйственных и промышленных целях.
Только 10% расходуемой воды приходится на бытовые расходы, а остальное количество затрачивается на промышленность и сельское хозяйство. Для получения 1 кг сахара необходимо 400 л воды, для обработки 1 кг зерна — 1500 л, а для получения 1 кг синтетической резины необходимо примерно 2500 л воды.
В промышленности вода в основном используется как растворитель, охладитель и очиститель.
Пресная вода широко используется в сельском хозяйстве для полива полей и питья в животноводстве.
Повсеместное использование воды в промышленности связано с проблемами возникновения сточных вод и загрязнения окружающей среды. Для решения этих проблем необходим комплексный подход.
Не забывайте, что вода является бесценным богатством!
Меры по сохранению водных ресурсов от загрязнения
Для жизнедеятельности (т.е. для бытовых нужд, сельского хозяйства и промышленности) используют воды озер, рек, подземные воды и воды искусственных водоемов. Для водообеспечения большое значение имеет сохранение чистоты воды, которая загрязняется, проходя через систему канализационных сетей, промышленных предприятий, подвергаясь «обработке» путем смыва химических средств с полей.
Возвращаемые в водоемы сточные воды должны проходить соответствующую очистку, поскольку они могут быть загрязнены выбросами ферм, мусоросборников, городской канализацией, дренажными водами, остатками минеральных удобрений, инсектицидами, гербицидами, отходами больниц, торговых предприятий, общественного питания, заводов, фабрик и лабораторий. Такие воды должны быть подвергнуты многоступенчатой очистке. Сначала вода пропускается через механические фильтры, на которых задерживаются песок и другие частицы. Мелкие же частицы и многие бактерии осаждаются путем добавления в воду сначала извести, а затем сульфата алюминия. При пропускании воздуха через такую воду в ней усиливается разложение органических веществ. На последней стадии, чтобы очистить воду от бактерий, ее обрабатывают озоном или хлором. После такой стерилизации воду можно использовать для потребления.
При применении данного метода очистки вода очищается от вредных веществ. Но в некоторых случаях появляется необходимость ее очистки от ионов кальция и магния, повышающих жесткость воды. Эти ионы в сочетании с мылом образуют в воде нерастворимые соединения, отрицательно влияющие на эффективность синтетических моющих веществ. Такая вода при кипячении дает накипь. Многие подземные воды подвергаются такой очистке, потому что в результате взаимодействия известняка, а также других соединений магния и кальция содержание их ионов в воде возрастает. Эта вода обрабатывается гашеной или негашеной известью, а также содой. Потом проводят ее обработку квасцами. Такая вода полностью готова к употреблению.
Для очистки сточных вод существует особый способ, состоящий из трех стадий. На первой стадии очистку проходят 30% воды, на второй 60%, 10% воды не подвергаются очистке. При этом на первой стадии фильтрованием отделяются крупные твердые частицы, 60% которых могут выпасть в осадок. Если не подвергать такую воду вторичной очистке, то следует провести ее обеззараживание хлором и отправить в водоем.
При вторичной очистке посредством воздуха разлагаются органические вещества, увеличивается количество аэробных бактерий, которые, питаясь остатками органических веществ, очищают воду. Затем они осаждаются, а вода подвергается обработке хлором и сливается в водоем. На этой стадии можно осадить до 90% твердых частиц.
Вода, прошедшая первичную и вторичную обработку, может содержать значительное количество соединений фосфора и азота, что приводит к размножению водорослей в водоемах. Помимо этого, многие химические вещества, содержащиеся в сточных водах, пройдя эти стадии очистки, могут снова загрязнять окружающую среду и водные бассейны.
Однако полная очистка воды от многих металлов и органических веществ — очень дорогостоящая процедура. Поэтому вода в незначительных количествах подвергается третичной обработке, при которой с помощью специальных средств такие примеси ликвидируются.
Вода — один из лучших растворителей
Вода имеет огромное значение в жизни и практической деятельности человека. Процесс усвоения пищи связан с переводом питательных веществ в растворимые формы посредством воды. Все физиологически важные жидкости (кровь, лимфа и др.) — водные растворы. В основе многих сфер производственной деятельности лежат процессы, в которых используются водные растворы.
Жидкие растворы — это жидкие гомогенные (однородные) системы, состоящие из двух или более компонентов.
Общая поверхность Земли составляет 510100000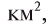
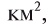
В природе вода широко распространена в виде растворенных в ней солей. Такие реки, как Ганг или Миссисипи, растворяют до 100 млн т солей в год, а все реки мира — 2,735 млрд т солей.
Почти все вещества растворяются в воде (рис. 31): некоторые — очень хорошо, другие — средне, а остальные — плохо.
Проходя через нижние слои атмосферы, дождевая вода может растворить значительное количество различных веществ. При выпаривании 1000 г дождевой воды остается 3—5 г твердого осадка.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.
Рис. 31. Растворение различных веществ в воде:
1 — хлорид кальция; 2 — перманганат калия; 3 — пищевая соль; 4 — бихромат калия;5 — карбонат натрия; 6 — бертолетова соль
Рис. 32. Растворение сахара в воде
Вода — универсальный растворитель, который может растворять и газы (кислород, водород, углекислый газ и др.), и жидкости (спирт, кислоты и др.), и твердые вещества (соли, минералы и др.).
В воде растворяются в небольшом количестве даже те вещества, которые, казалось бы, совсем не растворяются в ней. К.В. Шееле, кипятя в течение 12 дней в колбе дистиллированную снеговую воду, отметил небольшое разъедание стенок колбы. А. Лавуазье, кипятя определенное количество воды в колбе в течение 101 дня, заметил, что масса сосуда уменьшилась на определенное число, а масса осадка, полученного после выпаривания воды, равняется этому числу. Следовательно, даже стекло незначительно растворяется в воде.
Способность вещества растворяться называется растворимостью.
Например, понаблюдаем растворение сахара в воде (рис. 32). При комнатной температуре (20°С) в 100 г воды может раствориться 200 г сахара. Большее количество сахара при этой температуре не растворится. Такой раствор называется насыщенным.
Мера растворимости определяется количеством вещества в насыщенном растворе при определенных условиях.
Растворимость определяется растворением вещества в 100 г растворителя. Если в растворителе растворяется больше 10 г вещества, то оно считается хорошо растворимым, если меньше 1 г — малорастворимым, если меньше 0,01 г — практически нерастворимым.
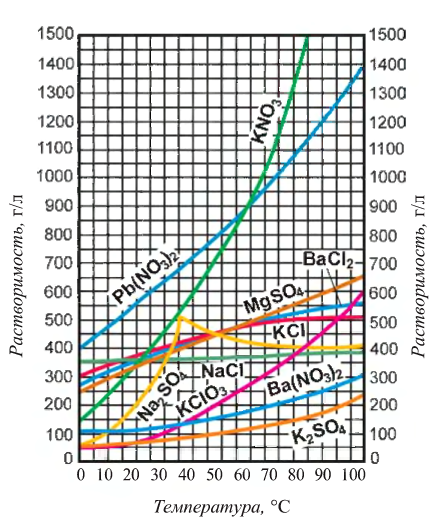
Растворимость многих твердых веществ возрастает с повышением температуры. Эту зависимость можно представить в виде графика (рис. 33).
Растворимость газов при повышении температуры уменьшается (при кипячении воды растворенные в ней газы выделяются).
Рис. 33. Кривые растворимости различных солей
Но повышение давления приводит к возрастанию их растворимости (открывая бутылку минеральной воды, мы уменьшаем давление внутри сосуда, и поэтому растворенный в ней углекислый газ начинает интенсивно выделяться).
Понятие о растворах и их концентрациях
Раствор — это однородная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещество в растворе измельчено до молекул, атомов или других частиц и равномерно распределено между молекулами растворителя, так как размеры частиц растворенного вещества составляют 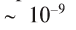
Растворы бывают жидкими, твердыми и газообразными. Примерами жидких растворов могут быть водные растворы соли, сахара, спирта; твердых растворов — золотометаллические изделия, сплавы типа дюралюминия; газообразных растворов — воздух или другие смеси газов.
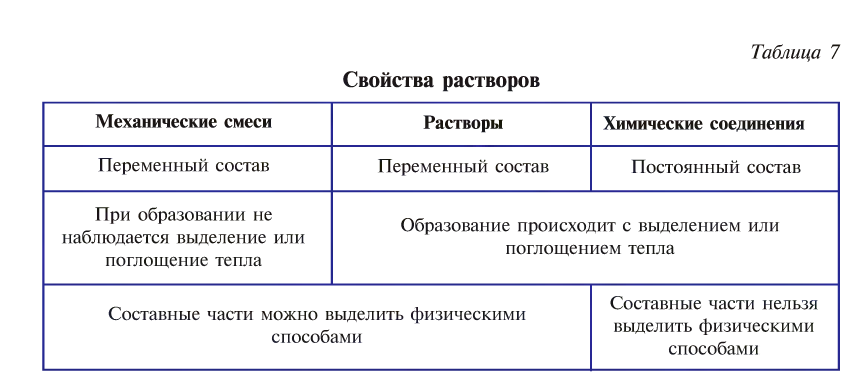
При образовании растворов наблюдается выделение или поглощение тепла. Растворы могут хорошо проводить или не проводить электрический ток.
Растворы обладают свойствами как механических смесей, так и химических соединений (табл. 7).
При практическом применении растворов важное значение имеет точное определение количества вещества, растворенного в общей массе раствора.
Состав раствора (в частности, количество растворенного вещества) можно установить различными способами и выразить в размерных величинах (концентрациях).
Когда речь идет о компонентах раствора, под ними подразумеваются чистые вещества, при смешивании которых образуется раствор. При этом большее количество вещества принимается за растворитель, а меньшее — за растворенное вещество (рис. 34).
Эти термины были приняты для удобства, потому что при смешивании двух компонентов их нельзя строго разделять. При образовании раствора из чистой жидкости и твердого вещества обычно за растворитель принимается жидкий компонент. Независимо от того, что является растворенным веществом — газ, жидкость или твердое тело, — когда мы говорим о составе раствора, то обязаны учитывать отношение растворенного вещества к раствору. Это относительное количество называется концентрацией и выражается в различных величинах.
Обычно в химии концентрация выражается:
- — в массовых долях вещества, растворенного в одной весовой части раствора;
- — в процентах растворенного вещества, содержащегося в 100 г раствора;
- — в молях или эквивалентах растворенного вещества, содержащегося в 1 л раствора.
Рис.34 Соли (а)и их растворы (б)
Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
Как уже было сказано при изучении предыдущей темы, при определении состава раствора необходимо учитывать природу и количество его компонентов.
Насыщенный раствор — это раствор, который при данной температуре не может растворить большего количества вещества.
Ненасыщенный раствор — это раствор, который при данной температуре продолжает растворять вещество.
Если количество растворенного вещества очень мало, то такой раствор называется разбавленным.
Если количество растворенного вещества будет достаточно высоким, то такой раствор называется концентрированным (рис. 35).
В химии в основном пользуются ненасыщенными растворами.
Рис. 35. Взаимодействие цинка с растворами серной кислоты различной концентрации
В химической практике для выражения количества растворенного вещества широко применяются следующие величины:
1. Массовая доля 
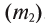
2. Процентная концентрация (С%) — выражение в процентах отношения массы растворенного вещества 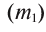
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
📺 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. Составление уравнений химических реакций.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства водыСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Вся неорганика для ЕГЭ и ОГЭ| Занятие №1Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Физические и химические свойства водыСкачать

Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Взаимодействие щелочных металлов с водойСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как понять что вещество выпадает в осадок или образуется газСкачать

Водород/химические свойства водорода/8 классСкачать

Уравнивание реакций горения углеводородовСкачать