Температура может оказывать существенное влияние на тепловой эффект химической реакции. Иногда значительное изменение температуры может изменять дажезнак теплового эффекта (переход от экзотермической реакции к эндотермической или от эндотермической к экзотермической).
Уравнение, характеризующее влияние температуры на тепловой эффект химической реакции, можно вывести следующим образом.
Пусть энтальпии исходных веществ и продуктов реакции в соответствии с реакцией (2 — 1) равны
исходных веществ продуктов реакции
Суммарная энтальпия исходных веществ выражается так:
а суммарная энтальпия продуктов реакции равна
Переход из исходного состояния в конечное, т.е. протекание реакции, приводит к изменению энтальпии
DH = H2 — H1 = Snj`HAj` — SniHAi , (2 — 6)
представляющему собой тепловой эффект реакции.
Дифференцируя равенство (2 — 6) по температуре при постоянном давлении, получим
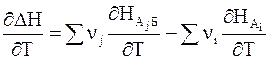
Напомним, что производная энтальпии вещества k по температуре является теплоемкостью при постоянном давлении
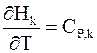
Поэтому равенство (2 — 7) приобретает следующий вид:

Уравнение ( 2 — 8), отражающее зависимость теплового эффекта от температуры, называется уравнением Кирхгофа в дифференциальной форме.
Еще один тип уравнения Кирхгофа в дифференциальной форме относится к реакциям, проводимым при постоянном объеме:
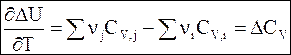
Интегрирование дифференциальных уравнений Кирхгофа в температурных пределах от Т1 до Т2 дает
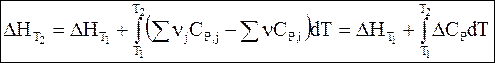
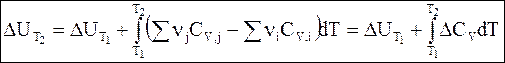
Обращаем внимание на то, что разности, заключенные в скобки, в уравнениях (2 — 10) и (2 — 11) затем обозначены символами DCP и DCV.
Уравнения (2 — 10) и (2 — 11) называются уравнениями Кирхгофа в интегральной форме. В них входят теплоты реакции при температуре Т1 ( 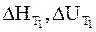
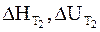
Уравнения Кирхгофа позволяют рассчитывать тепловые эффекты реакций в широком диапазоне температур, используя только справочные данные. В частности, теплоту реакции при определенной температуре можно рассчитать на основе первого или второго следствия из закона Гесса, а затем по известным из справочной литературы значениям теплоемкости тепловой эффект рассчитывается для другой температуры.
В справочниках зависимость теплоемкости веществ от температуры, как правило, приводится в виде степенных рядов следующих типов:
Диапазон температур, для которого температурная зависимость теплоемкости выполняется, четко оговаривается. Проведение вычислений при температурах, выходящих за пределы (особенно верхние) диапазона, недопустимо.
Уравнения Кирхгофа позволяют решать и некоторые качественные задачи. Например, зная, что теплоемкость пара всегда меньше теплоемкости жидкости, можно утверждать, что с повышением температуры теплота (изменение энтальпии) испарения жидкости уменьшается.
Дата добавления: 2015-07-24 ; просмотров: 2728 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект. Уравнение Кирхгофа
Тепловой эффект E процесса – это сумма количества теплоты, которую отдала система Q ‘ в этом процессе, и теплового эквивалента работы A
, элемент которой равняется:
= δ A — p d V ( 1 ) , где δ A считается элементарной полной работой системы, p d V – работой расширения.
Тогда получим, что:
Разрешается записать в виде E = — Q с Q , обозначающей количество теплоты, подведенное к системе. Согласно первому началу термодинамики:
E = — ∆ U — ∫ 1 2 p d V ( 3 ) , где ∆ U = U 2 — U 1 является изменением внутренней энергии системы, p – давлением, V – объемом.
Тепловой эффект применяется в термохимии. Тепловым эффектом химической реакции считается количество тепла, выделяемое в ходе данной реакции. При выделении теплоты реакция получила название экзотермической, при поглощении – эндотермической. Считается, что уравнение экзотермической реакции характеризуется E > 0 , а эндотермической –
Допустим, имеется химическая реакция, протекающая при V = c o n s t . Это говорит о тепловом эффекте реакции E V , который необходимо рассчитывать по формуле:
E V = U 1 — U 2 ( 4 ) .
Если прохождение этой реакции обусловлено наличием постоянного давления, то выражение ( 3 ) с использованием тепловой функции запишется:
H = U + p V ( 5 ) , E = H 1 — H 2 + ∫ 1 2 V d p ( 6 ) , то случай говорит о наличии теплового эффекта реакции с p = c o n s t :
E p = H 1 — H 2 ( 7 ) .
По уравнениям ( 4 ) , ( 5 ) видно прохождение теплового эффекта при изохорном и изобарном процессах в не зависимости от ее хода реакции (промежуточных стадий). Он определяется начальным и конечным состоянием системы. Данная формулировка получила название закона Гесса – первого закона термохимии. При твердых или жидких начальных и конечных продуктах реакции значения E p и E V практически аналогичны. Это происходит по причине неизменности системы. Реакции, имеющие газообразные составляющие, в виду существенной переменности объема тепловые эффекты E p и E V значительно отличаются, а тепловой эффект рассматривается при постоянном давлении. Наличие заданной температуры теплового эффекта E p почти не зависит от внешнего давления, которое является постоянным для данного процесса. Тепловой эффект, который определяется при t = 25 ° C и p = 760 м м р т . с т . называют стандартным.
Из закона Гесса вытекают следствия, упрощающие расчет химических реакций, в системах с p = c o n s t или V = c o n s t :
- Тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения.
- Разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равняется тепловому эффекту реакции перехода из одного начального состояния в другое.
- Разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет использовать термохимические уравнения в качестве алгебраических. Зависимость количества теплоты, которая выделяется в реакции E от теплового эффекта реакции E o , и количества вещества n b одного из участников реакции( вещества b в качестве исходного вещества или продукта реакции), выражается при помощи уравнения:
E = n b v b E 0 ( 8 ) , где v b — является количеством вещества b , задаваемое коэффициентом перед формулой вещества b в химическом уравнении.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Уравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298 К . Чтобы рассчитать тепловые эффекты, обладающие другими температурами, применяют уравнения Кирхгофа. Они записываются для изохорного E V и изобарного E p тепловых эффектов. Дифференциальная форма приобретает вид:
∂ E V ∂ T V = ∂ U 1 ∂ T V — ∂ U 2 ∂ T V = C V 1 — C V 2 = — ∆ C v ( 9 ) , ∂ E p ∂ T p = ∂ H 1 ∂ T p — ∂ H 2 ∂ T p = C p 1 — C p 2 = — ∆ C p ( 10 ) .
В ( 10 ) , ( 9 ) имеется C V , C p , являющиеся теплоемкостями веществ при соответствующих процессах.
Уравнение Кирхгофа для энтальпии изображается в интегральной форме вида:
H T 2 = H T 1 + ∫ T 1 T 2 ∆ C p T d T ( 11 ) , где ∆ C p = ∑ i v j C p B j — ∑ v i C p A i i считается разностью изобарных теплоемкостей продуктов реакции и исходных веществ. Зачастую выражение ( 11 ) применяют в химии.
Видео:Энтропия. 10 класс.Скачать

Примеры задач на вычислыние теплового эффекта
Записать выражение для расчета изменения стандартной энтальпии реакции.
Для решения задания необходимо взять за основу закон Гесса.
Именно он способствует оперированию термохимическими уравнениями как алгебраическими. Получаем, что запись принимает вид:
∆ H = ∑ j v j H B j — ∑ i v i H A i ( 1 . 1 ) , с B j , являющейся продуктами реакции, A i – исходными веществами. В задании требуют записать формулу для расчета стандартной энтальпии. Отметим, что все энтальпии, записанные уравнениями ( 1 . 1 ) , выбираются при температуре T = 298 К . Реже это фиксируется в самой формуле.
Даны химические уравнения. Произвести вычисление теплового эффекта реакции E образования 1 моль F e 2 O 3 при стандартных условиях из F e и O 2 .
1 . 2 F e + O 2 = 2 F e O , H 298 К , 1 = — 529 , 6 к Д ж ; 2 . 4 F e O + O 2 = 2 F e 2 O 3 , H ( 298 К , 2 ) = — 585 , 2 к Д ж .
По условию видно, что следует рассчитать тепловой эффект образования 1 моль оксида железа F e 2 O 3 реакции вида:
3 . 2 F e + 1 , 5 O 2 = F e 2 O 3 ( 2 . 1 ) .
Из двух данных реакций, следует сформировать реакцию ( 2 . 1 ) . Далее нужно разделить коэффициенты в ( 2 ) на 2 и произвести сложение с ( 1 ) . Отсюда:
2 F e + O 2 + 2 F e O + 0 , 5 O 2 = 2 F e O + F e 2 O 3 ( 2 . 2 ) .
Проведем преобразование (сокращение):
2 F e + 1 , 5 O 2 = F e 2 O 3 .
Было получено уравнение ( 2 . 1 ) :
Выше перечисленная последовательность действий с уравнениями привела к необходимому ( 2 . 1 ) . При проведении аналогичной схемы действий с тепловыми эффектами, будет результат эффекта реакции ( 2 . 1 ) . Протекание всех процессов обусловлено стандартными условиями, то есть при T = 298 К . Следовательно формула примет вид:
E 3 = H ( 1 ) + 0 , 5 H ( 2 ) ( 2 . 3 ) , где находящиеся в скобках цифры обозначают номер химической реакции. Рассчитаем и получим:
E 3 = — 529 , 6 + 0 , 5 · — 585 , 2 = — 822 , 2 ( к Д ж ) .
Ответ: тепловой эффект реакции равняется — 822 , 2 к Д ж .
Видео:Физика 10 класс. Агрегатные (фазовые) переходы.Скачать

Закон Кирхгофа
В термодинамических таблицах содержатся стандартные энтальпии (изобарные тепловые эффекты, изобарные теплоты) образования химических соединений из простых веществ мри 25°С. При температурах, отличных от 25°С, тепловые эффекты в общем случае будут иными. Причем для различных реакций влияние температуры на тепловой эффект неодинаково. Только в одном случае, когда суммы теплоемкостей исходных веществ и продуктов реакции равны, температура не влияет на тепловой эффект реакции. Чем сильнее отличаются теплоемкости исходных веществ от теплоемкостей продуктов реакции, тем сильнее сказывается влияние температуры на тепловой эффект реакции.
Дифференцируя по температуре (при постоянном давлении) равенство

Здесь АН — тепловой эффект химической реакции, а индексы 1 и 2 относятся соответственно к продуктам реакции и исходным веществам.
Здесь полезным может быть напоминание определения такой характеристики вещества, как теплоемкость. Теплоемкость (с) — количество теплоты, которое надо подать системе, чтобы увеличить ее температуру на 1 градус. Единица измерения теплоемкости в системе СИ — Дж/К. Удельная теплоемкость — теплоемкость единицы массы вещества. Единица измерения удельной теплоемкости в системе СИ — ДжДкг • К). В химии теплоемкость принято относить к 1 молю вещества (удельная теплоемкость); при этом ее единица измерения — Дж/(моль • К).
Так как производная (dH/dT)p является теплоемкостью системы при постоянном давлении
то выражение (2.14) можно переписать
или, вводя обозначения

Здесь Аср — изменение изобарной теплоемкости системы в химической реакции при постоянной температуре.
Для реакции, представленной в общем виде,
величина Аср будет равна

Здесь а, b, с и d — стехиометрические коэффициенты в уравнении реакции с участием веществ А, В, С и D.
Для изохорного процесса можно получить таким же путем аналогичное выражение:

где
Уравнения (2.14) и (2.15) выражают закон Кирхгофа в дифференциальной форме, который может быть сформулирован следующим образом: температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса.
Практически приходится чаще использовать закон Кирхгофа в интегральном виде. Для того чтобы получить это выражение, разделим переменныe и проинтегрируем выражения (2.15) и (2.17). Тогда тепловые эффекты при температурах Т1 и T2 будут связаны следующими выражениями:
Если пренебречь изменением теплоемкостей исходных веществ и продуктов в интервале температур от T1 до T2, то величины Аср и Acv можно вынести за знак интеграла как константы. При этом выражения (2.18) и (2.19) упростятся до следующих:
Если в качестве Тх выбрать стандартную температуру (Тх = 298 К), то зависимости теплового эффекта от температуры ((2.18)—(2.21)) будут выглядеть следующим образом ((2.18а)—(2.21а)):
Пример 2.4. Определить тепловой эффект ДН2 реакции
при 75°С, зная, что при t = 17°С АЯ, = -549,4 кДж/.моль (С6Н6), а средние мольные изобарные теплоемкости бензола и ацетилена в этом интервале температур соответственно равны 134,4 и 43,8 Дж/К.
Решение.
Пользуясь уравнением (2.16), определяем
Применяя уравнение (2.20) и выражая АН2, получаем
Если необходимо учесть изменение теплоемкости с температурой, следует воспользоваться приближенными эмпирическими уравнениями вида
Здесь а, b и с (или с’) — эмпирические коэффициенты, которые приведены для каждого вещества в термодинамических таблицах. (Вообще теплоемкость может быть выражена формулами, включающими температуру в любых степенях.) Изменение теплоемкости в химической реакции Аср будет описываться следующим выражением:

В этих выражениях а, Ь, с и d, стоящие в начале каждого из произведений, — коэффициенты в уравнении химической реакции
а(А), b(А), с(А), и с'(А) — упомянутые выше коэффициенты для теплоемкости в уравнениях (2.22), (2.23) для вещества А;
a(В), b(В),с(В) и с'(В) — эти же коэффициенты для вещества В;
a(С), b(С), с(С) и с'(С) — эти же коэффициенты для вещества С;
a(D), b(D), c(D) и c'(D) — эти же коэффициенты для вещества D.
Подставляя выражение (2.24) в уравнение (2.15) и интегрируя от T1 до Т2, получаем выражение для теплового эффекта ДН(Т2) с учетом зависимости изобарных теплоемкостей от температуры
Пример 2.5. Найти тепловой эффект химической реакции АН
при 923 К, используя следующие данные по теплоемкости:
Стандартный тепловой эффект реакции равен -1,698 • 10° Дж.
Решение.
Найдем коэффициенты Аа, Ah и Ас’ для данного химического уравнения.
Видео:Задача недели. Химия. №43. Законы РауляСкачать

Закон Лавуазье — Ломоносова — Лапласа
Тепловой эффект образования сложного вещества равен по величине и противоположен по знаку тепловому эффекту процесса разложения этого вещества. Или в более общей формулировке — тепловой эффект прямой реакции равен по абсолютной величине тепловому эффекту обратной реакции, но с противоположным знаком.
Иначе говоря, осуществив вначале какой-либо процесс, а затем, проведя противоположный (обратный) процесс, мы возвращаем систему в исходное состояние с той же внутренней энергией, какую она имела. Например, образование одного моля воды сопровождается выделением 285,84 кДж
В результате этой реакции энергосодержание системы уменьшилось на АН°= -285,85 кДж.
Разложение одного моль жидкой воды на исходные составляющие — водород и кислород — потребует подвода извне того же количества энергии, т.е. А// 0 = +285,85 кДж в соответствии с уравнением:
Таким образом, энтальпия образования вещества равна по абсолютной величине энтальпии разложения, по имеет противоположный знак:
Следствием из этого закона является положение: чем больше теплота образования вещества, тем оно более устойчиво, т.е. прочнее.
Например, если известно, что теплота образования твердого оксида скандия (Sc203 (кр)) АН° = 1907,4 кДж/моль, а оксида ртути (HgO (кр)) АН° = -90,4 кДж/моль, то ясно, что оксид скандия очень прочное соединение, и для разложения его на простые вещества потребуются очень высокие температуры. В то же время оксид ртути HgO (кр) разлагается при температуре около 100°С на металлическую ртуть и кислород.
Знание стандартных энтальпий образования соединений и применение закона Лавуазье — Ломоносова — Лапласа позволяет в какой-то степени оценить реакционную способность веществ. Непрочные соединения обычно более реакционноспособные вещества. Л в отношении простых веществ можно сказать, что чем более экзотермична реакция (больше выделяется энергии) с их участием, тем они химически более активны. Вероятность протекания той реакции выше, в которой выделяется больше энергии.
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Тепловые эффекты фазовых превращений
Фазовые превращения часто сопутствуют химическим реакциям. Однако тепловые эффекты таких превращений, как правило, меньше тепловых эффектов химических реакций. Ниже приведены примеры термохимических уравнений некоторых фазовых превращений.
Тепловой эффект реакции зависит от агрегатных состояний и модификаций исходных веществ и продуктов реакции. И если, например, взаимодействие вода с водородом, которое протекает по уравнению 1/212 + 1/2Н2 = HI, может сопровождаться или поглощением теплоты Д// ( 298= 25,94 кДж/моль, или ее выделением Д//298 = -5,18 кДж/моль, то это значит, что в первой реакции участвует кристаллический иод, а во второй — газообразный:
🔥 Видео
Энтальпия реакции. Решение задачи.Скачать

Энергия ГиббсаСкачать

Правило октета - важнейшее правило в химии!Скачать

Фазовые равновесия | ФизхимияСкачать
Урок 12. Решение задач на энтропию.Скачать

2 1 Первый закон термодинамики ЭнтальпияСкачать

Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

ЭнтальпияСкачать

Химическая термодинамикаСкачать

Пара дешевых Xeon против нового Threadripper в Ansys - стоит ли разница переплаты?Скачать

Переходные процессы | Классический метод расчета переходных процессов. Теория и задачаСкачать

Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

Лабораторная работа 2. ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ ХИМИЧЕСКОГО ПРОЦЕССАСкачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать



























