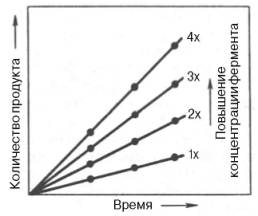
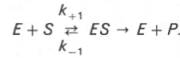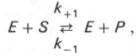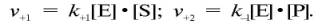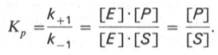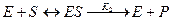Из приведенного ранее материала вытекает важное заключение: одним из наиболее существенных факторов, определяющих скорость ферментативной реакции, является концентрация субстрата (или субстратов) и продукта (продуктов). При постоянной концентрации фермента скорость реакции постепенно увеличивается, достигая определенного максимума (см. рис. 4.12, 4.13), когда дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т.е. все молекулы фермента связаны с субстратом. Ограничивающим скорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (Vmax) и значения константы Михаэлиса (Km) (см. рис. 4.13; 4.14).
Рис. 4.19. Зависимость скорости реакции от концентрации фермента в присутствии насыщающих концентраций субстрата.
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента (рис. 4.19). Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции.
Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента. Как было отмечено, фермент является одной из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который далее подвергается распаду на продукт и свободный фермент:
Если упростить это уравнение, исключив промежуточный ES-комплекс:
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента:
Как видно, константа равновесия (Kр) ферментативной реакции не зависит от концентрации фермента. Определяя скорость и направление химической реакции, фермент тем не менее не оказывает влияния на конечные (равновесные) концентрации реагирующих молекул и продуктов, определяющих величину константы равновесия.
Видео:Кинетика. О чем говорят графики. БиохимияСкачать

Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен.
Ферменты
Ферменты — это биокатализаторы, образующиеся в клетке, и представляющие собой простые или сложные белки. Слово фермент происходит от латинского — fermentum -закваска; другое название ферментов — энзимы — происходит от греческого- enzyme — в дрожжах. В 30-х годах XX века некоторые ферменты были выделены в высокоочищенном кристаллическом состоянии. По химической природе кристаллы оказались белковыми.
История изучения ферментов тесно переплетается с историей катализа. Катализом называют ускорение химической реакции, вызванное добавлением малых нестехиометрических количеств катализатора. Катализатор ускоряет реакцию не просто своим присутствием, а взаимодействием с веществом, подвергающимся превращению, но при этом регенерируется в ходе реакции. Ферменты — биокатализаторы — не являются исключением.
Ферменты — это белки, и подобно всем белкам, они могут избирательно присоединять определенные вещества — лиганды. Лиганд, подвергающийся химическому превращению под действием фермента, называют субстратом (S), продукты (P) реакции освобождаются в раствор. Ферменты являются наиболее изученным классом белков. Это объясняется той важной ролью, которую играют ферменты: любое химическое превращение в организме происходит с их участием. К тому же, ферменты, в отличие от других белков, сравнительно легко обнаруживать и измерять их количество по катализируемой реакции.
Особенности ферментов как биокатализаторов
Ферменты как катализаторы имеют ряд особенностей:
Высокоэффективные катализаторы — ускоряют реакцию в 10 10 раз:
1 моль каталазы при 0 0 С обеспечивает разложение за 1 мин 5 млн. H2O2, в то время как 1 моль Pt катализирует только 250- 2000 молекул H2O2.
Высокоспецифичны — катализируют, как правило, реакцию одного типа или воздействуют на один субстрат. Это наиболее важное свойство ферментов.
Эффективно работают в мягких условиях.
Синтез аммиака по реакции: N2 + 3H2 = 2NH3 проводят при t = 500-550 0 C, p = 10 7 -10 8 Па, ферменты, содержащиеся в бобовых культурах обеспечивают протекание подобного процесса при обычных условиях.
Ферменты — это катализаторы, работу которых можно регулировать.
Классификация ферментов по типу катализируемой реакции и номенклатура ферментов
В номенклатуре ферментов, введенной Международным биохимическим союзом (IUB) используется принцип классификации ферментов по типу катализируемой реакции и ее механизму. Основные принципы номенклатуры следующие:
Выделяют 6 классов ферментов, катализирующих 6 типов реакций:
Оксидоредуктазы.
Трансферазы.
Гидролазы.
Лиазы
Изомеразы.
Лигазы.
В каждом из 6 классов имеется несколько подклассов (от 4 до 13). Систематическое название фермента состоит из 2-х частей: названия субстрата, типа катализируемой реакции и части слова -аза.
Активный центр ферментов
Ферменты (с точки зрения строения) – это глобулярные белки, которые имеют в глобуле полость или щель определенных размеров – активный центр фермента.
Общие черты активного центра фермента:
а.ц.ф. – небольшая часть белковой молекулы;
а.ц.ф. – имеет строго определенную трехмерную структуру и размеры;
а.ц.ф. – формируется из аминокислотных остатков, удаленных в первичной структуре, но сближенных в третичной структуре;
а.ц.ф. – состоит из связывающего и каталитического участков.
Если белок сложный, то простетическая группа входит в состав а.ц. фермента.
Вся белковая молекула укладывается определенным образом в пространстве, образуя единственно возможный (термодинамически устойчивый) вариант третичной структуры данного белка, а следовательно и уникальный активный центр данного фермента.
Причины высокой каталитической активности.
Фермент поддерживает микроокружение субстрата в активном центре в состоянии отличном от его состояния в водной среде.
Располагает реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга, чтобы обеспечить оптимальное протекание реакции.
За счет кооперативного взаимодействия субстрата и нескольких остатков аминокислот в активном центре фермент снижает энергию активации данной реакции.
Субстратная специфичность
Структура активного центра фермента комплементарна структуре субстрата, т.е. соответствует ему по 1) форме, 2) размерам и 3) способности взаимодействовать. Это является причинами высокой специфичности ферментов.
Первоначально модель активного центра, предложенная Э.Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ-замок» – модель «жесткой матрицы». Однако эта модель объясняла лишь абсолютную субстратную специфичность.
Кошланд предложил модель индуцированного соответствия. Главная черта этой модели – гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подготовленным под форму молекулы-субстрата. В модели Кошланда субстрат индуцирует конформационные изменения фермента, и лишь в результате этих аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связи с субстратом и катализа. Эта модель позволяет объяснить относительную специфичность фермента.
Каждый фермент катализирует не любые из всех возможных путей превращения субстрата, а какое-либо одно. Это свойство называется специфичностью пути превращения.
Кинетика ферментативных реакций
Зависимость скорости ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен.
Любую ферментативную реакцию схематично можно описать следующим образом:
Поведение многих ферментов при изменении концентрации субстрата описывает уравнение Михаэлиса-Ментен:
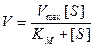
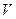
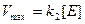
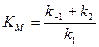
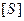
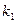
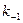
Влияние концентрации субстрата на скорость ферментативной реакции, описываемое этим уравнением, можно изобразить графически:
 |
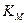
Некоторые ферменты требуют высокой концентрации субстрата для достижения скорости, равной максимальной, другие (например, гексокиназа) достигают 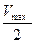
Таблица.Значения констант Михаэлиса для некоторых ферментов.
| Фермент | Субстрат | 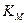 |
| каталаза | H2O2 | |
| гексокиназа (мозг) | D-глюкоза | 0,05 |
| D-фруктоза | 1,5 | |
| АТФ | 0,4 | |
| карбоангидраза | HCO3 — | |
| химотрипсин | Gly-Tyr-Gly | |
| N-бензоилтирозинамид | 2,5 |
Видео:Активность фермента (Enzyme activity). Влияние температуры, рН, концентрации субстратаСкачать

Влияние pH среды
Активность ферментов зависит от pH раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение pH, при котором наблюдается его максимальная активность. Отклонение от оптимального значения pH приводит к понижению ферментативной активности.
Влияние pH на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. Даже небольшой сдвиг реакции среды изменяет заряд кислотных и основных групп фермента и субстрата и конформацию активного центра фермента, вследствие чего резко понижается каталитическая активность молекулы фермента. Зависимость активности фермента от pH среды показана на рис. 6.4.
Рис. 6.4. Зависимость скорости ферментативной реакции (1/) от pH среды
Видео:Биохимия | Кинетика ферментативных реакций: константа Михаэлиса и график Лайнуивера-БеркаСкачать

Влияние концентрации фермента и субстрата
Если в физиологической среде много субстрата и мало ферментного белка, то скорость ферментативной реакции будет низкой, поскольку каждая молекула фермента способна катализировать превращение определенного количества субстрата в единицу времени. При увеличении концентрации фермента в среде скорость ферментативной реакции будет возрастать до тех пор, пока достаточно субстрата для полной реализации молекулярной активности фермента. При дальнейшем увеличении концентрации фермента скорость реакции уже не возрастает.
Скорость ферментативной реакции зависит также от концентрации субстрата в физиологической среде при условии, что количество фермента остается неизменным. Если в среде находится определенное количество фермента и в нее добавляется субстрат, то в начале скорость реакции будет возрастать пропорционально увеличению концентрации субстрата. При дальнейшем увеличении концентрации субстрата темпы нарастания скорости реакции замедляются, и при определенном количестве субстрата в среде скорость реакции достигает максимального уровня, при котором полностью реализуется молекулярная активность фермента (рис. 6.5).
Рис. 6.5. Зависимость скорости реакции от концентрации субстрата:
V — скорость ферментативной реакции; [S] — концентрация субстрата;
Ушах — максимальная скорость реакции при данной концентрации фермента
в оптимальных условиях проведения реакции; Кт — константа Михаэлиса
Зависимость скорости ферментативной реакции (V) от концентрации субстрата ([S]) выражается следующим уравнением (уравнение Михаэлиса — Ментен):
где Vmax — максимальная скорость реакции при высокой концентрации субстрата; [S] — концентрация субстрата; Кт — константа Михаэлиса.
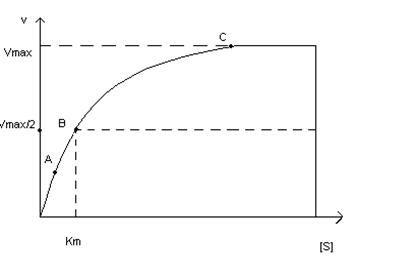
Константа Михаэлиса выражает сродство фермента к субстрату и служит важной характеристикой ферментного белка. Чем меньше константа Михаэлиса, тем выше молярная активность фермента и тем интенсивнее происходит ферментативный катализ. В случае, когда скорость реакции равна половине максимальной, Кт = [S]. Таким образом, константа Михаэлиса численно равна концентрации субстрата, при которой достигается половина максимальной скорости.
Уравнение Михаэлиса — Ментен — основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
📹 Видео
ФЕРМЕНТЫ 5.Основы ферментативного катализа. Кинетика ферментативных реакций.Скачать

USMLE Step 1 - Фармакология: кинетика ферментов | уравнение Михаелиса - Ментена и не толькоСкачать

9. Что определяет скорость ферментативной реакции?Скачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

ФЕРМЕНТАТИВНАЯ КИНЕТИКА: Занятие 1. Вывод уравнения Михаэлиса-МентенСкачать

Асеев В. В. - Основы энзимологии - Кинетика ферментативных реакцийСкачать

Ферментативная кинетикаСкачать

Этапы ферментативного катализа. Взаимодействие ферментов с несколькими субстратамиСкачать

Зависимость скорости реакции от концентрации реагентовСкачать

Разбираем Michaelis-Menten and Lineweaver-Burk plots.Скачать
Регуляция активности ферментов. 11 класс.Скачать

Факторы и условия, влияющие на активность ферментов. 10 класс.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Асеев В. В. - Основы энзимологии - Ферментативная кинетика Уравнение Михаэлиса-МентенСкачать
Биохимия. Лекция 22. Ферменты. Part 2.Скачать

Строение активного центра. Теории взаимодействия фермента и субстратаСкачать

Л.18 | ФЕРМЕНТАТИВНЫЕ РЕАКЦИИ | ФЕРМЕНТЫ | ОБЩАЯ БИОЛОГИЯ ЕГЭСкачать