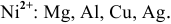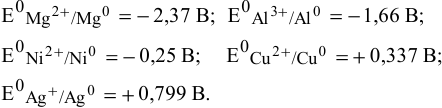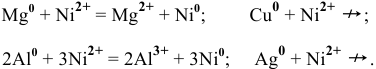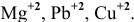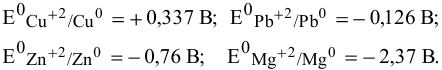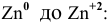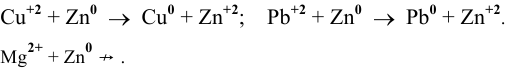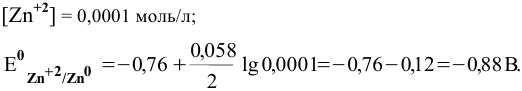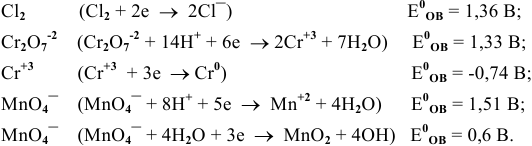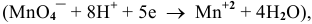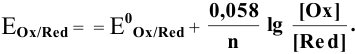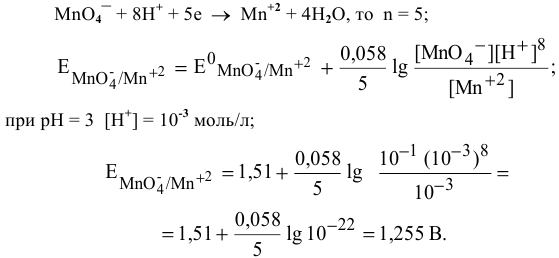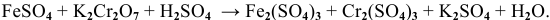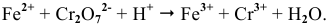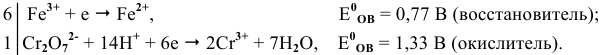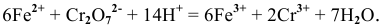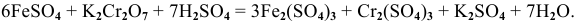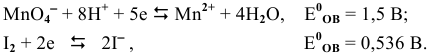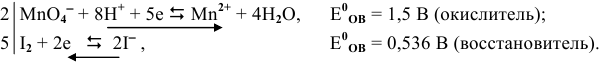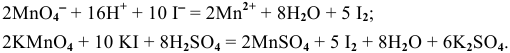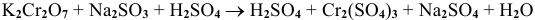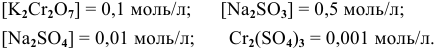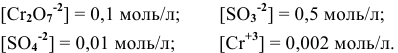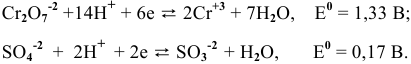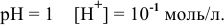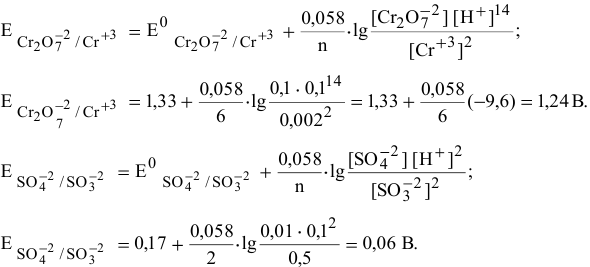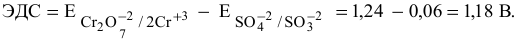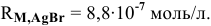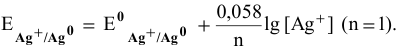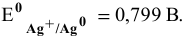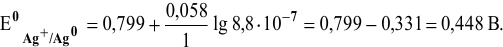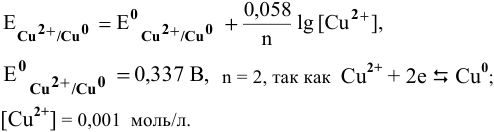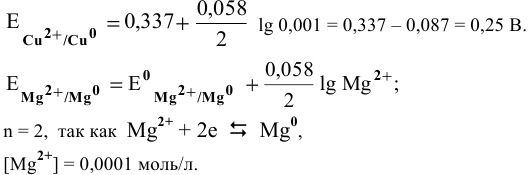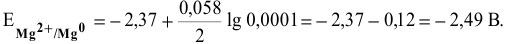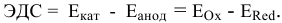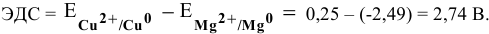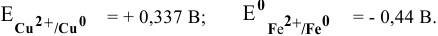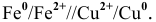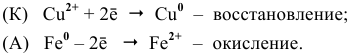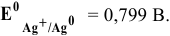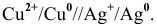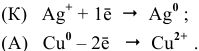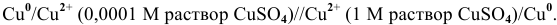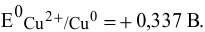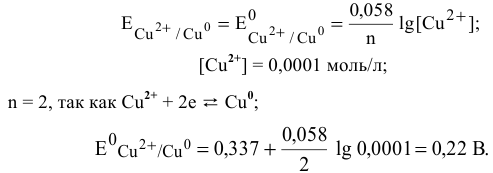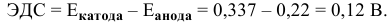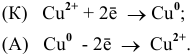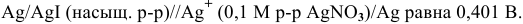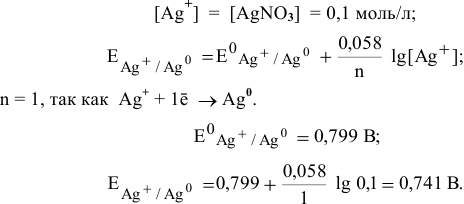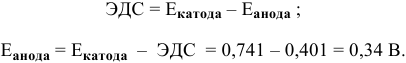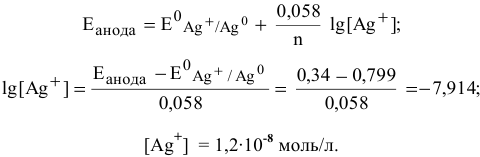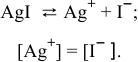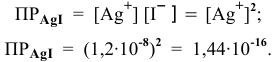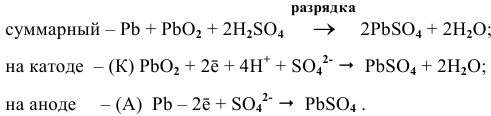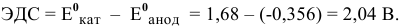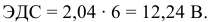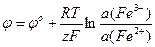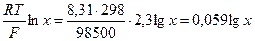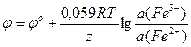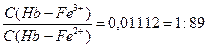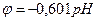Пример 1
Расчет стандартного электродного потенциала по
известным значениям ЭДС и электродного потенциала другого электрода.
Стандартная ЭДС(298К) гальванического элемента, анодом которого является цинк, опущенный в раствор сульфата цинка, равна 0,47 В. Вычислите стандартный электродный потенциал другого электрода. Как изменяется масса цинковой пластинки в ходе работы гальванического элемента?
Решение. По определению стандартная ЭДС равна разности стандартных редокс-потенциалов:
Е 0 = jr 0 (ox) — jr 0 (red)
Значение jr 0 (Zn 2+ /Zn)найдем в справочной таблице ( ). Оно равно –0,76 В.
Вычислим электродный потенциал катода:
Это значение стандартного потенциала редокс-пары Со 2+ /Со.
Поскольку в гальваническом элемента протекает реакция
Со 2+ + Zn Û Со + Zn 2+ ,
масса цинковой пластинки уменьшается.
Пример 2
Определение направления редокс-процесса в стандартном состоянии
Бромная вода – часто используемый в лабораторной практике реактив. Какие из перечисленных ионов можно окислить бромной водой:
а) золота(I), б) олова(II), в) кобальта(II)?
Решение. В стандартном состоянии редокс-процесс может протекать самопроизвольно, если значение разности потенциалов предполагаемого окислителя и предполагаемого восстановителя положительно: Djr = Djr о (ox)- Djr о (red) > 0.
По условию задачи бромная вода является окислителем, следовательно, золото(I), олово(II), кобальт(II)- восстановителями. Решим вопрос, будут ли самопроизвольно протекать следующие реакции:
а) Br2 + Au + = 2Br — + Au 3+
б) Br2 + Sn 2+ = 2Br — + Sn 4+
в) Br2 + Co 2+ = 2Br — + Co 3+
Стандартные редокс-потенциалы равны (табл. ):
jr о (Br2/2Br — ) = 1,09 В jr о (Sn 4+ /Sn 2+ ) = 0,15 В
jr о (Au 3+ /Au + ) = 1,41 В jr о (Co 3+ /Co 2+ ) = 1,95 В
Рассчитаем величину Djr каждой редокс-пары:
а) Djr = Djr о (Br2/2Br — ) — Djr о (Au 3+ /Au + ) = 1,09 -1,41 = -0,32 В
б) Djr = Djr о (Br2/2Br — ) — Djr о (Sn 4+ /Sn 2+ ) = 1,09 — 0,15 = 0,94 В
в) Djr = Djr о (Br2/2Br — ) — Djr о (Co 3+ /Co 2+ )= 1,09 — 1,95 = -0,86 В
Ответ: Реакции а) и в) самопроизвольно протекать не будут, т.к. Djr 0.
Пример 3
Определение направления редокс-процесса в состоянии, отличающемся от стандартного, с участием редокс-систем первого типа
В водном растворе концентрации ионов ртути(II) и железа (III) равны 0,01 моль/л, а концентрация ионов железа(II) равна 0,001 моль/л. В каком направлении будет протекать процесс в системе, содержащей ионы в указанных концентрациях и избыток металлической ртути? Т=298 К.
Решение. Запишем уравнения реакций в ионном виде, направление которых надо определить:
Hg + 2Fe 3+ = Hg 2+ + 2Fe 2+ — процесс окисления ртути
Hg 2+ + 2Fe 2+ = Hg + 2Fe 3+ — процесс окисления ионов железа(II)
n=2 — для редокс-системы Hg 2+ /Hg;
n=1 – для редокс-системы Fe 3+ /Fe 2+ .
Для второй редокс-системы активность восстановленной формы (ртути) принимается равной единице.
Стандартные редокс-потенциалы обеих систем равны(табл. ):
φ 0 r(Fe 3+ /Fe 2+ ) = 0,77 В; φ 0 r(Hg 2+ /Hg) =0,85 В
Зависимость редокс-потенциала от соотношения концентраций описывает уравнение Нернста (8.2). Преобразуем уравнение Нернста, введя коэффициент перехода от натуральных логарифмов к десятичным (2,303). При температуре 298К значение множителя 2,303RT/F равно 0,0591 В (табл.).
φr(Fe 3+ /Fe 2+ ) = φ 0 r(Fe 3+ /Fe 2+ ) + ¾¾¾ lg ¾¾¾ ;
Рассчитаем редокс-потенциалы данных систем, подставляя известные значения концентраций и стандартных редокс-потенциалов:
φr(Fe 3+ /Fe 2+ ) = 0,771 + 0,0591× lg ¾¾¾ = 0,830 В
φr(Hg 2+ /Hg)= 0,850 + ¾¾¾ × lg 0,01 = 0,791 B
Определим значение Djr для каждого случая:
Djr = φr(Fe 3+ /Fe 2+ )- φr(Hg 2+ /Hg) = 0,830 — 0,791 = 0,0390 > 0
Djr = φr(Hg 2+ /Hg) — φr(Fe 3+ /Fe 2+ ) = 0,791 – 0,830 = — 0,039 3+ /Fe 2+ и будет происходить процесс окисления ртути: 2Fe з+ + Hg ®2Fe 2+ + Hg 2+ . (Попутно заметим, что данная реакция используется для обезвреживания пролившейся ртути: она заливается раствором хлорида железа (III)).
Пример 4
Определение направления редокс-процесса в состоянии, отличающемся от стандартного, с участием редокс-систем второго типа
Определите, возможна ли реакция между перманганатом калия и бромидом калия в растворе при рН=2, если концентрации равны:перманганата калия 0,01 моль/л; иона марганца(II) 0,0001 моль/л; бромид-иона и брома по 0,01 моль/л. Т=298 К.
Решение. Запишем уравнение реакции, направление которой надо определить. В кислой среде (рН=2 – по условию задачи) перманганат-ион MnO4 — восстанвливается до Mn 2+ , а бромид-ион Br — — окисляется до брома.
Определим число электронов, принимающих участие в полуреакциях:
MnO4 — + 8Н + + 5 ē Û Mn 2+ + 4Н2О; n=5, m=8
2Br — — 2ē Û Br2; n=2
Вычислим редокс-потенциалы обеих редокс-систем, содержащихся в растворе, по уравнению Нернста (8.6) с учетом коэффициента 2,303:
Стандартные редокс-потенциалы обеих систем равны (табл. ):
φr 0 (MnO4 — + 8Н + /Mn 2+ + 4Н2О) = 1,51 В
φr 0 (Br2/2Br — ) = 1,09 В
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В (табл. ).
Вычислим редокс-потенциалы обеих редокс-систем, подставляя в уравнение Нернста известные значения концентраций и стандартных редокс-потенциалов:
0,0591 0,01·(10 -2 ) 8
φr 0 (Br2/2Br — ) = 1,09 +0,0591 lg 0,01 = 1,09 В
Реакция между перманганатом калия и бромидом калия может протекать, т.к.
Ответ: реакция между перманганатом калия и
бромидом калия может протекать самопроизвольно,
т.к. разность редокс-потенциалов положительна.
Пример 5
Определение глубины протекания редокс-процесса для стандартного состояния
Сопоставьте глубину протекания процесса восстановления ионов серебра металлическим цинком: а) если серебро находится в составе аквакомплекса;
б) если серебро находится в составе амминокомплекса.
Решение. Убыль энергии Гиббса, показывающая глубину протекания процесса, связана с разностью потенциалов (Djr ) уравнением (8.4). При условии, что множитель nF для сравниваемых реакций имеет одинаковое значение, о глубине протекания процесса можно судить по значению величины Djr.
Для обеих реакций n = 2.
Стандартные редокс-потенциалы этих редокс-пар найдем в табл. .
φr 0 (Ag + /Ag) = 0,80 В
φr 0 (Zn 2+ /Zn) = -0,76 В.
Определим, будут ли самопроизвольно протекать реакции, рассчитывая значения Djr для каждого редокс-процесса:
а) Djr = φr 0 (Ag + /Ag) — φr 0 (Zn 2+ /Zn) = 0,8 — (-0,76) = 1,56 В
Ответ: глубина протекания процесса восстановления ионов серебра, находящихся в растворе аквакомплекса, цинком больше глубины протекания процесса восстановления ионов серебра, находящихся в составе аммиачного комплекса металлическим цинком, т.к. 1,56 В > 1,41 В.
Пример 6
Расчет константы равновесия редокс-процесса
Рассчитайте константу равновесия реакции окисления ионов олова(II) до олова (IV) в водной среде ионами железа(Ш) при Т=298 К.
Решение.Для равновесия
Sn 2+ + 2Fe 3+ Û Sn 4+ + 2Fe 2+
n=2 – для редокс-системы Sn 4+ /Sn 2+ ;
n=1- для редокс-системы Fe 3+ /Fe 2+
Число электронов, принимающих участие в этом редокс-процессе равно двум, т.к. число принятых электронов равно числу отданных.
Воспользовавшись значением стандартных редокс-потенциалов систем Fe 3+ /Fe 2+ и
Sn 4+ /Sn 2+ (табл. ), вычислим значение стандартной ЭДС гальванического элемента:
Е 0 = jr 0 ( Fe 3+ /Fe 2+ ) — jr 0 (Sn 4+ /Sn 2+ ) = 0,77 – 0,15 =0,62 В.
Константу равновесия редокс-процесса рассчитаем, используя уравнение (8.5) с учетом коэффициента 2,303:
При температуре 298К значение множителя 2,303RT/F равно 0,0591 В(табл. ).
Подставляя известные величины в это уравнение, вычислим:
__________________
Пример 7
Расчет константы редокс-процесса
Известно, что в ходе биологического окисления протекает реакция
НАД-Н + ФП + H + Û ФП-Н2 + НАД +
НАД + — окисленная форма кофермента,
НАД-Н – восстановленная форма кофермента;
ФП – флавопротеид-1, фермент, «отнимающий» водород у НАД-Н).
Вычислите константу равновесия при 37 о С.
Решение. Формальнные потенциалы биологических редокс-систем ФП/ФП-Н2 и НАД + /НАД-Н найдем в табл. . Они равны –0,32 В и -0,06 В, соответственно. Для записанной выше формы уравнения окислителем является ФП, а восстановителем – НАД-Н. Вычислим значение стандартной ЭДС гальванического элемента:
Число электронов, принимающих участие в этом редокс-процессе, равно двум.
Константу равновесия редокс-процесса рассчитаем, используя уравнение (8.5) с учетом коэффициента 2,303. При температуре 298 К значение множителя 2,303RT/F равно 0,0591 В (табл. ).
Подставляя известные величины в уравнение (8.5), вычислим:
lg K = ¾¾¾¾¾= 10 8, 8 = 6,29×10 8
Пример 8
Расчет редокс-потенциала для редокс-системы с заданным соотношением
активностей окисленной и восстановленной форм
Вычислите теоретическое значение редокс-потенциала для системы, содержащей по 10 мл растворов гексацианоферрата(Ш) калия и гексацианоферрата (П) калия с концентрациями 0,01 моль/л и 0,5 моль/л; температура равна 298 К.
Решение: Зависимость редокс-потенциала от соотношения активностей описывает уравнение Нернста (8.2):
Перейдем от натурального логарифма к десятичному:
где jr 0 – стандартный редокс-потенциал, табличная величина при 298 К.
Последней формулой пользоваться удобнее, т.к значение множителя, стоящего перед логарифмом, приведено в табл. при разных температурах.
Для разбавленных растворов можно считать, что ионная сила равна нулю (I® 0), тогда коэффициенты активности (f(ox) и f(red)) можно считать равными единице,
а активности окисленной и восстановленной форм можно приравнять концентрациям. Число электронов, принимающих участие в элементарном редокс-процессе, определяется полуреакцией:
Стандартный редокс-потенциал данной редокс-системы равен 0,36 В(табл. ).
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
При сливании растворов равных объемов концентрация каждого компонента уменьшается вдвое. Вычислим концентрации окисленной и восстановленной форм после смешения:
с(ox) = 0,01:2 = 0,005 моль/л; c(red) = 0,5:2 = 0,25 моль/л.
Подставляя в уравнение [ ]вычисленные значения концентраций и справочную величину стандартного редокс-потенциала, найдем
jr = 0,36 +0,0591 lg ¾¾¾ = 0,259 В
Пример 9
Расчет отношения активностей окисленной и восстановленной форм
редокс-системы по известному значению редокс-потенциала
Редокс-потенциал системы, состоящей из платины, опущенной в раствор, содержащий смесь хлорида железа(П) и хлорида железа(Ш), при 298 К равен 0,783 В. Вычислите отношение концентраций ионов Fe 3+ и Fe 2+ .
Решение. Число электронов, принимающих участие в редокс-процессе, определяется полуреакцией:
В соответствии с модифицированным уравнением Нернста (8.2):
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
Преобразуем данное выражение:
где jr 0 (0,77 В) — значение стандартного потенциала редокс-ситемы Fe 3+ /Fe 2+ (табл. ).
с(Fe 3+ ) 0,783 –0,770
Ответ: отношение концентраций ионов Fe 3+ и Fe 2+ равно 1,66.
Пример 10
Расчет отношения активностей окисленной и восстановленной форм редокс-системы по известному изменению энергии Гиббса реакции
Изменение энергии Гиббса (298 К) реакции между двумя редокс-парами:
равно –200 кДж/моль. Вычислите отношение активностей [Mо(CN)6] 3- /[Mо(CN)6] 4- для исходного состояния, если отношение активностей [Cr(CN)6] 3- /[Cr(CN)6] 4- в исходном состоянии было равно 5.
Решение. Запишем уравнение реакции между данными редокс-парами:
В уравнение изотермы Вант-Гоффа (2.11)
По определению стандартная ЭДС равна разности стандартных редокс-потенциалов:
где jr 0 (0,73 В) — значение стандартного потенциала редокс-системы
[Мо(CN)6] 3- /[Мо(CN)6] 4- , jr 0 (-1,28В) — значение стандартного потенциала редокс-системы[Cr(CN)6] 3- /([Cr(CN)6] 4- (табл. ).
Рассчитаем отношение активностей [Mо(CN)6] 4- /[Mo(CN)6] 3- :
-200000 Дж/моль = -1× 2,01 В × 96480Кл/моль + 2478 ln¾¾¾¾¾¾¾¾
Тогда отношение активностей [Mо(CN)6] 3- /[Mо(CN)6] 4- = 1/0,0172 = 58,1
Пример 11
Расчет редокс-потенциала системы II типа
Концентрация ацетат- и пируват-ионов в системе равны между собой; чему станет равным редокс-потенциал этой биологической редокс-системы при рН=6? Т=298 К.
Решение. Воспользуемся уравнением Нернста (8.6) для редокс-систем второго типа:
2,303 RT a(ox)a m (H + )
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
Определим число электронов, принимающих участие в полуреакции:
ацетат-ион + СО2 + 2Н + + 2ē Û пируват-ион
Формальный редокс-потенциал этой редокс-системы равен –0,70 В(табл. ).
Ранее полученное выражение преобразуем:
Поскольку по условию задачи c(ox) = c(red), a при низком значении ионной силы можно считать, что a(ox) = a(red), то предыдущее выражение можно упростить:
При температуре 298К значение множителя 2,303RT/F равно 0,0591 В (табл. ).
Подставляя известные значения формального редокс-потенциала и рН, вычислим редокс-потенциал этой системы:
φr = φ 0 r – 0,0591рН = — 0,70-0,0591× 6 = — 1,05 В
Ответ: при рН=6 редокс-потенциал системы станет равным -1,05 В.
Пример 12
Расчет изменения редокс-потенциала при
введении в редокс-систему окислителя или восстановителя
Концентрации лактат- и пируват-ионов в буферном растворе равны между собой; рН=7. Как изменится потенциал при окислении 1/10 части лактат-ионов до пируват-ионов?
Решение. Воспользуемся модифицированным уравнением Нернста (8.6) для редокс-систем второго типа:
2,303 RT а(ox)а m (H + )
При температуре 298К значение множителя 2,303RT/F равно 0,0591 В(табл. ).
Определим число электронов, принимающих участие в полуреакции:
пируват-ион + 2Н+ +2ē Û лактат-ион
Формальный редокс-потенциал этой редокс-системы равен – -0,19 В (табл. ).
Преобразуем последнее выражение аналочично примеру 8-11:
Подставляя известные значения формального редокс-потенциала и рН, вычислим редокс-потенциал этой системы до процесса окисления:
При окислении 1/10 части лактат-ионов величина концентрации окисленной формы увеличится на 1/10, а величина концентрации восстановленной формы уменьшится на 1/10. Тогда:
F а(red)-0,1
Вычислим значение редокс-потенциала системы после процесса окисления:
φr΄ = -0,19 + ¾¾¾ [ lg ¾¾- (–2×7) ] = -0,601 В
Вычислим, на сколько изменится значение редокс-потенциала после процесса окисления:
Ответ: редокс-потенциал системы пируват/ лактат увеличится на 0,0027 В.
Пример 13
Расчет изменения редокс-потенциала при
введении в редокс-систему окислителя или восстановителя
Редокс-потенциал системы метгемоглобин/гемоглобин равен при 298 К 0,055 В. Как изменится редокс-потенциал системы, если 5 % гемоглобина будет окислено нитритом натрия?
Решение. Рассчитаем по модифицированному уравнению Нернста (8.2) соотношение концентраций окисленной (метгемоглобин) и восстановленной (гемоглобин) форм:
с(Hb-Fe 3+ ) 0,055 – 0,17
¾¾¾¾¾ =10 –1,95 = 0,0111 или ————— = 1:89
Примем за х количество вещества метгемоглобина, тогда 89х – количество вещества гемоглобина. Окисляется 0,05×89х = 4,45х гемоглобина. Поскольку стехиометрические
коэффициенты равны единице количество вещества образующегося метгемоглобина равно также 4,45х.
Для расчета редокс-потенциала при новом соотношении концентраций окисленной и восстановленной форм воспользуемся также модифицированным уравнением Нернста (8.2):
2,303 RT c(Fe 3+ ) х+4,45х
nF c(Fe 2+ ) 89х+4,45х
φr = 0,17 + 0,0591× lg0,065 = 0,17 + 0,0591× (-1,19) = 0,1 В.
Ответ: редокс-потенциал в системе возрастает на 0,045 В.
Пример 14
Расчет рН раствора при введении в редокс-систему сильного протолита
В систему, содержащую хинон и гидрохинон в эквимолярном соотношении, ввели некоторое количество кислоты, при этом редокс-потенциал уменьшился на 77 мВ. На сколько единиц изменился при этом рН раствора? Т=298 К.
Решение. Воспользуемся модифицированным уравнением Нернста (8.6) для редокс-систем второго типа:
2,303 RT а(ox)а m (H + )
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
Определим число электронов, принимающих участие в полуреакции:
 |
оx red n = 2; m= 2
Преобразуем выражение аналогично примеру 8-11:
После введения некоторого количества протолита значение редокс-потенциала системы уменьшается:
Вычислим, на сколько единиц изменился рН раствора после введения некоторого количества протолита:
φr 0 — φr ΄= 0,0591(рН΄- рН) = 0,0591ΔрН
Отсюда
Ответ: рН увеличился на 1,3 единицы.
Пример 15
Расчет потенциала водородного электрода при заданном значении рН
Вычислите потенциал водородного электрода, насыщенного водородом при давлении 101 кПа, погруженного в дистиллированную воду при 298 К.
Решение. В соответствии с уравнением Нернста:
Стандартный потенциал водородного электрода принимается за 0; z = 1.
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
рН дистиллированной воды при 298 К равен 7.
Вычислим значение редокс-потенциала водородного электрода:
__________________
Пример 16
Расчет потенциала электрода, электролитом которого является буферный раствор
Вычислите потенциал водородного электрода (давление водорода составляет 101 кПа), погруженного в буферный раствор, содержащий равные массы гидрофосфата и дигидрофосфата натрия.
Решение. Воспользуемся уравнением:
Величину рН буферного раствора найдем по уравнению (5.13):
Преобразуем уравнение для расчета потенциала водородного электрода:
Подставляя в это уравнение известные величины, вычислим:
Пример 17
Расчет величины ЭДС гальванической цепи, состоящей из двух водородных электродов, электролитами которых являются растворы гидролизующихся солей
Гальванический элемент составлен из двух водородных электродов, погруженных в растворы ацетата натрия и хлорида аммония с концентрациями по 1,0 моль/л. Вычислите ЭДС цепи (температура 298 К).
Решение. В соответствии с уравнением Нернста потенциал водородного электрода при 298 К можно рассчитать следующим образом :
Искомая величина будет равна:
рН1 – рН раствора ацетата натрия,
рН2 – рН раствора хлорида аммония.
Вычислим рН соли NаСН3СОО, гидролизующейся по аниону, используя значение
рН(NаСН3СОО) = 7 + 0,5(рКа + lgсb) = 7 + 0,5(4,76 + lg1) = 9,38
Вычислим рН соли NH4Cl, гидролизующейся по катиону, используя значение рКа = 9,24 (табл.):
Рассчитаем значение ЭДС гальванического элемента:
Е = 0,0591(9,38 – 4,62) = 0,281 В
__________________
Пример 18
Расчет величины рН по известному значению ЭДС водородно-каломельной цепи
Гальванический элемент составили из каломельного (с(КСl) = 1 моль/л)
электрода и водородного электрода, погруженного в желудочный сок. ЭДС элемента равна 340 мВ при 37 °С. Вычислите рН желудочного сока.
Решение. В соответствии с уравнением Нернста потенциал водородного электрода при 310 К можно рассчитать следующим образом :
Потенциал электрода сравнения φr(Hg2Cl2) при с(КСl) = 1 моль/л и Т = 310 К равен 0,278 В.
Схема гальванической цепи:
р=101 кПа | || KCl | Hg
Значение ЭДС этой гальванической цепи выразим:
Выразим величину рН из этого выражения:
Подставляя известные величины найдем:
Пример 19
Расчет ЭДС гальванической цепи, составленной из двух стеклянных электродов при известных значениях рН растворов
Вычислите ЭДС гальванического элемента (при 25 о С), составленного из двух стеклянных электродов, погруженных в растворы хлороводородной кислоты с рН,равным 1 и с рН, равным 3. Константы стеклянных электродов числено равны между собой.
Решение. Потенциал стеклянного электрода зависит от с(Н3О + )
Воспользуемся модифицированным уравнением Нернста, включающего вместо стандартного потенциала константу стеклянного электрода, зависящую от свойств мембраны:
Произведя простейшие преобразования, аналогичные предыдущим задачам, получим:
В случае равенства К для обоих электродов потенциал электрода будет тем больше, чем меньше рН раствора.
Схема гальванической цепи:
Внутренний Внутренний электрод
электрод сравнения сравнения
| │стекло | HCl || HCl |стекло | │
Ag, AgCl | KCl | |pH 3 || pH 1 | | КCl | Ag, AgCl
- Задачи с решениями на электрохимические расчеты
- Химические источники постоянного тока. электрохимические расчеты
- Пример 92
- Пример 93
- Пример 94
- Пример 95
- Пример 96
- Пример 97
- Пример 98
- Пример 99
- Задача 68
- Задача 69
- Задача 70
- Задача 71
- Задача 72
- Задача 73
- Образец билета входного тест-контроля
- Лабораторная работа 4
- 🎥 Видео
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Задачи с решениями на электрохимические расчеты
Химические источники постоянного тока. электрохимические расчеты
Пример 92
Среди перечисленных ниже металлов найти те, которые могут восстановить катион никеля
Решение:
Выпишем значения стандартных электродных потенциалов данных металлов:
Так как 
Пример 93
Среди перечисленных ниже катионов металлов найти те, которые могут окислить цинк:
Решение:
Согласно ряду напряжений металлов
Свинец и медь имеют стандартные электродные потенциалы выше, чем цинк.
Таким образом, катион меди и катион свинца являются окислителями более сильными, чем катион цинка, и будут окислять
Пример 94
Как изменится восстановительная активность цинка, если его погрузить (при Т = 298 К) в раствор нитрата цинка с концентрацией 0,0001 моль/л ?
Решение:
Воспользуемся формулой Нернста:
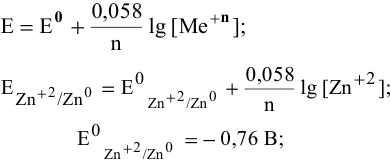
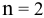
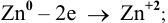
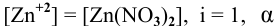
Вывод. С разбавлением раствора восстановительная активность возрастает, так как электродный потенциал понижается.
Пример 95
Среди приведенных ниже частиц укажите наиболее сильный окислитель. Эти частицы участвуют в следующих полуреакциях:
Решение:
Самый сильный окислитель тот, который обладает наибольшим значением редокс-потенциала 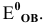
Пример 96
Рассчитать редокс-потенциал полуреакции:
если стандартный 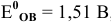
Решение:
Воспользуемся формулой Нернста для расчета редокс-потенциалов:
Так как уравнение электродной полуреакции —
Вывод. В условиях, отличающихся от стандартных, окислительная способность аниона 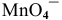
Пример 97
Определить, можно ли окислить 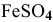
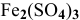
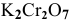
Решение:
Записываем сокращенное ионное уравнение данной реакции:
Составляем уравнения полуреакций, записывая в левой части окисленные формы каждого из изменяющихся веществ, а в правой — восстановленные формы, и находим по таблице стандартные 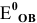
По величине 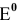
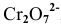
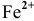
Записываем ионное уравнение реакции с учетом множителей:
Составляем молекулярное уравнение:
Пример 98
По данным полуреакциям составить ионное и молекулярное уравнение ОВ реакции:
Решение:
Роль окислителя будет выполнять окисленная форма I полуреакции, а роль восстановителя — восстановленная форма II полуреакции.
Составляем ионное и молекулярное уравнение, подобрав противоионы:
Пример 99
Определить возможность протекания окислительно-восстановительной реакции
в кислой среде, pH которой равен 1, а концентрации:
Решение:
Для упрощения расчетов предполагаем, что диссоциация всех веществ полная, тогда:
Изучаемая реакция состоит из двух полуреакций, стандартные редокс-потенциалы которых находим в таблице:
Определяем редокс-потенциалы каждой полуреакции по формуле Нернста для соответствующих концентраций:
при
По формуле 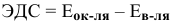
В роли окислителя выступит бихромат — ион 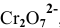
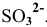
Так как 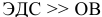
Задача 68
Рассчитать электродный потенциал гальванической пары: раствор 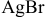
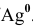
Решение:
Определяем концентрацию ионов 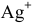
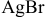
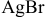
Таким образом, 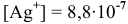
Для расчета электродного потенциала гальванической пары 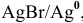
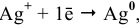
В справочнике находим:
Задача 69
Рассчитать электродвижущую силу гальванического элемента, состоящего из медной пластины, погруженной в 0,001 М раствор 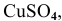
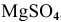
Решение:
Прежде всего, рассчитаем электродные потенциалы медного и магниевого электродов по уравнению Нернста:
Предположив, что диссоциация разбавленного раствора соли полная (а = = 1,0), вычислим электродный потенциал меди:
Предположив, что диссоциация разбавленного раствора соли полная, вычислим электродный потенциал магния:
Рассчитаем электродвижущую силу гальванического элемента по формуле
Роль катода выполняет электрод, имеющий более высокий электродный потенциал, в данном случае — это медный электрод. Тогда находим:
Задача 70
Составить два гальванических элемента: медный электрод играет роль катода; медный электрод играет роль анода. Составить схемы этих гальванических элементов и написать процессы, происходящие на катоде и на аноде.
Решение:
1. Медный электрод играет роль катода, если электродный потенциал гальванической пары 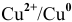
Таким образом, подбираем для этой цели любую гальваническую пару, электродный потенциал которой ниже электродного потенциала медного электрода, например 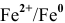
Железный электрод играет по отношению к медному электроду роль анода.
Схема полученного гальванического элемента следующая:
Процессы, происходящие на электродах:
2. Медный электрод играет роль анода, если в качестве катода подобрана такая гальваническая пара, электродный потенциал которой выше электродного потенциала пары 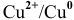
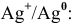
Схема полученного гальванического элемента следующая:
Процессы, происходящие на электродах:
Задача 71
Рассчитать электродвижущую силу концентрационного элемента, схема которого следующая:
Написать процессы, происходящие на электродах.
Решение:
Определяем, прежде всего, электродные потенциалы каждого электрода.
Электрод с концентрацией 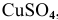
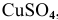
Для электрода с концентрацией 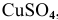
Второй электрод с более низкой концентрацией катионов 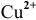
Процессы, протекающие на электродах, следующие:
Задача 72
Рассчитать произведение растворимости 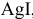
Решение:
Прежде всего, рассчитаем электродный потенциал катода, предположив, что 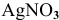
Зная величину электродного потенциала катода и величину ЭДС, рассчитаем величину электродного потенциала анода:
Рассчитаем концентрацию ионов 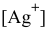
В насыщенном растворе 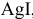
Рассчитаем произведение растворимости 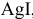
Задача 73
Рассчитать ЭДС свинцового аккумулятора, состоящего из шести банок, соединенных последовательно.
Решение:
Рассчитаем ЭДС одной банки свинцового аккумулятора. При разрядке аккумулятора происходят следующие процессы:
Для каждой из электродных полуреакций находим в справочнике значения стандартных электродных потенциалов:
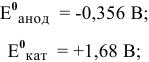
Электродвижущая сила шести последовательно соединенных банок будет равна:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Образец билета входного тест-контроля
1. Редокс-система состоит из:
А) окисленной формы Б) кислотной формы
В) щелочной формы Г) восстановленной формы
Д) сольватной формы
2. Окислительно-восстановительный потенциал зависит от:
А) природы редокс-пары
В) ионной силы раствора
Г) соотношения концентраций окисленной и восстановленной форм
Д) электроотрицательности атомов
3. Измерение ЭДС проводят:
А) в калориметрическом стакане Б) в колбе для титрования
В) в гальваническом элементе Г) на аналитических весах
Д) на спектрофотометре
4. Измерительными электродами являются:
А) медный Б) хлорсеребряный В) водородный
Г) стеклянный Д) каломельный
5. Гальванический элемент составляется:
А) из двух измерительных электродов
Б) из двух электродов сравнения
В) из измерительного электрода и электрода сравнения
Г) из стеклянного электрода и хлорсеребряного электрода
Д) из двух водородных электродов
6. Гальванический элемент состоит из серебряного и хлорсеребряного электродов. Формула гальванической цепи имеет вид:
А) Pt, H2/H + // 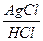
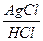
В) Ag/ 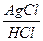
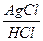
Д) Ag/Ag + //H + /Hg, Pt
7. Редокс-потенциалы большинства биологических систем имеют в целом:
А) высокие значения Б) средние значения
В) низкие значения
8. Токсичными для организма являются:
А) NO Б) Ca 2+ В) NO 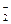
Информационная часть
Окислительно-восстановительные взаимодействия связаны с переносом электрона от одной частицы к другой:
окислитель + 
Окисленная и восстановленная формы одного и того же вещества образуют редокс-систему.
Важнейшей термодинамической характеристикой редокс-системы является окислительно-восстановительный потенциал (редокс-потенциал j), величину которого можно определить по уравнению Нерста-Петерса.
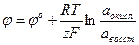
аокисл, авосст – активности окисленной и восстановленной форм редокс-системы;
R – универсальная газовая постоянная;
Т – термодинамическая температура, К о ;
F – число Фарадея;
z – число электронов, принимающих участие в элементарном редокс-процессе.
Величина j о представляет собой стандартный редокс-потенциал, т.е. потенциал, измеренный при Т=298 о К и аокисл = авосст = 1 моль/л. Стандартные редокс-потенциалы приводятся в справочных таблицах.
Если в окислительно-восстановительном процессе принимают участие ионы водорода, то говорят о формальном потенциале (jr). Для процессов, протекающих в живых системах, т.е. при условии аокисл = авосст, рН=7,36 и Т=310 о К (физиологический уровень), формальный потенциал называют мид-поинт потенциалом.
Для редокс-систем с участием ионов водорода уравнение Нернста-Петерса имеет вид:
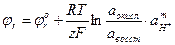

m – стехиометрический коэффициент при ионе водорода в описываемой полуреакции.
Редокс-потенциал характеризует в целом систему, т.е. окислительно-восстановительную пару. При записи потенциала химическая природа системы указывается в виде нижнего индекса, причем окислитель в этом индексе записывается в числитель, а восстановитель в знаменатель.
Если металл находится в растворе собственной соли, т.е.:
Ме z + + ze « Me o ,
то потенциал, возникающий на границе раздела фаз «металл-раствор», называют электродным потенциалом. Величина электродного потенциала определяется уравнением Нернста:
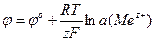
j о – стандартный электродный потенциал;
а(Ме z + ) – активность ионов металла в растворе.
При сравнении уравнений Нернста-Петерса и Нернста очевидна их схожесть. В случае электродного потенциала восстановленная форма редокс-пары – металл, т.е. твердое вещество. Активность твердой фазы является постоянной величиной и поэтому не указывается в уравнении Нернста.
Возможность самопроизвольного протекания редокс-процесса решается:
· либо расчетом DG о реакции по стандарстным термодинамическим функциям;
· либо расчетом электродвижущей силы (ЭДС) гальванического элемента.
В любом редокс-процессе принимают участие как минимум две редокс-системы.
ЭДС гальванического элемента называется разность потенциалов двух редокс-систем. Процессы идут самопроизвольно, если эта величина ЭДС больше нуля, т.е. положительна:
Гальванический элемент – это устройство из двух электродов, в котором химическая энергия превращается в электрическую.
Совокупность различных методов исследования основанная на измерении потенциалов электродов, называется потенциометрией.
Поскольку измерить абсолютное значение потенциала отдельно взятого электрода нельзя, для практических целей измеряют ЭДС гальванического элемента, составляемого из измерительного электрода, потенциал которого зависит от параметров изучаемой редокс-системы, и электрода сравнения, потенциал которого известен (приводится в справочнике) и практически постоянен при прохождении небольших токов.
Для определения редокс-потенциала часто используют платиновый электрод. Этот инертный металл является как бы посредником в процессе передачи электрона окислителю от восстановителя.
При записи схем (формулы) гальванических элементов придерживаются следующих правил:
1. Электроды записываются слева направо в порядке возрастания потенциала.
2. Вещества, входящие в состав одной фазы, записываются через запятую.
3. Границы раздела «проводник 1 рода – проводник 2 рода» обозначаются одной вертикальной чертой, двух проводников второго рода – пунктирной вертикальной чертой.
4. Контакт проводников второго рода, осуществляемый посредством солевого мостика, обозначается сдвоенной вертикальной чертой.
На величину редокс-потенциала влияют:
· рН раствора, если в окислительно-восстановительном процессе участвуют ионы водорода или гидроксид-ионы.
· Соотношение активностей окисленной и восстановленной форм. С увеличением концентрации окисленной формы потенциал возрастает, а с увеличением концентрации восстановленной формы – уменьшается. Концентрация окисленной или восстановленной форм может значительно изменяться за счет протекания конкурирующих процессов (протолитических, гетерогенный, комплексообразовательных).
Для нормального осуществления многих биологических функций часто необходима обратимость химических процессов, лежащих в их основе. Обратимость определяется взаимодействием термодинамических и кинетических факторов.
С кинетических позиций для обратимости процессов необходимы достаточно низкие значения энергии активации. В этом отношении удобным переносчиком электронов в живых системах являются ионы металлов, связанные в общие комплексы. Присоединение электрона к такой структуре и его отдача вызывают изменения лишь электронной конфигурации атома металла, не затрагивая глубинные структуры биолигандов.
Уникальная роль в живых системах отведена двум редокс-системам неорганического характера: Fe 3+ /Fe 2+ и Cu 2+ /Cu + .
Биолиганды стабилизируют в большей степени в первой паре всегда окисленную форму, а во второй паре – преимущественно восстановленную.
Атомы железа входят в состав цитохромов и железосеропротеинов.
Атомы меди входят в состав более 30 биокомплексых соединений. Ферменты, содержащие медь, в большинстве своем являются оксиредуктазами, т.к. они ускоряют окислительно-восстановительные реакции.
В редокс-процессах, протекающих в живых организмах, принимают участие также соединения кобальта, марганца и молибдена. Редокс-потенциалы многих биологических редокс-систем имеют низкие значения, т.е. для них преобладающей функцией является восстановительная. Окислители, реагируя с восстановленными формами компонентов редокс-систем даже обратимо, значительно повышают потенциалы и разлаживают четко отработанную последовательность окислительно-восстановительных метаболических реакций. Во многих случаях сильные окислители необратимо взаимодействуют с различными субстратами, что приводит к тяжелым последствиям.
Хотя хром и марганец являются жизненно необходимыми элементами, их соединения в высшей степени окисления (хроматы, дихроматы, перманганаты) являются токсичными для многих организмов.
Токсическое действие NO и NO2, концентрация которых в воздухе постоянно возрастает, также связано с их свойствами сильных окислителей. Нитраты, попадающие в продукты питания в результате чрезмерного использования азотных удобрений, в организме восстанавливаются до нитритов:
NO 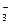

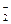
Нитриты являются чрезвычайно токсичными веществами: они вызывают окисление гемоглобина:
Hb + NO 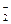
В составе метгемоглобина находится железо (III). Образовавшийся в результате окисления гемоглобина оксид азота (II) образует стабильный комплекс с еще не окислившимся гемоглобином. Здесь сочетаются окислительно-восстановительный и лигандообменный механизмы токсического действия. Помимо этого, нитриты, как соли слабой кислоты, реагируют с НС1 в желудочном содержимом, образуя при этом азотистую кислоту, которая со вторичными аминами образует канцерогенные нитрозамины:
Действие многих бактерицидных веществ (О3, С12, хлорная известь и др.) также основано на окислительно-восстановительных процессах.
Редокс-процессы применяются и для детоксикации. При отравлениях сероводородом дают подышать слегка увлажненной хлорной известью, из которой выделяются небольшие количества хлора. При отравлениях бромом дают вдыхать пары аммиака.
Потенциометрические методы основаны на измерении потенциалов электродов, являющихся функцией активностей ионов в растворе.
Основной задачей в потенциометрии является правильный выбор измерительного электрода, который воспроизводимо отражает свойства раствора, а именно активность ионов. По механизму возникновения потенциала различают ионно-металлические (сюда же относят и газовые) электроды, редокс-электроды, мембранные электроды.
Ионно-металлический электрод, представляющий собой металл, опущенный в раствор соли этого металла, функционирует как электрод первого рода, если его потенциал зависит от активности катиона в растворе. Если же металлический электрод покрыт электролитически нанесенным слоем малорастворимой соли этого металла, то он функционирует как электрод второго рода, т.к. отражает активность аниона, образующего эту малорастворимую соль.
В силу многих причин не все металлы могут быть использованы для изготовления электродов, измеряющих активность их катионов. В этом случае часто используются мембранные электроды, способные давать потенциалы, зависящие от активности ограниченного числа ионов, а в некоторых случаях – только одного типа ионов. Такие электроды называют ионоселективными электродами.
Примером ионоселективного электрода является стеклянный электрод, потенциал которого зависит от активности ионов Н3О + .
Силикат натрия, входящий в состав стеклянной мембраны толщиной 0,03-0,1 мм, подвергается гидролизу до кремниевой кислоты. Протоны, возникающие при диссоциации кремниевой кислоты, способных к обмену с катионами, содержащимися в растворе, контактирующем с мембраной. При низких значениях рН, т.е. при большой концентрации ионов Н3О + они переходят в состав мембраны, в результате чего возникает скачок потенциала на границе раздела стекло-раствор. При высоких значениях рН ионы Н3О + наоборот переходят в раствор.
Гальваническая цепь, содержащая в качестве электрода сравнения хлорсеребряный электрод, а в качестве измерительного – стеклянный, записывается так:
| внутренний электрод сравнения | |||||
 | |||||
| Ag | AgCl KCl c = const | a(H3O + ) = x | стеклянная мембрана j1 | a(H3O + ) = 1 KCl AgCl j2 | Ag |
 |  | ||||
| внешний электрод сравнения | стеклянный электрод |
Чем больше разница активностей Н3О + в растворах, омывающих внутреннюю и внешнюю мембрану, тем больше потенциал стеклянного электрода.
При полной идентичности внешней и внутренней мембраны и при равных активностях Н3О + j1 = j2. Однако полная идентичность мембран труднодостижима, поэтому каждый стеклянный электрод имеет свою постоянную, обусловленную асимметрией. Это обстоятельство диктует необходимость перед измерением проводить калибровку электрода.
Устройство стеклянного электрода имеет вид.
Модифицируя стеклянную мембрану различными ионами, можно получить Na-селективный электрод, Li-селективный электрод. Мембраны могут быть в электродах и жидкими. Они образованы несмешивающимися с водой жидкостями. Так, эфиры фосфорной кислоты с двумя алифатическими радикалами С8-С16 способны обмениваться с водным раствором ионами Са 2+ .
| [(RO2POO]2Ca | « | 2[(RO)2POO] — | + | Ca 2+ |
| орг.фаза | орг.фаза | водная фаза |
На таком механизме основано действие Са 2+ -селективного электрода.
Калиевый электрод состоит из мембраны, представляющей собой раствор валиномицина в дифениловом эфире. Валиномицин избирательно образует прочный макроциклический комплекс с ионами калия.
Наряду с упомянутыми электродами в медицине широко применяются ферментные электроды.
Прямые потенциометрические методы определения концентрации тех или иных ионов требуют предварительного построения градуировочного графика.
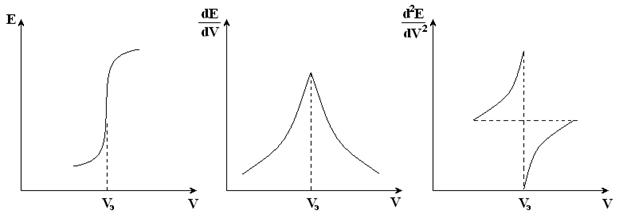
Косвенные потенциометрические методы чаще всего используются для индикации точки эквивалентности в титриметрических методах, когда применение обычных индикаторов затруднено. В основе потенциометрического титрования могут лежать те же реакции, что применяются и в классических методах: кислотно-основные, окислительно-восстановительные, осадительные, комплексообразования. Точка эквивалентности определяется по резкому скачку потенциала измерительного электрода, более точно – по максимуму первой производной dE/dV или по изменению знака второй производной d 2 E/dV 2 .
Разбор типовых задач
1. Вычислите редокс-потенциал системы, содержащей С 
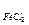
Решение: Согласно уравнению Нернста-Петерса имеем:
При решении задач по уравнению Нернста или Нернста-Петерса принимают постоянное значение предлогарифмического множителя. Если подставить постоянные величины и перейти к десятичным логарифмам:
Для процесса Fe 3+ + 1e « Fe 2+ имеем z=1. Примем также в первом приближении а=с. Тогда j 
2. Редокс-потенциал системы метгемоглобин/гемоглобин при Т=298 о К равен 0,055 В. Как измениться редокс-потенциал системы, если 10% гемоглобина будет окислено нитритом натрия (j о =0,17 В)?
Решение: По уравнению Нернста-Петерса рассчитаем соотношение концентраций окисленной (метгемоглобин) и восстановленной (гемоглобин) форм с учетом замечаний, сделанных в задаче 1.
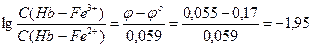
Примем за х количество вещества метгемоглобина, тогда 89х — количество вещества гемоглобина. Окислится 89х × 0,1 = 8,9х гемоглобина. Количество вещества образующегося метгемоглобина равно также 8,9х. Рассчитаем редокс-потенциал при новом соотношении концентраций окисленной и восстановленной форм:
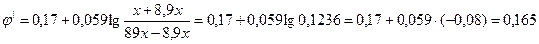
Таким образом, потенциал в системе возрастет на 0,11 Вольт.
3. Написать формулу гальванического элемента, составленного из медного электрода, находящегося в растворе CuCl2 и хлорсеребряного электрода, если они разделены солевым мостиком.
Решение: Из справочника найдем, что 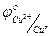
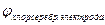
Следовательно, медный электрод будет положительным полюсом, а хлорсеребряный электрод – отрицательным полюсом.
— Ag / AgCl, HCl // Cu 2+ / Cu +
Это и есть формула данной гальванической цепи. ЭДС этой цепи будет:
Е = 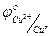
4. Вычислите потенциал водородного электрода, насыщенного водородом при давлении 101,3 кПа, погруженного в дистиллированную воду при 298 о К.
Решение: Для системы 2Н + + 2е « Н2 уравнение Нернста примет вид:
Стандартный потенциал водородного электрода принят равной 0 В.
Тогда j = 0,059lgC 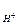
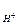
рН дистиллированной воды равен 7.
С учетом этого: j = -0,059 × 7 = -0,413 В.
5. Гальванический элемент составлен из нормального каломельного электрода и водородного электрода, погруженного в желудочный сок. ЭДС этого элемента равна 340 мВ при 37 о С. Вычислите рН желудочного сока.
Решение: В соответствии с уравнением Нернста при 310 о К (37 о С) имеем:
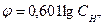
Как видно из полученного уравнения, при положительных значениях рН потенциал водородного электрода всегда отрицателен.
В соответствии с правилами записи гальванических цепей водородный электрод будет положительным полюсом в гальваническом элементе.
| — | Pt, H2 P =101,3 кПа | рН = х Н + | Hg2Cl2 KCl C = 1 моль/л | Hg | + |
ЭДС этой цепи равен:
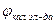
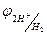
0,340 = 0,278 – (-0,601рН) = 0,278 + 0,601рН ® рН = 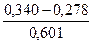
Ответ: рН желудочного сока равен 1,0.
Лабораторная работа
Измерение рН потенциометрическим способом.
Цель работы: Ознакомиться определением рН водных растворов потенциометрическим методом с помощью стеклянного электрода.
Сущность работы: Для определения рН составляют гальваническую цепь, состоящую из стеклянного и хлорсеребряного электродов. Затем калибруют электрод по буферным растворам с известными значениями рН. Каждый студент получает задание: раствор с неизвестным значением рН и определяет значение рН полученного раствора.
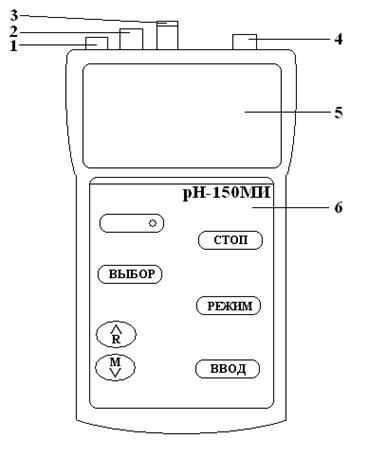
Подготовка рН-метра к работе.
Питание прибора осуществляется от сети через блок сетевого питания. Вставить вилку блока сетевого питания в разъем 1 (см. рисунок), затем подключить блок сетевого питания к сети переменного тока с номинальным напряжением 220 В.
Комбинированный электрод закрепляют в штативе и подключают к гнезду «ИЗМ». Если используется раздельная электродная пара, состоящая из измерительного электрода и электрода сравнения, то оба электрода закрепляются в штативе, разъемы кабеля измерительного электрода подключаются к гнезду «ИЗМ», а электрода сравнения к гнезду «СРАВ» преобразователя.
Термодатчик закрепить в штативе и подключить к гнезду «ТД».
Для включения прибора нажать кнопку 
В поле режимов работы на дисплее высвечивается знак «измерение». На основном цифровом поле дисплея отображаются результаты текущего измерения.
Выключение прибора производится простым нажатием кнопки 
Проведение измерений.
Прибор имеет следующие режимы работы:
· «измерение» — основной режим работы;
· «настройка» — градуировка прибора;
· «контроль» — контроль и редактирование параметров электродной системы.
Для измерения рН кнопкой ВЫБОР следует установить режим измерений и «рН». При этом в правой части дисплея высвечивается символ «рН».
Промыть электроды и термодатчик дистиллированной водой, осушить их фильтровальной бумагой и погрузить в анализируемый раствор. Глубина погружения термодатчика в анализируемый раствор должна быть не менее 30 мм.

На дисплее прибора отображается измеренные значения рН и температура раствора. Например:
Общий вид рН-метра 150МИ
1 – гнездо для подключения блока сетевого питания;
2 – разъем для подключения электрода сравнения;
3 – разъем для подключения комбинированного или измерительного электрода;
4 – разъем «ТД» для подключения датчика температуры;
5 – жидкокристаллический дисплей;
6 – панель управления.
Градуировка прибора.
Градуировка прибора должна производиться по градуировочным растворам, в качестве которых рекомендуется применять рабочие эталоны рН по ГОСТ 8.135 со значениями рН25: 1,65; 4,01; 6,86; 9,18; 12,43.
При выборе градуировочных растворов следует придерживаться такого принципа, чтобы рН анализируемых растворов оказались внутри охваченного ими диапазона. Разница в значениях рН у градуировочных растворов должна быть не менее одного рН.
· по одному градуировочному раствору;
· по двум градуировочным растворам.
Более точной является градуировка по двум растворам.
1) Нажать кнопку РЕЖИМ, выбрать режим «настройка».
2) Когда знак «настройка» на дисплее начинает мигать нажать кнопку ВВОД. При этом прекращается мигание знака «настройка».
3) Промыть электроды и термодатчик дистиллированной водой, осушить фильтровальной бумагой, поместить их в первый градуировочный раствор и нажать кнопку ВВОД.
4) Для занесения значения рН первого градуировочного раствора в память прибора следует нажать кнопку ВВОД. При этом «градуировка по одному раствору» завершена.
5) Для продолжения градуировки по второму раствору электродную систему и термодатчик вновь промывают дистиллированной водой, осушают фильтровальной бумагой и помещают их во второй градуировочный раствор. Нажать кнопку ВВОД.
6) Порядок градуировки по второму раствору полностью аналогичен градуировке в первом растворе. Для записи значения рН второго градуировочного раствора в память прибора следует нажать кнопку ВВОД.
7) Проверка правильности проведения градуировки производится в режиме «измерение». Если погрешность измерения не превышает ±0,05рН, то прибор калиброван правильно. При этом используется раствор с известным значением рН.
Определение рН неизвестного раствора.
рН-метр калибруют по двум буферным растворам с известными значениями рН под руководством преподавателя. Затем каждый студент получает раствор с неизвестным значением рН (контрольный раствор) и проводит определение рН как было показано в разделе «Проведение измерений».
В протоколе лабораторных работ описывается ход калибровки прибора и измерений рН неизвестного раствора. Приводится схема гальванической цепи.
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

Лабораторная работа 4
Лабораторная работа 4
Система, содержащая в одной фазе окисленную и восстановленную форму одного и того же вещества или нескольких веществ, называется окислительно-восстановительной или редокс системой.
В момент динамического равновесия на поверхности электрода из инертного металла, помещенного в редокс-систему, возникнет равновесный потенциал, который называют окислительно-восстановительным (ОВ) или редокс – потенциалом Еr, который рассчитывается по уравнению Нернста:

где Er — стандартный редокс-потенциал; n — число электронов, передаваемых с донора (Red) на акцептор (Ох) в элементарном акте; CОх и CRed — концентрации окисленной и восстановленной форм, соответственно.
Цель работы: Измерить редокс-потенциал нескольких смесей различного состава, приготовленных из растворов солей K3[Fe(CN)6] (красная кровяная соль) и K4[Fe(CN)6] (жёлтая кровяная соль). Построить график зависимости редокс-потенциала этой системы от логарифма соотношений концентраций окисленной и восстановленной форм железа.
Оборудование: Штатив с бюретками, потенциометр (иономер), электроды: платиновый (измерительный) и хлорсеребряный (сравнения), химические стаканы.
Реактивы: Растворы красной K3[Fe(CN)6] и желтой K4[Fe(CN)6] кровяных солей одинаковой концентрации 0,01 моль×л-1, раствор KCl (2 моль×л-1), дистиллированная вода, бумажные фильтры.
1. Составить смеси растворов красной и желтой кровяных солей в соответствии с таблицей 4.
2. Измерить потенциометром ЭДС элемента:
для каждого соотношения концентраций окисленной и восстановленной форм железа.
3. Рассчитать величину редокс-потенциала Еr по формуле:
где Еr — редокс-потенциал, В,
Е — измеренное потенциометром значение ЭДС, В,
ECl¯, Ag+/Ag — потенциал насыщенного хлорсеребряного электрода, величина которого для данной температуры (в °С) рассчитывается по формуле:
🎥 Видео
Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окислительно-восстановительный потенциалСкачать

Учимся составлять электронный баланс/овр/8классСкачать

Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Продукты в ОВР. Ч.2-2. Окислительно-восстановительный (редокс) потенциал в растворе.Скачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать

Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

4 3 Электрохимический потенциалСкачать

Редокс-реакцииСкачать
Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать