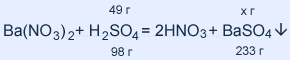1. Формулы только оснований приведены в ряду
| 1) Na2CO3, NaOH, NaCl | 3) KOH, Mg(OH)2, Cu(OH)2 |
| 2) KNO3, HNO3, KOH | 4) HCl, BaCl2, Ba(OH)2 |
2. Индикатор лакмус изменяет свой цвет в щелочной среде
1) на фиолетовый
2) на красный
3) на синий
4) на бесцветный
4. Установите соответствие между исходными веществами (веществом) и продуктами химических реакций.
| 1) NaOH + CO2 | А. FeO + H2O |
| 2) NaOH + H2SO4 | Б. Na2CO3 + H2O |
| 3) Fe(OH)2 + HCl | В. Na2SO4 + H2O |
| 4) Fe(OH)2 | Г. FeCl2 + H2O |
Ответы: 1 – Б, 2 – В, 3 – Г, 4 – А.
В уравнении реакции обмена 2koh mg oh 2 2kcl пропущена формула

Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.

Ca(NO3)2 = Ca 2+ + 2NO3 − нитрат кльция
Na3PO4 = 3Na + + PO4 3− фосфат натрия
Кислые соли
Ca(HSO4)2 = Ca 2+ + 2HSO4 − гидросульфат кальция
NaH2PO4 = Na + + H2PO4 − дигидрофосфат натрия
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Основные соли
(CaOH)2SO4 = 2CaOH + + SO4 2− гидроксосульфат кальция
MgOHNO3 = MgOH + + NO3 − гидроксонитрат магния

а) HCl + Na2SO4 →
б) H3PO4 + CaCl2 →
в) FeCl3 + AgNO3 →
г) KNO3 + NaCl →
д) NaOH+ FeS →
е) KOH + Al2(SO4)3 →
ж) Ca + CuCl2 →
з) Cu + AgNO3 →
и) Mg + ZnS →
к) Cu + Fe(NO3)2 →
Если реакция не может быть осуществлена, объясните почему.

а) 2HCl + Na2SO4 = H2SO4 + 2NaCL 2H + +2Cl − + 2Na + + SO4 2− = 2H + + SO4 2− + 2Na + + 2Cl −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
г) KNO3 + NaCl = KCl + NaNO3 K + + 2NO 3 − + Na + + Cl − = K + + Cl − + Na + + NO 3 −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
ж) Cu + CuCl2 = CaCl2 + Cu
Ca 0 + Cu 2+ + 2Cl − = Ca 2+ + 2Cl − + Cu 0
Ca 0 + Cu 2+ = Ca 2+ + Cu 0
з) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu 0 + 2Ag + + 2NO 3 − = Cu 2+ + 2 NO 3 − + 2Ag 0
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
и) Mg + ZnS ≠ MgS + Zn Реакция не идет т.к. ZnS и MgS нерастворимые соли
к) Cu + Fe(NO3)2 ≠ Реакция не идет т.к. в электрохимическом ряду напряжений Cu расположена правее Fe и не может вытеснять железо из его солей

Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

| Дано: H2SO4, Ba(NO3)2 mр-ра= 980 г ω( H2SO4) = 0,05 mосад. =? | Решение: m(H2SO4) = mр-ра • ω( H2SO4) = = 980 • 0,05 = 49 г M(H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 г / моль M(BaSO4) = 137 + 32 + 16 • 4 = 233г / моль 49 : 98 = х : 233; х = 116,5 г BaSO4 |


1. Fe + H2SO4 = FeSO4 + H2↑
2. FeO + H2SO4 = FeSO4 + H2O
3. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4. CuSO4 + Fe = FeSO4 + Cu
5. FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O

🎥 Видео
Реакции ионного обмена. 9 класс.Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Реакции обменаСкачать

Реакции ионного обмена. 9 класс.Скачать

MGO+MG(OH)2Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химия 8 класс: Реакции обменаСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Реакции ионного обменаСкачать

Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

Реакции ионного обмена за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Химия 9 класс (Урок№6 - Реакции ионного обмена и условия их протекания.)Скачать

25. Схема реакции и химическое уравнениеСкачать