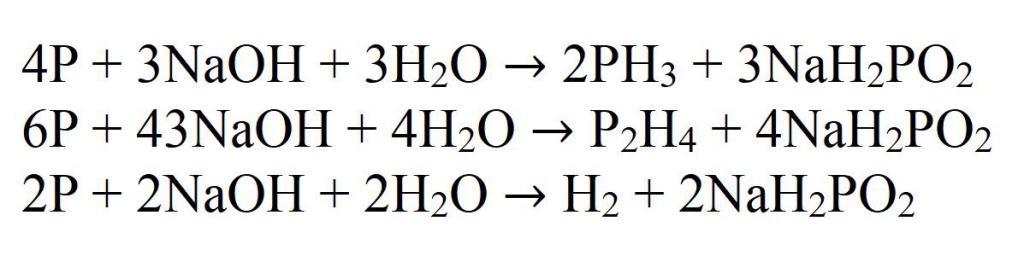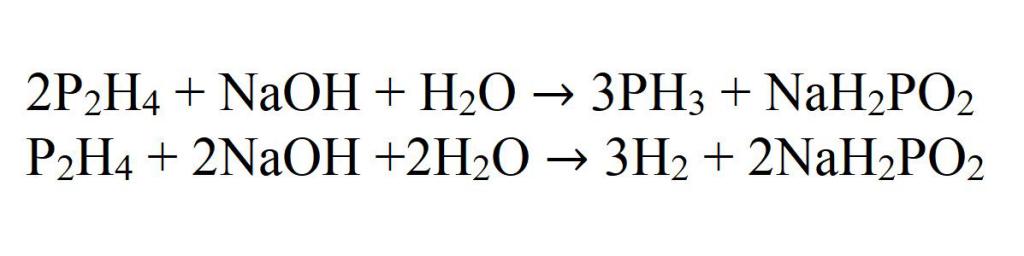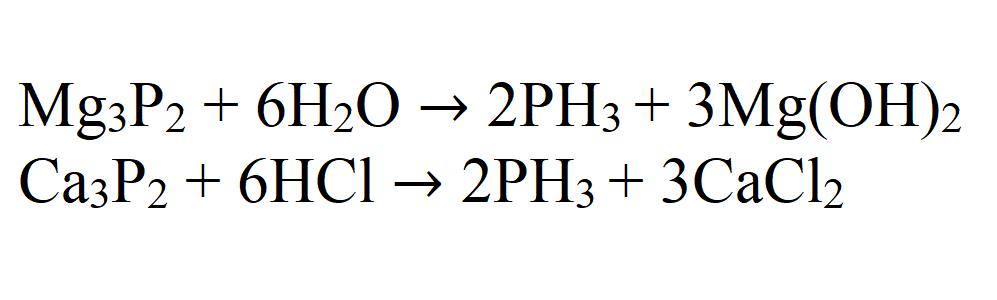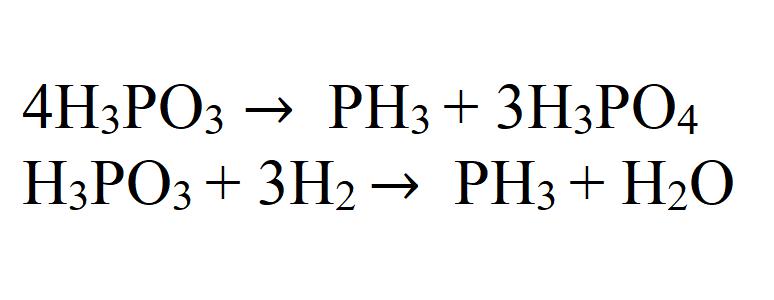- Фосфин
- Строение молекулы и физические свойства
- Способы получения фосфина
- Химические свойства фосфина
- 1. Закончите реакции?
- Коэффициент перед кислородом уравнении реакции горения водорода?
- Сумма коэффициентов в реакции горения ацетилена равна?
- Определите коэффициент перед формулой кислорода в уравнении реакции горения ацетилена С2Н2 в кислороде ?
- Укажите коэффициент перед кислородом в реакции горения пропана?
- Сумма коэффициентов в уравнении реакции горения нонана ( формулу пожалуйста) и ответ?
- Сумма коэффициентов в уравнении реакции горения пропана?
- Сумма коэффициентов в реакции горения углерода в избытке кислорода равна б?
- Коэффициент перед кислородом в уравнении реакции горения водорода помогите пожалуйста?
- В реакции горения этана чему равен коэффициент перед формулой кислорода?
- Коэффициент перед кислородом в уравнении реакции горения водорода?
- Составьте уравнения реакций, схемы которых даны ниже:
- Фосфин: формула, получение, физические и химические свойства
- Получение
- Физические свойства
- Химические свойства
- Применение
- Токсикология
- 🌟 Видео
Фосфин
Строение молекулы и физические свойства
Фосфин PH3 – это бинарное соединение водорода с фосфором, относится к летучим водородным соединениям. Следовательно, фосфин газ, с неприятным запахом, бесцветный, мало растворимый в воде, химически нестойкий и ядовитый. Водородные связи между молекулами фосфина не образуются. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы фосфина похожа на структуру аммиака — правильная треугольная пирамида. Но валентный угол H-P-H меньше, чем угол H-N-H в аммиаке и составляет 93,5 о .
У атома фосфора в фосфине на внешнем энергетическом уровне остается неподеленная электронная пара. Эта электронная пара оказывает значительное влияние на свойства фосфина, а также на его структуру. Электронная структура фосфина — тетраэдр , с атомом фосфора в центре.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Видео:Фосфин - PH3. Реакция Фосфида Кальция И Соляной Кислоты. Получение Фосфида Кальция.Скачать

1. Закончите реакции?
Химия | 5 — 9 классы
1. Закончите реакции.
Какой коэффициент должен быть перед формулой кислорода.
А) 4 ; б) 3 ; в) 2 ; г) 1.
2. В уравнении реакции горения фосфина PH3 сумма всех коэффициентов равна : а) 4 ; б) 8 ; в) 5 ; г) 10.
1. 2Н2S + 3O2 → 2SO2 + 2Н2О
2PH3 + 4O2→Р2О5 + 3Н2Огб) 10.
Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Коэффициент перед кислородом уравнении реакции горения водорода?
Коэффициент перед кислородом уравнении реакции горения водорода.
Видео:25. Схема реакции и химическое уравнениеСкачать

Сумма коэффициентов в реакции горения ацетилена равна?
Сумма коэффициентов в реакции горения ацетилена равна.
Видео:Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

Определите коэффициент перед формулой кислорода в уравнении реакции горения ацетилена С2Н2 в кислороде ?
Определите коэффициент перед формулой кислорода в уравнении реакции горения ацетилена С2Н2 в кислороде :
Видео:Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать

Укажите коэффициент перед кислородом в реакции горения пропана?
Укажите коэффициент перед кислородом в реакции горения пропана.
Видео:Практическая работа «Сравнение реакций горения серы, фосфора, железа в воздухе и кислороде»Скачать

Сумма коэффициентов в уравнении реакции горения нонана ( формулу пожалуйста) и ответ?
Сумма коэффициентов в уравнении реакции горения нонана ( формулу пожалуйста) и ответ.
Видео:Горение. 7 класс.Скачать

Сумма коэффициентов в уравнении реакции горения пропана?
Сумма коэффициентов в уравнении реакции горения пропана?
Видео:ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать

Сумма коэффициентов в реакции горения углерода в избытке кислорода равна б?
Сумма коэффициентов в реакции горения углерода в избытке кислорода равна б.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Коэффициент перед кислородом в уравнении реакции горения водорода помогите пожалуйста?
Коэффициент перед кислородом в уравнении реакции горения водорода помогите пожалуйста.
Видео:ОЛИМПИАДНАЯ ХИМИЯ ДЛЯ ВСЕХ!Скачать

В реакции горения этана чему равен коэффициент перед формулой кислорода?
В реакции горения этана чему равен коэффициент перед формулой кислорода?
Видео:Химия 9 класс : ФосфинСкачать

Коэффициент перед кислородом в уравнении реакции горения водорода?
Коэффициент перед кислородом в уравнении реакции горения водорода.
Вы открыли страницу вопроса 1. Закончите реакции?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 5 — 9 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
1) реакция Соединения 2) KCl = K + Cl (реакция решена неверно у вас). Реакция разложения. 3) Реакция замещения 4) Рекция обмена.
1)соединение 2)разложение 3)замещение 4)обмен.
Простое вещество : б, г, д элемент : а, в, е, ж.
NaCl n = N / NA = 30 / 6, 02 = 4, 98 m = M * n = 58, 5 * 5 = 292, 5 N = 30 * 10 ^ 23 V = Vm * n = 22, 4 * 5 = 112 M = Mr = 58, 5 CO2 n = 10 m = 440 N = n * NA = 60, 2 V = 10 * 22, 4 = 224 M = 44 CuSO4 n = 640 / 160 = 4 m = 640 N = 24, 08 V = 89. 6 M..
N = (ѡ(c) / Ar(C) * 100) * M(CnH2n) n(C) = 85, 7 / 1200 * 28 = 2 n(H) = 14, 3 / 100 * 28 = 4 Формула = С2Н4.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaClFeS + 2HCl(разб. ) = FeCl2 + H2S↑2Cu(OH)2 + H2SO4(нед. ) = (CuOH)2SO4 + 2H2O.
Радиус атома увеличивается, электроотрицательность уменьшается, металлические свойства усиливаются. ( вроде бы всё).
135 наверное где то, но я могу быть не прав.
Ответ : Объяснение : 2Н₂⁰ + О₂⁰ = 2Н₂⁺¹О⁻²Н₂⁰ — 2е⁻ = 2Н⁺¹ | 2 — восстановитель, процесс окисленияО₂⁰ + 4е⁻ = 2О⁻² | 1 — окислитель, процесс восстановления.
Дано F2 — 38моль (воздух) O2 — 32моль (плотность)p — ? (относительная плотность)Dвоздуха — ? Решение p = Mвоздуха / Vm(молекулярный объем равный 22, 4г / моль) Dвоздуха = M(F2) / M(O2) p = 32 / 22 = 1, 5 Dвоздуха = 38 / 32 = 1, 2 (в некоторых скобк..
Видео:Органика. Олимпиадная задача на горение смеси углеводородов.Скачать

Составьте уравнения реакций, схемы которых даны ниже:
| а) Li + … → Li2O | е) Li2O + … → LiNO3 + H2O |
| б) Ca + … → CaO | ж) CuO + … → CuCl2 + H2O |
| в) C + … → CO2 | 3) Li2O + … → LiOH |
| г) Al + … → Al2O3 | и) P2O5 + … → H3PO4 |
| д) PH3 + … → P2O5 + H2O | к) SO3 + … → Na2SO4 + … |
а) Li + … → Li2O
Продуктом реакции является оксид. В левой части у нас только литий, значит, в левой части не хватает кислорода:
Li + O2 → Li2O
Слева у нас молекула кислорода с двумя атомами, справа – всего 1 атом кислорода. Значит нужно поставить коэффициент два у оксида лития:
Li + O2 → 2Li2O
Осталось уравнять литий:
4Li + O2 = 2Li2O
б) Ca + … → CaO
Продуктом реакции является оксид. В левой части у нас только кальций, значит, в левой части не хватает кислорода:
Ca + O2 → CaO
Слева у нас молекула кислорода с двумя атомами, справа – всего 1 атом кислорода. Значит нужно поставить коэффициент два у оксида кальция:
Ca + O2 → 2CaO
Остаётся уравнять кальций:
2Ca + O2 = 2CaO
в) C + … → CO2
Продуктом реакции является оксид. В левой части у нас только углерод, значит, в левой части не хватает кислорода:
C + O2 → CO2
Слева у нас 1 атом углерода и молекула с двумя атомами кислорода; справа молекула углекислого газа содержит 1 атом углерода и 2 атома кислорода. Имеем право поставить знак равенства.
C + O2 = CO2
г) Al + … → Al2O3
Продуктом реакции является оксид. В левой части у нас только алюминий, значит, в левой части не хватает кислорода:
Al + O2 → Al2O3
В левой части у нас 2 атома кислорода в молекуле; в правой части 3 атома кислорода в оксиде алюминия. Наименьшее кратное – шесть. Поставим коэффициенты:
Al + 3O2 → 2Al2O3
Уравниваем алюминий:
4Al + 3O2 = 2Al2O3
д) PH3 + … → P2O5 + H2O
В правой части у нас только оксиды. Очевидно, что это реакция горения и в левой части не хватает кислорода:
PH3 + O2 → P2O5 + H2O
Хотелось бы считать по кислороду, но в правой части мы видим 2 атома фосфора в оксиде P2O5, поэтому для начала нужно поставить коэффициент 2 у фосфина:
2PH3 + O2 → P2O5 + H2O
Теперь уравняем водород:
2PH3 + O2 → P2O5 + 3H2O
Наконец, можем перейти к кислороду:
2PH3 + 4O2 = P2O5 + 3H2O
е) Li2O + … → LiNO3 + H2O
Справа мы видим соль – нитрат лития и воду. Это говорит о том, что в левой части не хватает азотной кислоты.
Li2O + HNO3 → LiNO3 + H2O
Слева у нас два атома лития в оксиде, а справа – один в нитрате. Уравниваем:
Li2O + HNO3 → 2LiNO3 + H2O
Теперь справа мы имеем два остатка азотной кислоты в нитрате лития. Ставим коэффициент два у азотной кислоты:
Li2O + 2HNO3 = 2LiNO3 + H2O
ж) CuO + … → CuCl2 + H2O
Справа мы видим хлорид меди и воду. Значит, в левой части нам не хватает хлора и водорода. Логично предположить, что это соляная кислота (HCl): CuO + HCl → CuCl2 + H2O
Видно, что в правой части у нас по два атома хлора и водорода. Значит, у соляной кислоты ставим коэффициент два:
CuO + 2HCl = CuCl2 + H2O
3) Li2O + … → LiOH
В параграфе есть табличка, где указано, что гидроксиды могут получаться из оксидов и воды.
Li2O + H2O → LiOH
Слева у нас 2 атома водорода,а справа два атома лития. Поэтому коэффициент два у гидроксида лития напрашивается сам:
Li2O + H2O = 2LiOH
и) P2O5 + … → H3PO4
Кислоты могут образовываться из кислотных оксидов при взаимодействии с водой:
P2O5 + H2O → H3PO4
Молекула фосфорной кислоты содержит 3 атома водорода, а молекула воды – два. Наименьшим кратным будет шесть:
P2O5 + 3H2O = 2H3PO4
к) SO3 + … → Na2SO4 + …
Соли могут образовываться при взаимодействии кислотного оксида либо с основным оксидом (реакция соединения), либо с основанием (реакция замещения). Так как в правой части у нас чего-то не хватает, очевидно, что речь идёт о втором варианте.
SO3 + NaOH → Na2SO4 + H2O
В правой части у нас два атома натрия в сульфате. Значит ставим коэффициент два у гидроксида:
SO3 + 2NaOH = Na2SO4 + H2O
Видео:Химия ОГЭ-2023 / Блок "Химическая реакция" / Типы реакций / ОВР / Электронный балансСкачать

Фосфин: формула, получение, физические и химические свойства
Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Видео:Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать

Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
Видео:Реакция термокольцепреципитации (реакция Асколи)Скачать

Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см 3 .
Видео:Гибридизация атомных орбиталей и геометрия молекул. 10 класс.Скачать

Химические свойства
Как уже было сказано, химическая формула фосфина — PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
Видео:140. Расставляем коэффициенты методом электронного балансаСкачать

Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Видео:Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м 3 . Концентрация 10 мг/м 3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
🌟 Видео
10 класс(база).Решение задач на нахождение формулы по продуктам сгорания и массовой доли элемента.Скачать
Задание 23 нового формата | Химия ЕГЭ 2023 | УмскулСкачать