Условие
Установите соответствие между способом воздействия на равновесную систему: (24)
и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
A) повышение давления
Б) разбавление водой
B) добавление гидроксида калия
Г) добавление соляной кислоты
1) смещается в сторону продуктов реакции
2) смещается влево
3) практически не смещается
Запишите в таблицу выбранные цифры под соответствующими буквами.
Решение
А) в реакции нет газов, поэтому изменение давление не влияет значительно
Б) увеличение концентрации воды, смещение в сторону избавления от лишней воды=> в сторону продуктов
В) добавление гидроксида калия увеличивает количество OH^(-)=>система старается убрать лишние гидроксид-ионы=> смещение влево
Г) добавление соляной кислоты связывает имеющиеся OH^(-) с образованием воды, количество OH^(-) уменьшается, система старается восстановить исходные условия => смещение в сторону продуктов.
Видео:Получение основного карбоната меди (СuOH)2CO3Скачать

При каких условиях усилится гидролиз соли карбоната натрия
Задача 1001.
Добавление каких из указанных веществ усилит гидролиз карбоната натрия: а) NаОН; б) ZnCl 2 ; в) Н 2 O; г) К 2 S?
Решение:
Na 2 CO 3 – соль сильного основания и слабой кислоты гидролизуется по аниону. Гидролиз практически протекает по первой ступени:
а) При добавлении к раствору карбоната натрия, содержащему избыток ионов OH − , раствора NaOH в смеси появится дополнительное количество ионов ОН − (NaOH ↔ Na + + OH − ). Избыток ионов ОН − , согласно принцип Ле Шателье, сместит равновесие в системе влево, в сторону уменьшения концентрации ионов ОН − , т.е. гидролиз соли замедлится.
б) ZnCl2 – соль сильной кислоты и слабого основания гидролизуется по катиону. Гидролиз практически протекает по первой ступени:
Zn 2+ + H2O ↔ ZnOH + + H + ;
При гидролизе ZnCl2 образуется избыток ионов Н + . Поэтому при приливании раствора хлорида цинка к раствору карбоната натрия произойдёт связывание ионов Н+ и ОН- с образованием Н2О (Н + + ОН − ↔ Н2О). Таким образом, согласно принципу Ле Шателье, равновесие в системе сместится вправо, в сторону увеличения концентрации Н2О, т. е. гидролиз обеих солей усилится.
в) При разбавлении раствора карбоната натрия водой концентрация ионов ОН − уменьшится что, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону увеличения концентрации ионов ОН − , т. е. гидролиз солей взаимно усилится.
г) K2S – соль сильного основания и слабой кислоты гидролизуется по аниону. Гидролиз практически протекает по первой ступени:
S 2 − + H2O ↔ HS − +OH − ;
При гидролизе сульфида калия образуется избыток ионов ОН − . Поэтому при добавлении раствора сульфида калия к раствору карбоната натрия образуется дополнительный избыток ионов ОН − , что, согласно принципу Ле Шателье, сместит равновесие системы влево, в сторону уменьшения концентрации ионов ОН − , т. е. гидролиз обеих солей замедлится.
Видео:Получение ГИДРОКСИДА КАЛЬЦИЯ Ca(OH)2. Растворение КАЛЬЦИЯ в ВОДЕ. Опыты по химии дома. ЭкспериментыСкачать

Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат свинца (II), карбонат калия. Какие значения pH имеют растворы их солей?
Решение:
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2 + связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2 + + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 
полное ионно-молекулярное уравнение:
2K + + CO3 2– + H2O 
K2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: хлорид цинка, сульфит натрия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид цинка ZnCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли ZnOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Zn 2+ + H2O 
полное ионно-молекулярное уравнение:
Zn 2+ + 2Cl — + H2O 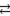
ZnCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HSO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
SO3 2– + H2O 
полное ионно-молекулярное уравнение:
2Na + + SO3 2– + H2O 
Na2SO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей хлорид кобальта (II), нитрат алюминия. Какие значения pH имеют растворы этих солей?
Решение:
Хлорид кобальта (II) CoCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Co 2+ + H2O 
полное ионно-молекулярное уравнение:
Co 2+ + 2Cl — + H2O 
CoCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 3+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
Al 3+ + 3NO3 — + H2O 
Al(NO3)3+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
📹 Видео
Взаимодействие углекислого газа с известковой водой (CO2 + Ca(OH)2 = CaCO3 + H2O)Скачать

How to Write the Equation for Co(OH)2 + H2OСкачать

Equation for CaCO3 + H2O (Calcium carbonate plus Water)Скачать

अभिक्रिया H_2O + HCl to H_3O^(oplus) + Cl^(-) में H_2O का व्यवहार होता है | 12 | अम्ल , क्षारक त...Скачать

Вариант 28 из сборника Д.Ю. ДобротинаСкачать

Как сбалансировать: CaCO3 + HCl = CaCl2 + CO2 + H2O (карбонат кальция + соляная кислота)Скачать

How to write the equation for Ag2CO3 + H2O (Silver carbonate + Water)Скачать

CH3COOH + H2O (Ethanoic acid plus Water)Скачать

Equation for CaCO3 + H2O (Calcium carbonate + Water)Скачать

0.7 g of Na_(2)CO_(3).xH_(2)O is dissolved in 100 mL of water , 20 mL of which required 19.8 mL ...Скачать

CH3COOH+NaHCO3=CH3COONa+CO2+H2O balance the chemical equation @mydocumentary838.Скачать

How to Balance NaHCO3 + HBr = H2O + CO2 + NaBrСкачать

How to Write the Net Ionic Equation for NaHCO3 + HCl = NaCl(aq) + CO2(g) + H2O(l)Скачать

Как сбалансировать Al(OH)3 + H2CO3 = Al2(CO3)3 + H2OСкачать

How to Balance CuCO3 + HCl = H2O + CO2 + CuCl2Скачать

Как сбалансировать Al(HCO3)3 = Al2O3 + CO2 + H2OСкачать

How to Balance CH3-CH2-OH + O2 = CO2 + H2O (Ethanol + Oxygen gas)Скачать

How to Balance Ca3N2 + H2O = Ca(OH)2 + NH3Скачать


