Химия | 10 — 11 классы
В результате реакции, термохимическое уравнение которой FeO(тв) + H2(г) = Fe(тв) + H2O(ж) – 21 кДж израсходовалось 10 г водорода.
Определите количество теплоты (в килоджоулях), затраченной при этом.
На фотке показано ответ :
- По термохимическому уравнению реакций получения воды из простых веществ 2H + O2 = 2H2 0 + 484kДЖ определите А) Количество теплоты, выделившейся при получении 360гводы Б) Количество израсходованного ки?
- Какое количество теплоты выделится при сгорании 2, 24 л водорода?
- Составьте термохимическое уравнение реакции, если известно, что при сгорании 2 г водорода в кислороде выделяется 286 кДж теплоты?
- С помощью термохимического уравнения горения водорода 2Н2 + О2 = 2Н2О + 484 кДж рассчитать объем водорода (н?
- В результате реакции, термохимическое уравнение которой C2H2 + 1 / 2О2 = 2CO2 + H2O + 1305 кДж / моль выделилось 652, 5 кДж теплоты?
- Помогите пожалуйста?
- Помогите пожалуйста?
- Составьте термохимическое уравнение реакции, если известно, что при сгорании 20г водорода в кислороде выделяется 2860 кДж теплоты?
- Напишите термохимическое уравнение реакции между CO( г ) и водородом, в результате которой?
- Составте термохимическое уравнение реакции, если известно, что при сгорании 2г водорода в кислороде выделяется 286 кДж теплоты?
- Досрочный вариант ЕГЭ по химии-2022 Вариант 2
- 20.04.2022 Работа статград ЕГЭ химия 11 класс варианты ХИ2110501-ХИ2110504 с ответами
- ПОДЕЛИТЬСЯ
- Тренировочная работа №5 статград ЕГЭ 2022 по химии 11 класс
- Задания и ответы с варианта ХИ2110501
- Задания и ответы с варианта ХИ2110502
- 🌟 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

По термохимическому уравнению реакций получения воды из простых веществ 2H + O2 = 2H2 0 + 484kДЖ определите А) Количество теплоты, выделившейся при получении 360гводы Б) Количество израсходованного ки?
По термохимическому уравнению реакций получения воды из простых веществ 2H + O2 = 2H2 0 + 484kДЖ определите А) Количество теплоты, выделившейся при получении 360гводы Б) Количество израсходованного кислорода ( в гр.
), если выделилось 200кДЖ теплоты В) Массу образовавшейся воды, если выделилось 1000 кДж теплоты.
Г) Количество израсходованного водорода, если выделилось 400 кДж теплоты.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Какое количество теплоты выделится при сгорании 2, 24 л водорода?
Какое количество теплоты выделится при сгорании 2, 24 л водорода?
Термохимическое уравнение реакции : 2H2 + O2 = 2H2O + 572 кДж.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Составьте термохимическое уравнение реакции, если известно, что при сгорании 2 г водорода в кислороде выделяется 286 кДж теплоты?
Составьте термохимическое уравнение реакции, если известно, что при сгорании 2 г водорода в кислороде выделяется 286 кДж теплоты.
Видео:Тепловой эффект реакции. ЗадачиСкачать

С помощью термохимического уравнения горения водорода 2Н2 + О2 = 2Н2О + 484 кДж рассчитать объем водорода (н?
С помощью термохимического уравнения горения водорода 2Н2 + О2 = 2Н2О + 484 кДж рассчитать объем водорода (н.
У. ) и количество вещества воды, если в результате реакции выделяется 24, 2 кДж теплоты.
Видео:Решение цепочек превращений по химииСкачать

В результате реакции, термохимическое уравнение которой C2H2 + 1 / 2О2 = 2CO2 + H2O + 1305 кДж / моль выделилось 652, 5 кДж теплоты?
В результате реакции, термохимическое уравнение которой C2H2 + 1 / 2О2 = 2CO2 + H2O + 1305 кДж / моль выделилось 652, 5 кДж теплоты.
Определите массу сгоревшего ацетилена.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Помогите пожалуйста?
Напишите термохимическое уравнение реакции горения водорода, если при сгорании 1 г водорода выделилось 121 кДж теплоты.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Помогите пожалуйста?
Напишите термохимическое уравнение реакции горения водорода, если при сгорании 1 г водорода выделилось 121 кДж теплоты.
Видео:Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Составьте термохимическое уравнение реакции, если известно, что при сгорании 20г водорода в кислороде выделяется 2860 кДж теплоты?
Составьте термохимическое уравнение реакции, если известно, что при сгорании 20г водорода в кислороде выделяется 2860 кДж теплоты.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Напишите термохимическое уравнение реакции между CO( г ) и водородом, в результате которой?
Напишите термохимическое уравнение реакции между CO( г ) и водородом, в результате которой.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Составте термохимическое уравнение реакции, если известно, что при сгорании 2г водорода в кислороде выделяется 286 кДж теплоты?
Составте термохимическое уравнение реакции, если известно, что при сгорании 2г водорода в кислороде выделяется 286 кДж теплоты.
Вопрос В результате реакции, термохимическое уравнение которой FeO(тв) + H2(г) = Fe(тв) + H2O(ж) – 21 кДж израсходовалось 10 г водорода?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
2 — этилбутен — 1 2, 3, 4 — триметилгексан 2 — метилпроаен — 1.
ОПределим в каждом массовую долю железа. Мы знаем , что атом железа весит 56 грамм, а атом кислорода 16 грамм. В соединении FeO , 1 атом железа и 1 атом кислорода. Посчиатем молекулярную массу , 16 + 56 = 72 грамм . А теперь определим массовую до..
2. FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4 Fe²⁺ + SO4²⁻ + 2Na⁺ + 2OH⁻ = Fe(OH)2↓ + 2Na⁺ + SO4²⁻ Fe²⁺ + 2OH⁻ = Fe(OH)2↓⁻ Fe(OH)2↓ + 2HCl = FeCl2 + 2H2O Fe(OH)2↓ + 2H⁺ + 2Cl⁻ = Fe²⁺ + 2Cl⁻ + 2H2O Fe(OH)2↓ + 2H⁺ = Fe²⁺ + 2H2O 1. K2SO3 + 2HCl = 2KCl + SO2 + H..
Нет конечно, это физическое явление, откуда оно химическое.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Досрочный вариант ЕГЭ по химии-2022 Вариант 2
Досрочный вариант ЕГЭ по химии-2022. Скачать разбор досрочного варианта ЕГЭ по химии-2022 от 23 марта 2022 с ответами и решениями
Для выполнения заданий 1–3 используйте следующий ряд химических элементов:
1) Na 2) S 3) Al 4) O 5) Cr
Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1. Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат одинаковое число s-электронов. Запишите в поле ответа номера выбранных элементов.
2. Из указанных в ряду химических элементов выберите три элемента-металла. Расположите выбранные элементы в порядке возрастания восстановительных свойств образуемых ими простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
3. Из указанных в ряду элементов выберите два элемента, у которых в образуемых ими ионах ЭОх 2- совпадает степень окисления. Запишите в поле ответа номера выбранных элементов.
4. Из предложенного перечня выберите два вещества, которые имеют ионную и ковалентную неполярную связь.
1) фосфат натрия
2) метилацетат
3) бензоат аммония
4) диэтиловый эфир
5) пероксид натрия
Запишите номера выбранных веществ.
5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) кислоты; Б) средней соли; В) кислотного оксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
| А | Б | В |
| 9 | 3 | 8 |
6. В одну из пробирок с порошком оксида цинка добавили слабый электролит X, а в другую – раствор вещества Y. В результате в первой пробирке наблюдали растворение твердого вещества. В пробирке с раствором вещества Y произошла реакция, которую описывает сокращенное ионное уравнение:
ZnO + 2H + = Zn 2+ + H2O
выберите вещества X и Y, которые могут вступать в описанные реакции.
1) йодоводород
2) хлорид аммония
3) гидрокарбонат натрия
4) гидроксид натрия
5) фтороводород
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| X | Y |
| 5 | 1 |
7. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) CuBr2 Г) HCl(р-р) | 1) Cl2, KOH, KI 5) NaCl, H2SO4, O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
| 1 | 3 | 2 | 4 |
8. Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) Fe2O3 и HI Г) Fe3O4 и HI | 1) FeI2, I2 и H2O 6) HCl и NaНSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
| 1 | 3 | 6 | 1 |
9. Задана следующая схема превращений веществ:
Fe 

Определите, какие из указанных веществ являются веществами X и Y.
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| X | Y |
| 3 | 4 |
10. Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| КЛАСС/ГРУППА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) нитросоединение В) спирт | 1) тринитроглицерин 2) диизопропиловый эфир 4) нитротолуол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В |
| 4 | 1 | 3 |
11. Из предложенного перечня выберите два вещества, которые являются межклассовыми изомерами.
1) пропаналь
2) пропановая кислота
3) уксусная кислота
4) нитроэтан
5) глицин
Запишите в поле ответа номера выбранных веществ.
12. Из предложенного перечня выберите все вещества, которые реагируют с водородом.
1) олеиновая кислота
2) стеариновая кислота
3) ацетон
4) изопрен
5) изопропиловый спирт
Запишите в поле ответа номера выбранных веществ.
13. Из предложенного перечня выберите два вещества, которые реагируют и с глюкозой, и с фруктозой.
1) гидроксид меди (II)
2) сульфат калия
3) водород
4) медь
5) метан
Запишите в поле ответа номера выбранных веществ.
14. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х + Н2О ⟶ (кат.) изопропиловый спирт Б) Х + KMnO4 + Н2О ⟶ пропандиол-1,2 В) Х + KMnO4 + H+ ⟶ пропионовая кислота Г) Х + Н2О ⟶ (кат.) ацетон | 1) бутен-1 6) бутин-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
| 5 | 5 | 1 | 4 |
15. Установите соответствие между веществом и его способом получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную
цифрой.
| ВЕЩЕСТВО | СПОСОБ ПОЛУЧЕНИЯ |
| А) этанол Б) уксусная кислота Г) этаналь | 1) окисление этена перманганатом калия в нейтральной среде 2) щелочной гидролиз метилацетата 3) щелочной гидролиз 1,1-дихлорэтана 4) окисление бутена-2 перманганатом калия в кислой среде 5) термолиз ацетата кальция 6) восстановление ацетальдегида |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В | Г |
| 6 | 4 | 1 | 3 |
16. Задана следующая схема превращений веществ:
метан ⟶ Х ⟶ бензол ⟶ Y ⟶ толуол
Определите, какие из указанных веществ являются веществами X и Y.
1) бромметан
2) этен
3) нитробензол
4) ацетилен
5) бромбензол
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
| X | Y |
| 4 | 5 |
17. Из предложенного перечня выберите все типы реакций, к которым можно отнести взаимодействие водорода с хлором.
1) гомогенная
2) замещения
3) экзотермическая
4) нейтрализации
5) окислительно-восстановительная
Запишите номера выбранных ответов.
18. И з предложенного перечня выберите все реакции, для которых будет увеличиваться скорость реакции при добавлении кислорода.
Запишите номера выбранных ответов.
19. Установите соответствие между схемой реакции и свойством элемента фосфора, которое он проявляет в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВА ФОСФОРА |
| А) Mg + H3PO4 → Mg(H2PO4) 2 + H2 В) PH3 + O2 → H3PO4 | 1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не проявляет окислительно-восстановительных свойств |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В |
| 4 | 2 | 2 |
20. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции,
обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) бромид лития Б) сульфат натрия В) хлорид алюминия | 1) водород, галоген 2) металл, галоген 3) водород, кислород 4) металл, кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
| А | Б | В |
| 1 | 3 | 1 |
| Для выполнения задания 21 используйте следующие справочные данные. Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V). pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды. 21. Д ля веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л). Запишите номера веществ в порядке возрастания значения pH их водных растворов. 22. У становите соответствие между способом воздействия на равновесную систему S 2− (р-р) + H2O(ж.) ⇆ HS − (р-р) + OH − (р-р) — Q и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
23. В реактор постоянного объёма поместили некоторое количество серного ангидрида. В результате протекания обратимой реакции в реакционной системе установилось химическое равновесие. Используя данные, приведённые в таблице, определите равновесную концентрацию сернистого газа (X) и равновесную концентрацию кислорода (Y). Выберите из списка номера правильных ответов.
24. Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
25. Установите соответствие между названием вещества и основной областью применения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в таблицу выбранные цифры под соответствующими буквами.
27. Синтез углекислого газа протекает в соответствии с термохимическим уравнением реакции Определите объем (в л) кислорода, который образуется в результате выделения 944 кДж тепла. (Запишите число точностью до целых.) 28. 175 г технического карбоната магния, содержащего 4% некарбонатной примеси, нагрели. Найдите объем (в л) выделившегося газа (н.у.) (Запишите число с точностью до десятых.)
29. Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция, в которой в растворе образуется только кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции. 2Cl 0 S +4 30. Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена, в результате которой из окрашенного раствора выпадает осадок. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. 31. Бромоводородной кислотой нейтрализовали карбонат калия. Через полученный раствор пропустили электрический ток. Образовавшийся на катоде газ пропустили над нагретым оксидом меди (II). Полученное простое вещество растворили в концентрированном растворе азотной кислоты. Напишите уравнения четырёх описанных реакций 2KBr + 2H2O 32. Н апишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 ⟶ Х1 ⟶ бутин-1 ⟶ Х2 ⟶ гексин-3 При написании уравнений реакций используйте структурные формулы органических веществ. CH3CH2CH=CH2 + Cl2 →
5CH3-CH2-C≡C-CH2-CH3 + 6KMnO4 + 9H2SO4 33. К раствору сульфата железа (III) массой 632 г, содержащего в общей сложности 1,806∙10 25 атомов кислорода, добавили 79 г сульфита калия. После окончания реакции к образовавшемуся раствору прилили 552 г 10%-ного раствора карбоната калия. Вычислите массовую долю сульфата калия в образовавшемся растворе. (Образованием кислых солей пренебречь.) В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин). nO = 1,306·10 25 /6,02·10 23 = 30 моль тогда nFe = 2x моль, nS = 3x моль, n1(O) = 12x моль у + 12х = 30 ω(K2SO4) = (0,4+0,5)·174/(632+79+552 — 0,4·44) = 0,1257 или 12,57% 34. При взаимодействии соли первичного амина с нитратом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 25,93% азота, 7,41% водорода и 44,44% кислорода по массе. Напишите уравнение реакции получения вещества А из соли первичного амина и нитрата серебра. На основании данных условия задания: m(N) = 25,93г n(N) = 25,93/14 = 1,852143 моль Видео:Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  20.04.2022 Работа статград ЕГЭ химия 11 класс варианты ХИ2110501-ХИ2110504 с ответамиПОДЕЛИТЬСЯТренировочная работа №5 статград по химии 11 класс составлена по образцу экзамена ЕГЭ 2022 года , 4 тренировочных варианта ХИ2110501, ХИ2110502, ХИ2110503, ХИ2110504 с ответами и решением на все задания. Официальная дата проведения работы статград 20 апреля 2022 года. Работа статград ЕГЭ 2022 по химии состоит из двух частей, включающих в себя 34 задания. Часть 1 содержит 28 заданий с кратким ответом, часть 2 содержит 6 заданий с развёрнутым ответом. Тренировочная работа №5 статград ЕГЭ 2022 по химии 11 классЗадания и ответы с варианта ХИ2110501Для выполнения заданий 1–3 используйте следующий ряд химических элементов: Элементы: 1) Cl, 2) Mn, 3) F, 4) Br, 5) Fe Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1)Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns2 np4 nd1 ? Запишите номера выбранных элементов в порядке возрастания. Ответ: 14 2)Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке усиления кислотных свойств водородного соединения. Запишите в поле ответа номера выбранных элементов в нужной последовательности. Ответ: 314 3)Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +2. Запишите в поле ответа номера выбранных элементов в порядке возрастания. Ответ: 25 4)Из предложенного перечня выберите два вещества, в молекулах которых имеется двойная связь. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 45 5)Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) несолеобразующего оксида; Б) двухосновной кислоты; В) комплексной соли. Ответ: 561 6)В двух колбах находился раствор сульфата железа(III). В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выпал бурый осадок, а во второй выпал такой же осадок и выделился газ. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Ответ: 14 7)Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. А) CaO Б) FeS В) CO2 Г) MgI2
Ответ: 5213 11)Из предложенного перечня выберите два вещества, в молекулах которых имеется хотя бы одна π-связь. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 25 12)Из предложенного перечня выберите все вещества, способные окислять алкены. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 345 13)Из предложенного перечня выберите два вещества, которые реагируют с анилином. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 12 14)Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. А) бензол и пропен в присутствии AlCl3 Б) ацетиленид натрия и избыток бромметана В) 2-метилбутан и бром при нагревании Г) 2-метилпропен и перманганат калия (подкисленный раствор).
Ответ: 6124 17)Из предложенного перечня выберите все окислительно-восстановительные реакции. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 123 18)Из предложенного перечня выберите все реакции, скорость которых уменьшается при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания.
19)Установите соответствие между схемой реакции и свойством, которое проявляет элемент фосфор в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. А) POCl3 + H2O → H3PO4 + HCl Б) P2O3 + HNO3 → H3PO4 + NO + H2O В) H3PO2 → PH3 + H3PO4.
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих концентрацию 0,1 моль/л. Расположите эти вещества в порядке возрастания pH водного раствора. Запишите номера веществ в правильном порядке.
26)В 100 г воды растворили 35 г медного купороса (пентагидрата сульфата меди(II)). Рассчитайте массовую долю (в %) сульфата меди(II) в растворе. (Запишите число с точностью до десятых.) 27)Разложение оксида серебра описывается термохимическим уравнением: 2Ag2O = 4Ag + O2 – 62 кДж При разложении навески оксида серебра поглотилось 1,55 кДж теплоты. Сколько граммов серебра образовалось? (Запишите число с точностью до десятых.) 28)Для окисления бромоводородной кислоты потребовалось 5,01 г бромата калия. Сколько граммов HBr вступило в реакцию? (Запишите число с точностью до сотых.) 29)Для выполнения заданий 29 и 30 используйте следующий перечень веществ: нитрат натрия, хлорат калия, аммиак, гидросульфит натрия, разбавленная серная кислота, хлорид хрома(III). Допустимо использование водных растворов веществ и воды в качестве среды для протекания реакций. Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция, происходящая без выделения газа и без изменения цвета раствора. В ответе запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 30)Из предложенного перечня выберите два вещества, которые вступают в реакцию ионного обмена с выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ. 31)Иод нагрели с 30 %-м раствором пероксида водорода. Полученный раствор упарили, а затем охладили. Выпал осадок, который высушили и прокалили. Над твёрдым остатком от прокаливания пропустили газ, полученный нагреванием муравьиной кислоты с концентрированной серной кислотой, и наблюдали потемнение твёрдого вещества. Напишите молекулярные уравнения четырёх описанных реакций. 32)Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ. 33)Смесь аммиака с кислородом общим объёмом 11,2 л (н. у.) подожгли без катализатора, продукты охладили, а образовавшуюся смесь газов пропустили через 117,6 г 10 %-го раствора серной кислоты, в результате масса раствора увеличилась. Объём оставшегося непоглощённым газа составил 2,24 л (н. у.). Вычислите объёмные доли газов в исходной смеси и массовые доли веществ (кроме воды) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления. 34)Неизвестное органическое вещество X содержит 72,0 % углерода, 12,0 % водорода по массе и кислород. Это легкоплавкое твёрдое вещество. Его получают гидрированием ароматического соединения. Оно реагирует с подкисленным раствором перманганата калия, а при окислении концентрированной азотной кислотой превращается в неразветвлённую двухосновную кислоту. Определите молекулярную формулу вещества X и установите его структуру. Напишите уравнение взаимодействия X с азотной кислотой (в уравнении используйте структурные формулы органических веществ). Задания и ответы с варианта ХИ21105021)Для выполнения заданий 1–3 используйте следующий ряд химических элементов: Элементы: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns2 np3 nd1 ? Запишите номера выбранных элементов в порядке возрастания. Ответ: 15 2)Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. Ответ: 513 3)Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. Ответ: 24 4)Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 15 6)В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции.
Ответ: 24 11)Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 14 12)Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 245 13)Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания.
Ответ: 14 17)Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. Запишите номера выбранных ответов в порядке возрастания.
18)Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания.
21)Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих концентрацию 0,05 моль/л. Расположите эти вещества в порядке уменьшения pH водного раствора. Запишите номера веществ в правильном порядке.
26)В 100 г воды растворили 42,9 г кристаллической соды (декагидрата карбоната натрия). Рассчитайте массовую долю (в %) карбоната натрия в растворе. (Запишите число с точностью до десятых.) 27)Разложение безводного нитрата магния описывается термохимическим уравнением: 2Mg(NO3)2 = 2MgO + 4NO2 + O2 – 4150 кДж При разложении навески нитрата поглотилось 332 кДж теплоты. Сколько граммов оксида магния образовалось? (Запишите число с точностью до десятых.) 28)Для полного восстановления сульфата бария потребовалось 2,688 л (в пересчёте на н. у.) водорода. Сколько граммов твёрдого продукта образовалось? (Запишите число с точностью до сотых.) 29)Для выполнения заданий 29 и 30 используйте следующий перечень веществ: серная кислота, хлорид цинка(II), нитрат калия, гидрокарбонат калия, оксид кремния, карбонат железа(II). Допустимо использование водных растворов веществ и воды в качестве среды для протекания реакций. Из предложенного перечня выберите вещества, между которыми протекает окислительно-восстановительная реакция с выделением газов. В ответе запишите уравнение реакции. Составьте электронный баланс, укажите окислитель и восстановитель. 30)Из предложенного перечня выберите вещества, которые вступают в реакцию ионного обмена с образованием осадка. В ответ запишите уравнение только одной из возможных реакций. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ. 31)Марганец растворили в разбавленной азотной кислоте. Полученный раствор выпарили и прокалили до постоянной массы. Полученное тёмно-коричневое вещество смешали с хлоратом калия и карбонатом калия, твёрдую смесь прокалили, в результате выделился газ и образовалось зелёное вещество, которое растворили в воде. При добавлении к полученному раствору разбавленной соляной кислоты выпал тёмный осадок, а раствор окрасился в малиновый цвет. Напишите молекулярные уравнения четырёх описанных реакций. 33)Смесь метана с кислородом общим объёмом 11,2 л (н. у.) подожгли, продукты охладили, а образовавшуюся смесь газов пропустили через 67,2 г 10 %-го раствора гидроксида калия. Непоглощённый газ пропустили через трубку с раскалённой медью, в результате масса трубки увеличилась на 6,4 г. Вычислите объёмные доли газов в исходной смеси и массовые доли веществ (кроме воды) в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления. 34)Неизвестное органическое вещество X содержит 73,5 % углерода, 10,2 % водорода по массе и кислород. Это легкоплавкое твёрдое вещество. Его получают окислением кислородом неразветвлённого циклического углеводорода. Вещество X не реагирует с перманганатом калия и с аммиачным раствором оксида серебра, но при окислении концентрированной азотной кислотой превращается в неразветвлённую двухосновную кислоту. Определите молекулярную формулу вещества X и установите его структуру. Напишите уравнение взаимодействия X с азотной кислотой (в уравнении используйте структурные формулы органических веществ). 🌟 ВидеоРасчетный интенсив. Все 27 и 28 задачи ЕГЭ по химии за 1 урок | Екатерина СтрогановаСкачать  ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать  Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать  Химия 9 класс — Как определять Степень Окисления?Скачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать  Химические уравнения. Как составлять химические уравнения.Скачать  Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать  |

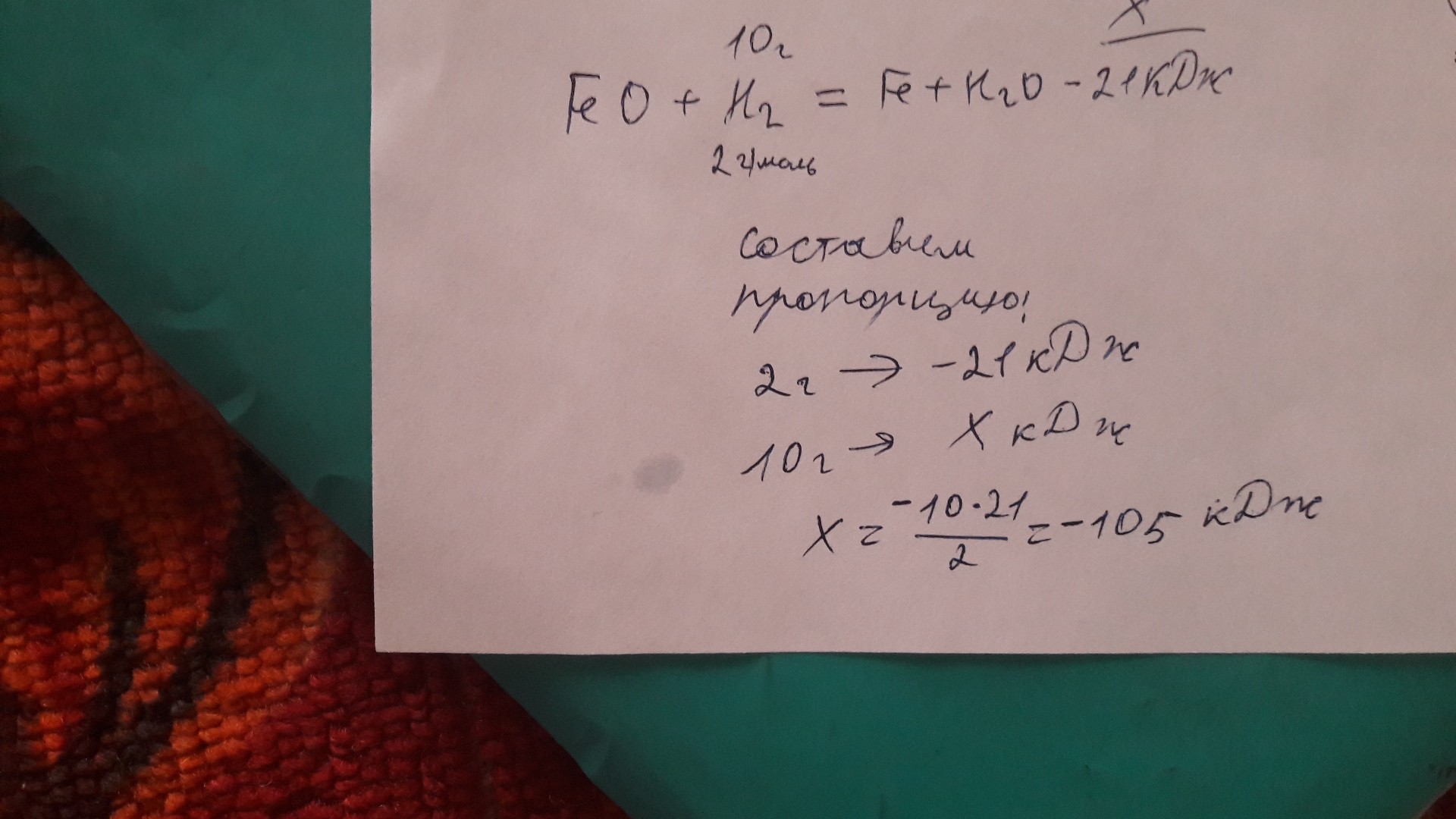










 2Cl − Cl2 0 – окислитель
2Cl − Cl2 0 – окислитель S +6 SO2 +4 – восстановитель
S +6 SO2 +4 – восстановитель H2 + 2KOH + Br2
H2 + 2KOH + Br2 Х3
Х3
 10CH3CH2COOH + 3K2SO4 + 6MnSO4 + 4H2O
10CH3CH2COOH + 3K2SO4 + 6MnSO4 + 4H2O