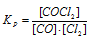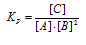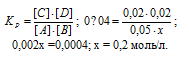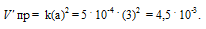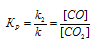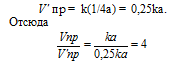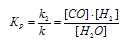- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Вычисление константы равновесия системы и исходных концентраций реагирующих веществ
- Константа равновесия химической реакции
- Скорость реакции
- Равновесие гомогенной системы
- Химия NeoChemistry — мы знаем о химии всё
- 💥 Видео
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Опыты по химии. Получение оксида азота (II); окисление его кислородомСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7001adf92c0a97a9 • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:Оксиды азота. Оксид азота(IV)Скачать

Вычисление константы равновесия системы и исходных концентраций реагирующих веществ
Видео:Получение оксида азота (IV) и его конденсация / Obtaining and condensation of nitrogen oxideСкачать

Константа равновесия химической реакции
Задание 128.
В гомогенной системе СО + Сl2 ↔ СОСl2 равновесные концентрации реагирующих веществ (моль/л): [СО] = 0,2; [Сl2] = 0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации Сl2 и СО. Ответ:
К р = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 1,2/(0,2 . 0,3) = 20.
Для нахождения исходных концентраций веществ СО и Cl2 учтём, что, согласно уравнению реакции, из 1 моль Со и 1 моль Cl2 образуется 1 моль COCl2. Поскольку по условию задачи в каждом литре системы образовалось 1,2 моль COCl2, то при этом было израсходовано 1,2 моль СО и 1,2 моль Cl2. Таким образом, искомые исходные концентрации равны:
Ответ: К = 20; [С12]исх = 1,5 молы/л; [СO]исх = 1.4 молы/л.
Задание 129.
В гомогенной системе А + 2В = С равновесные концентрации реагирующих газов (молы/л): [А] = 0,06; [В] = 0,12; [С] = = 0,216. Вычислите константу равновесия системы и исходные концентрации веществ А и В. Ответ: К = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Решение:
Уравнение реакции имеет вид:
Выражение константы равновесия данной реакции имеет вид:
Подставляя в него данные задачи, получим:
Кр = 0,216/[0,06 . (0,12)2] = 250.
Для нахождения исходных концентраций веществ А и В учтём, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль C. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль C, то при этом было израсходовано 0,216 моль А и 0,432 моль В.
Таким образом, искомые исходные концентрации равны:
[А]исх = 0,06 + 0,216 = 0,276 молы/л;
[В]исх = 0,12 + 0,432 = 0,552 молы/л.
Ответ: Кр = 250; [А] = 0,276 моль/л; [В] = 0,552 моль/л.
Задание 130.
В гомогенной газовой системе А + В С ↔ С + D равновесие установилось при концентрациях (моль/л): [В] = 0,05 и [С] 0,02. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В. Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Решение:
Уравнение реакции имеет вид:
Обозначим исходную концентрацию вещества А через х. По уравнению реакции в результате взаимодействия веществ А и В образуются одинаковые количества вещества С и D, т. е. равновесные концентрации продуктов будут равны: [С] = [D] = 0,02 моль/л. Подставляем равновесные концентрации веществ в выражение константы равновесия:
Поскольку по условию задачи в каждом литре системы образовалось 0,02 моль веществ C и D, то при этом было израсходовано 0,02 моль А и 0,02 моль В. Таким образом, искомые исходные концентрации равны:
[А]исх = 0,2 + 0,02 = 0,22 молы/л;
[В]исх = 0,05 + 0,02 = 0,07 молы/л.
Ответ: [А] = 0,22 моль/л; [В] = =0,07 молы/л.
Видео:Оксиды азота. Оксид азота(II)Скачать

Скорость реакции
Задание 131.
Константа скорости реакции разложения N2O, протекающей по уравнению 2N 2 O = 2N 2 + О 2, равна 5 . 10 -4 . Начальная концентрация N2О равна 6,0 моль/л. Вычислите начальную скорость реакции и её скорость, когда разложится 50% N2O. Ответ: 1,8 . 10-2; 4,5 . 10 -3 .
Решение:
Уравнение реакции имеет вид:
Обозначим начальную концентрацию исходного вещества: [N2O] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации N2O равна:
Vпр = ka2 = 5 . 10 -4 . (6) 2 = 1,8 . 10 -2 .
После разложения 50% N2O, концентрация его будет равна 3 моль/л (50 . 6/100 = 3). При новой концентрации N2O скорость прямой реакции ( пр) равна:
Ответ: 1,8 . 10 -2 ; 4,5 . 10 -3 .
Задание 132.
Напишите выражение для константы равновесия гетерогенной системы
СО2 + С ↔ 2СО. Как изменится скорость прямой реакции образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия системы:
При гетерогенной реакции учитываются только концентрации газообразных веществ. Обозначим концентрацию исходного вещества: [CO2] = a. Согласно закону действующих масс, скорость прямой реакции до изменения концентрации равна: Vпр = ka. После уменьшения концентрации СО2 в 4 раза её значение можно записать так: [CO2] = 1/4a. При новой концентрации СО2 скорость прямой реакции пр будет равна:
Следовательно, при уменьшении концентрации СО2 в 4 раза скорость прямой реакции уменьшится в 4 раза.Так как в данной системе происходит увеличение объёма (из 1 моль газообразного исходного вещества образуется
2 моль газообразного продукта реакции), то для смещения равновесия в данной системе в сторону прямой реакции – образовании СО надо уменьшить давление в системе.
Задание 133.
Напишите выражение для константы равновесия гетерогенной системы
С + Н2О (г) ↔ СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции — образования водяных паров?
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы. В выражении для гетерогенной системы концентрации твёрдых веществ не указываются. Выражение константы равновесия для данной реакции:
а) Смещение равновесия в сторону образования водяных паров можно достигнуть увеличением концентрации СО или Н2, так и уменьшением концентрации паров воды, так как, согласно принципу Ле Шателье, равновесие в системе сместится в сторону той реакции, которая ослабляет это воздействие.
б) Так как в данной системе из углерода и водяных паров образуются углекислый газ и водород, т. е. в данной системе увеличивается объём (из 1 моль газа образуется 2 моль газов), то для смещения равновесия в сторону образования паров воды надо увеличить давление.
Видео:В системе, в которой реакция протекает. Уразова Томирис, Химия-01 301Скачать

Равновесие гомогенной системы
Задание 134.
Равновесие гомогенной системы
4НСI (г) + О 2 ↔ 2Н2О (г) + 2Сl2 (г)
установилось при следующих концентрациях реагирующих веществ (молы/л): [Н2O]P = 0,14; [С12]P = 0,14; [НС1]P = 0,20; [O2]р = О,32. Вычислите исходные концентрации хлороводорода и кислорода. Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Решение:
Уравнение реакции имеет вид:
Для нахождения исходных концентраций хлороводорода и кислорода учтём, что согласно уравнению реакции из 4 моль HCl 1 моль О2 образуется 2 моль Н2О и 2 моль Cl2. Поскольку по условию задачи в каждом литре системы образовалось 0,14 моль Н2О и 0,14 моль Cl2, то при этом было израсходовано 0,14 . 4/2 = 0,28 моль HCl и ,
14 . 1/2 = 0,07 моль Cl2. Таким образом, искомые концентрации HCl и Cl2 равны:
Ответ: [НС1]исх = 0,48 моль/л; [О2]исх = 0,39 моль/л.
Видео:Разложение нитратов за 5 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Химия NeoChemistry — мы знаем о химии всё
| Задачи по химии (с решениями) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия общая | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| Химия неорганическая | |||||||||
|---|---|---|---|---|---|---|---|---|---|
|
Начальные концентрации реагирующих веществ были (моль/л): СNО =0,8; СО2 =0,6. Как изменится скорость реакции, если концентрацию кислорода увеличить до 0,9моль/л, а концентрацию оксида азота (II) – до 1,2 моль/л
Решение:
Зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ.
V =К [NО]2[О2]
Обозначим скорость реакции до изменения концентраций V1, а после изменения концентраций V2
Тогда V1=К*0,82*0,6
V2 = К*1,22*0,9
изменение скорости (V2/V1) равно:
V2/V1 = (К*1,22*0,9)/ К*0,82*0,6 =1,44*0,9/0,64*0,6=3,4
Ответ: Скорость реакции возрастет в 4 раза.
💥 Видео
Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

РАЗБИРАЕМ ХИМИЮ САМЫХ СЛОЖНЫХ ЭЛЕМЕНТОВ | Химические свойства азота и фосфораСкачать

Равновесие в системе диоксида азота и его димерСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Димеризация оксида Азота (IV)Скачать

задачи по химии "Зависимость скорости химической реакции от концентрации реагирующих веществ"Скачать

Получение оксида азота (IV)Скачать

Тепловой эффект реакции. Экзотермические и эндотермические реакцииСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

08 Азот 2 оксиды азотаСкачать