== «В основе потенциометрического метода анализа лежит измерение:» Ответы на вопрос: 2. Приоритет 1. Текст: «электродных потенциалов» 18
Ответы на вопрос: 1. Приоритет 1. Текст: «коллоидными частицами» 2. Приоритет 1. Текст:»грубодисперсными»
== «Раствор какого электролита из ниже перечисленных при одинаковой моль эквивалентной концентрации наиболее эффективно вызовет коагуляцию отрицательно заряженного золя? Ответы на вопрос: 5. Приоритет 1. Текст: «AlCl3»
== «Какой знак заряда гранулы мицеллы золя СdS, полученного по реакции CdSO4 c Na2S при избытке первого?» Ответы на вопрос: 1. Приоритет 1. Текст: «положительный»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы» Ответы на вопрос: 2. Текст: «топочный дым». Поставлен в соответствие с (1).»твердая» 3. Текст: «пена». Поставлен в соответствие с (1).»газообразная» 4. Текст: «мазут». Поставлен в соответствие с (1).»жидкая»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Ag+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Li»
== «Назовите какой продукт образуется при реакции H2SO4 конц с K, если реакция возможна.» Ответы на вопрос: 2. Приоритет 1. Текст: «H2S
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «Назовите какой продукт образуется при реакции H2SO4 конц. с Ca, если реакция возможна.» Ответы на вопрос: 1. Приоритет 1. Текст: «H2S
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?» Ответы на вопрос: 4. Приоритет 1. Текст: «Fe2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора MgCl2 Ответы на вопрос: 2. Приоритет 1. Текст: «H2»
== «Определите анодную реакцию в марганцево-магниевом гальваническом элементе.» Ответы на вопрос: 2. Приоритет 1. Текст: «Mg — 2e ? Mg2+»
== «Определите анодную реакцию в серебряно-цинковом гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Zn — 2e ? Zn2+»
== «Какое вещество, выделяется на аноде при электролизе водного раствора KCL» Ответы на вопрос: 4. Приоритет 1. Текст: «Cl2
== «Какое вещество, выделяется на аноде при электролизе водного раствора K2SO4» Ответы на вопрос: 2. Приоритет 1. Текст: «O2»
== «Определите катодную реакцию в железо-медном гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Cu2++2e ? Cu»
== «Какой из перечисленных металлов будет служить протектором для стальной конструкции. » Ответы на вопрос: 4. Приоритет 1. Текст: «никакой»
== «Какой из перечисленных металлов будет служить протектором для алюминиевого кабеля. «Ответы на вопрос: 2. Приоритет 1. Текст: «никакой»
== «Какой из перечисленных металлов будет служить протектором для медного кабеля.» Ответы на вопрос: 1. Приоритет 1. Текст: «Ni»
== «Возможна ли коррозия железной конструкции в воде, содержащей растворенный кислород? Если возможна, выберите уравнение анодного процесса Ответы на вопрос: 2. Приоритет 1. Текст: «Fe -2e ? Fe2+
== «Какой из перечисленных металлов будет служить протектором для медного кабеля. » Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «При взаимодейстии разбавленной серной кислоты с цинком выделяется водород.» Ответы на вопрос: 2. Приоритет 1. Текст: «да»
== «Люминесцентный анализ относится к методам:» Ответы на вопрос: 4. Приоритет 1. Текст: «спектральным»
== Потенциометрическим методом анализа определили потенциал водородного электрода?= -0,3в Определить PH этого раствора: образец ответа: 7 Ответы на вопрос: 1. Приоритет 1. Синонимы: «5»
== «Раствор соли Сu(II) при действии раствора аммиака NH3, приобрел цвет : Ответы на вопрос: 2. Приоритет 1. Текст: «ярко-синий»
== «К какому типу реакций, используемых при идентификации относится данная реакция: Cu(OH)2 + 2NaOH =Na2[Сu(OH)4] Ответы на вопрос: 3. Приоритет 1. Текст: «комплексообразования»
== «Методы анализа, основанные на измерении интенсивности светового потока, прошедшего через окрашенный раствор, относятся к . » Ответы на вопрос: 2. Приоритет 1. Текст: «колориметрическим» == «В сточной воде предполагается присутствие ионов Fe2+. C помощью какого реактива можно их обнаружить: » Ответы на вопрос: Приоритет 1. Текст: «K3[Fe(CN)6]» 19
== «Ядро коллоидной частицы имеет заряд » Ответы на вопрос: 2. Приоритет 1. Текст: «нет»
== «Какие из перечисленных систем относятся к дисперсным системам: » Ответы на вопрос:
1. Приоритет 1. Текст: «порошок»
2. Приоритет 1. Текст: «нефть»
4. Приоритет 1. Текст: «мазут»
== «Дисперсная система состоит из жидкой дисперсионной среды и жидкой дисперсной фазы. Как можно назвать такую систему?» Ответы на вопрос: 3. Приоритет 1. Текст: «эмульсия»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы » Ответы на вопрос: 1. Текст: «нефть». Поставлен в соответствие с (1).»жидкая» 2. Текст: «пенопласт». Поставлен в соответствие с (1).»газообразная» 5. Текст: «ситалл». Поставлен в соответствие с (1).»твердая»
== «Соотнесите название дисперсной системы с агрегатным состоянием дисперсной фазы » Ответы на вопрос: 3. Текст: «пенобетон». Поставлен в соответствие с (1).»газообразная» 4.
Текст: «кермет». Поставлен в соответствие с (1).»твердая» 5. Текст: «молоко». Поставлен в соответствие с (1).»жидкая»
== «Губка зто дисперсная система с твердой ДФ и жидкой ДС?» Ответы на вопрос: 1. Приоритет 1. Текст: «НЕТ»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Cа»
== «Назовите какой продукт образуется при реакции H2SO4 конц. с Ca, если реакция возможна.
Ответы на вопрос: 1. Приоритет 1. Текст: «H2S
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 2. Приоритет 1. Текст: «Ag+»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Zn2+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 4. Приоритет 1. Текст: «Al»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 1. Приоритет 1. Текст: «Fe» == «Определите катодную реакцию в серебряно-магниевом гальваническом элементе.» Ответы на вопрос: 3. Приоритет 1. Текст: «Ag+ + e ? Ag»
== «Какое вещество, выделяется на аноде при электролизе водного раствора KCl» Ответы на вопрос: 2. Приоритет 1. Текст: «Cl2
== «Определите анодную реакцию в медно-цинковом гальваническом элементе.» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn — 2e ? Zn2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора Na2SO4» Ответы на вопрос:3. Приоритет 1. Текст: «H2»
== «Определите анодную реакцию в железо-медном гальваническом элементе. » Ответы на вопрос: 4. Приоритет 1. Текст: «Fe — 2e ? Fe2+»
== «Какое вещество, выделяется на катоде при электролизе водного раствора KJ » Ответы на вопрос: 4. Приоритет 1. Текст: «H2»
== «Какими из металлов было защищено от коррозии Sn, если на аноде протекает процесс: Zn — 2e ? Zn2+» Ответы на вопрос: 2. Приоритет 1. Текст: «Zn»
== «При электролизе водного раствора гидроксида калия на катоде выделяется: » Ответы на вопрос: 3. Приоритет 1. Текст: «водород»
== «Какими из металлов был защищен от коррозии Zn, если на аноде протекает процесс: Zn — 2e ? Zn2+» Ответы на вопрос: 3. Приоритет 1. Текст: «Ni» == «Железная пластинка покрыта серебром. Определить характер покрытия.» Ответы на вопрос: 2. Приоритет 1. Текст: «катодное»
== «При взаимодейстии концентрированной серной кислоты с металлами никогда не выделяется водород.» Ответы на вопрос: 1. Приоритет 1. Текст: «да» == «Покрытие железа хромом является анодным Ответы на вопрос: 1. Приоритет 1. Текст: «да
== «Какие из катионов при действии щелочи образуют осадок гидроксида, который растворяется в избытке щелочи : Ответы на вопрос:2. Приоритет 1. Текст: «Zn(II)» 4. Приоритет 1. Текст: «Al(III)» 5. Приоритет 1. Текст: «Cr(III)»
== «В расчетах при использовании потенциометрического метода анализа в уравнении: ?=?0(NO3)-/NH3 + 0,06/n * lgC величина «n» равна :образец ответа: 9 Ответы на вопрос: 1. Приоритет 1. Синонимы: «8»
== «К какому типу реакций, используемых при идентификации относится данная реакция: 2NaOH + Zn(OH)2 ? Na2[Zn(OH)4] Ответы на вопрос: 3. Приоритет 1. Текст: «комплексообразования»
== «Соотнесите :» Ответы на вопрос: 1. Текст: «титриметрический». Поставлен в соответствие с (1).»обьемный» 2. Текст: «гравиметрический». Поставлен в соответствие с (1).»весовой» == «В основе титриметрического метода анализа лежит закон:» Ответы на вопрос: 3. Приоритет 1. Текст: «эквивалентов»
== «Различная сорбционная способность определяемых веществ лежит в основе метода анализа: Ответы на вопрос: Приоритет 1. Текст: «хроматографического»0 == «Золь СdS по реакции между растворами K2S и Cd(NO3)2 при избытке первого. Какой из ионов будет потенциалопределяющим? » Ответы на вопрос:1. Приоритет 1. Текст: «S 2-2. Приоритет 0. Текст: «Cd 2+
== «Какие из перечисленных систем относятся к дисперсным системам:» Ответы на вопрос: 1. Приоритет 1. Текст: «молоко» 3. Приоритет 1. Текст: «порошок» 4. Приоритет 1. Текст: «паста»
== «Золь СdS по реакции между растворами K2S и Cd(NO3)2 при избытке последнего. Какой из ионов будет потенциалопределяющим?» Ответы на вопрос: 2. Приоритет 1. Текст: «Cd 2+ == «Какие из перечисленных систем относятся к дисперсным системам:» Ответы на вопрос: Приоритет 1. Текст: «порошок» 3. Приоритет 1. Текст: «почва » 4. Приоритет 1. Текст: «ситалл»
== «Губка зто дисперсная система с твердой ДФ и жидкой ДС?» Ответы на вопрос: Приоритет 1. Текст: «НЕТ»
«Дисперсная система состоит из твердой дисперсионной среды и твердой дисперсной фазы. Как можно назвать такую систему?» «твердая суспензия»
== «Назовите газообразный продукт, при реакции HNO3 конц. с Ag, если реакция возможна.» Ответы на вопрос: 1. Приоритет 1. Текст: «NO2
== «Назовите ион, который легче всего восстанавливается в стандартных условиях,используя значение ?0 Ответы на вопрос: 3. Приоритет 1. Текст: «Ag+»
== «Назовите вещество, которое легче всего окисляется в стандартных условиях, используя значение ?0» Ответы на вопрос: 4. Приоритет 1. Текст: «Cа»
== «Назовите ион, который легче всего восстанавливается в стандартных условиях, используя значение ?0» Ответы на вопрос:2. Приоритет 1. Текст: «Zn2+»
«Назовите какой продукт образуется при реакции H2SO4 конц. с Cd, если реакция возможна.»»H2″
«Какое вещество, выделяется на аноде при электролизе водного раствора CaSO4»«O2»
«Какое вещество, выделяется на катоде при электролизе водного раствора NaJ«H2»
«Какое вещество, выделяется на аноде при электролизе водного раствора Na2SO4»«O2»
«Какое вещество, выделяется на аноде при электролизе водного раствора KJ«J2
«При электролизе расплава хлорида серебра на катоде выделяется:«серебро»
«При электролизе расплава хлорида алюминия на катоде выделяется:«алюминий»
«Какой из перечисленных металлов будет служить протектором для свинцового кабеля.»Ni»
«Потенциометрическим методом анализа определили потенциал водородного электрода. ?= -0,6 в Определить PH этого раствора:«10»
«В калориметрии измеряемой величиной является:«тепловой эффект реакции»
«В расчетах при использовании потенциометрического метода анализа в уравнении: ?=?0(NO3)-/NO + 0,06/n * lgC величина «n» равна«3»
«Инфракрасная спектроскопия используется для:«всего вышеперечисленного» «В кондуктометрическом методе анализа измеряемой величиной является: «электрическая проводимость»
«Расчеты результатов определений в титриметрии основаны на законе: эквивалентов»
«Cоотнесите: Термодинамическую характеристику реакции с возможностью самопроизвольного протекания реакцииG 0″реакция невозможна»
«Cooтнесите вещества с с соответствующим типом химической связи:
«Ba». металлическая» «NСl».ионная» «HF». Ковалентная полярная»»Cl2″.ковалентная
«Cooтнесите вещества с соответствующим типомхимической связи: ««Br2 «.ковалентная неполярная» «Pb». металлическая»NH4Cl». ионная» «NH3». ковалентная
«Определите значение константы равновесия системы: 3H2(г)+N2(г)?2NH3(г), если в реакционном
сосуде обьемом 1 литр содержится: 0,2 моля Н2, 0,2 моля N2, 2,2 моля NН33025
«Равновесие реакции: А+3В?2С установилось при следующих концентрациях реагирующих веществ, моль/л: *A+=3,5 *B+=2,8 *C+=4,6 Рассчитать константу равновесия этой реакции.«0,275»
«Как следует одновременно изменить температуру и давление в системе: 2CO(г)+O2(г)? 2СО2(г) ?H
- Броматометрия метод (прямая и обратная)
- Литература
- Полезно знать
- Потенциометрические методы анализа и их типы
- Потенциометрия
- Основы потенциометрии
- Области использования потенциометрии
- Сущность метода потенциометрического метода анализа
- Прямая потенциометрия
- Титрование
- Принципы титрования
- Преимущества потенциометрии
- Особенности и недостатки потенциометрии
- Преимущества потенциометрического метода анализа
- Преимущества потенциометрического титрования
- 🔍 Видео
Видео:Потенциометрические определения.Скачать

Броматометрия метод (прямая и обратная)
Броматометрия — титриметрический метод определения восстановителей, а также органических субстанций, которые реагируют с бромом. При титровании рабочим раствором КBrO3 происходит реакция:
BrO3- + 6H + + 6ë 2arrow.eps Br — + 3H2 O (Е0 = 1,45 В),
избыточная капля титранта окисляет бромид-ионы по уравнению
BrO3- + 5Br- + 6H + 2arrow.eps 3Br2 + 3H2O
к свободному брому, который окрашивает раствор в желтый цвет (безиндикаторне титрования) или обесцвечивает индикатор (метиловый красный, метиловый оранжевый). Конечную точку титрования определяют также потенциометрическим или фотометрическим методами.
Титрование органических соединений происходит при добавлении в раствор титранта избытка КBr (бромид-броматная смесь). Бром, образующийся взаимодействует с органическим соединением, поэтому иногда бромид-броматометрию относят к броматометрии, основанной на использовании стандартного раствора Br2.
В методике броматометрии при использовании в качестве титранта водного раствора KBrO3 избыток KBr добавляют к раствору, который анализируют, перед титрованием. При обратном броматометрическом методе титрования бром, образовавшийся при взаимодействии бромат-ионов с бромид-ионами, окисляет добавленный в избытоке KI до свободного иода, который титруют раствором Na2S2O3 в присутствии индикатор (крахмала) или определяют методом обратного арсенитометрического титрования:
H3AsO4 + 2H + + 2ē 2arrow.eps HAsO2 + 2H2O
В этом случае к раствору, содержащему свободный бром, добавляют стандартный раствор NaAsO2, избыток которого титруют KBrO3 (индикатор — метиловый оранжевый, метиловый красный). Метод броматометрии использую для определения соединений Cu (I), Sb (III), As (III), Sn (II), Fe (II), гидразина, гидроксиламина, семикарбазида, муравьиной кислоты, а также ароматических (фенолы, крезолы, ароматические амины, резорцинол) и ненасыщенных органических соединений, способных к реакциям замещения или присоединения Br2 соответственно; для косвенного определения катионов металлов (Al3 +, Mn2 +, Mg2 +, Fe3 +, Zn2 +), образующие с 8-оксихинолина малорастворимые соединения.
Существует также обратная броматометрия.
Видео:Определение рН потенциометрическим методомСкачать

Литература
Берка А., Вултерин Я., зыка Я. Новые окислительно-методы в аналитической химии. — М., 1968.
Видео:Определение концентрации вещества в растворе методом титриметрииСкачать

Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Видео:Оптические методы анализа. Часть 1.Скачать

Потенциометрические методы анализа и их типы
Чтобы получить более полное представление о том, что такое потенциометрические методы анализа, зачем они существуют, и каково их предназначение, необходимо начать разбираться с самой потенциометрии. Этим мы сейчас и займемся.
Видео:Потенциометрические методы анализаСкачать

Потенциометрия
Начать объяснение стоит с того, что же такое потенциометрия. Это не какая-то отдельная область науки или что-то в этом роде. Данный подраздел включает в себя совокупность всех физико-химических методов проведения исследований, которые существуют, но с одним небольшим условием. Сюда входят лишь те их них, которые базируются на измерении электродвижущей силы цепей.
Данные цепи состоят из двух основных элементов:
- индикаторного электрода;
- электрода сравнения.
Для того чтобы использовать потенциометрический метод анализа, необходимо найти зависимость электрохимического электрода, а точнее, его потенциала от концентрации ионов или же от их активности. Есть еще одно положение, и оно говорит о том, что потенциометрия — это раздел, который включает в себя электрохимические способы анализа, основывающиеся на возбуждении вещества электрическим полем и необходимость проводить измерения равновесного электрода.
Видео:Лекция 8. Введение в электрохимические методы анализа.Скачать

Основы потенциометрии
Основоположником такого раздела анализа как потенциометрия является В. Нернст. В основе потенциометрического метода анализа лежит уравнение, которое в 1889 году вывел именно этот человек. Полученное Нернстом уравнение служило для равновесных электродных потенциалов, для их нахождения. Но вскоре после этого, потенциометрия стала получать более широкое распространение и начала использоваться в таком разделе как аналитическая химия.
В 1893 г. ученый Р. Беренд провел первое в истории человека потенциометрическое титрование. А в настоящее время такой раздел как потенциометрия довольно широко применяется в аналитической и физической химии. Кроме того, существует еще несколько областей применения потенциометрического метода анализа.
Видео:РЕФРАКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗАСкачать

Области использования потенциометрии
Аналитическая и физическая химия — это, как мы говорили, не единственные области, где потенциометрия нашла свое применение. Данный метод анализа также широко используется в редокосометрии. Названный раздел объединяет в себе несколько методов, которые основываются на измерении окислительно-восстановительных потенциалов в исследуемом растворе.
Потенциометрические методы анализа также используются и в ионометрии. Так именуют ответвление прямой потенциометрии, суть которого заключается в определении концентрации или активности ионов в их различных фазах. Для этого применяется ионселективный электрод. Кроме того, ионометрия объединяет в себе все методы анализа, относящиеся к определению концентрации. Также стоит добавить, что к данному разделу принадлежит еще и рН-метрия, катионо- и анионометрия.
Еще одно использование потенциометрического метода анализа — это потенциометрическое титрование. Суть титрования заключается в необходимости наблюдения за ходом реакции титрования и последующего нахождения точек эквивалентности.
Видео:Электрохимические методы анализа. Часть 1.Скачать

Сущность метода потенциометрического метода анализа
Сущность потенциометрии, а также методов анализа этой области заключается в проведении измерения разности электродвижущей силы двух электродов. Один из них является измерительным, а другой — вспомогательным. К тому же оба эти электрода должны быть помещены в исследуемый раствор.
Очень важно отметить, что величина электродвижущей силы сильно зависит от температуры. По этой причине все приборы, которые используются для проведения анализа, в частности рН-метры и ионометры дополнительно комплектуются температурными компенсаторами, которые могут управляться как в ручном режиме, так и в автоматическом.
Если говорить коротко, то потенциометрический метод анализа основан на измерении ЭДС гальванических элементов. Под этими элементами как раз и понимают соединение двух электродов, один из которых, как говорилось ранее, индикатор, а другой необходим для сравнения.
Видео:Определение порядка реакции методом подбора кинетического уравненияСкачать

Прямая потенциометрия
Классификация методов потенциометрического анализа довольно проста и имеет всего 2 пункта. И первая подгруппа — это прямая потенциометрия. Суть данного метода заключается в том, что необходимо измерять точную величину электродного потенциала, а после этого находить по уравнению Нернста активность потенциалоопределяющего иона в растворе. Данный метод используют для того, чтобы находить рН водных и неводных растворов. К тому же, этим способом можно находить и рН для производственных растворов олигомеров.
Кроме этого, потенциометрические методы анализа прямой потенциометрии используют для того, чтобы проводить анализ кислых и основных примесей в диметилформамиде. Также данный метод можно использовать для определения хлорид-ионов и кислотных компонентов в различных производственных растворах.
На вопрос о том, на чем основан потенциометрический метод анализа этой группы, можно ответить так — на измерении точных величин. А отсюда становится ясным, почему данный способ анализа нашел свое широкое применение и в таких областях как термодинамика, электрохимические, а также химические реакции.
Видео:Объёмный анализ ( титрование)Скачать

Титрование
Сущность метода потенциометрического метода анализа в данной области потенциометрического титрования основывается на необходимости определения точки эквивалентности в реакции нейтрализации, а также в реакции осаждения и комплексообразования, которые будут известны по итогам проведения потенциометрических измерений. После того как в результате проведения анализа станет точно известна эта самая точка эквивалентности, которая является и точкой окончания реакции, окажется возможным нахождение неизвестного количества вещества в растворе, за которым ведется контроль. Определить это можно по расходу титранта, концентрация которого известна в точных числах.
Видео:Стехиометрические расчеты. Практическая часть - решение задачи. 9 класс.Скачать

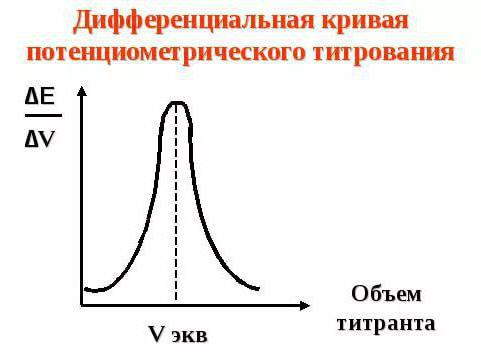
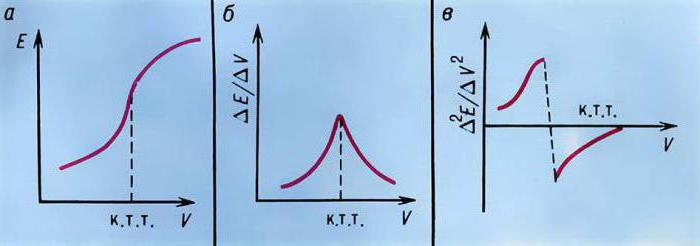
Принципы титрования
Принцип работы потенциометрического метода анализа — титрования — заключается в следующем. Вблизи от точки эквивалентности обычно происходит сильное изменение или даже скачок потенциала от индикаторного электрода. Сила данного скачка будет зависеть от силы титруемого раствора кислоты или же основания, а также от концентрации самого раствора. Если же проводить титрование смесей различных кислот, то можно наблюдать несколько скачков за одну реакцию.
Использование данного метода осуществляется в чисто прикладных целях, когда необходимо обнаружить конечную точку титрования, с помощью которой есть возможность определить принадлежность анализируемого вещества в растворе к какой-либо группе. Однако, несмотря на это, данный способ получил довольно широкое распространение, а также имеет свои преимущества, которые выгодно выделяют его среди других методов анализа.
Видео:Условная диаграмма напряжений. Пластичные и хрупкие материалыСкачать

Преимущества потенциометрии
Среди преимуществ потенциометрии, в целом, можно выделить следующие пункты:
- Высокая точность проводимых анализов.
- Высокая чувствительность измерений.
- Если говорить о титровании, то метод можно использовать в мутных или разноцветных растворах.
- Использование прямого потенциометрического метода анализа — быстрота и простота, проводимых измерений.
- Одно из больших преимуществ — это возможность автоматизации процесса титрования. Некоторые промышленные объекты занимаются производством автоматических автотитраторов, которые комплектуются потенциометрами. В итоге получается небольшой автономный комплекс для проведения анализа.
Также выгодно отличает этот метод от других то, что есть возможность определения нескольких веществ в одном и том же растворе без их предварительного разделения.
Видео:Смачивание. Капиллярные явления. 10 класс.Скачать

Особенности и недостатки потенциометрии
Если говорить о потенциометрии, а также о ее методах анализа, то можно выделить несколько особенностей. К примеру, потенциометрическое титрование сильно расширяет возможность практического применения данной области проведения анализа среди неводных растворителей. Данные методы позволяют людям находить содержание различных компонентов, которые в отдельности невозможно титровать, а также появляется возможность проведения анализа вещества, которое не растворяется или, наоборот, разлагается в воде.
Также важной особенностью потенциометрических методов является то, что их относят к неразрущающей группе. Другими словами, проведение анализа одним из потенциометрических способов не влияет на состав анализируемого раствора и не разрушает его, вследствие чего смесь можно использовать в дальнейшем без каких-либо проблем. Погрешность измерений при использовании прямого потенциометрического метода составляет всего от 2 до 10%. А если использовать потенциометрическое титрование, то погрешность и вовсе составляет от 0,5 до 1%.
Недостатком метода можно считать то, что невозможно его применять для непрерывного контроля, а также в некоторых случаях им невозможно определить слишком малые концентрации в растворе.
Видео:Задача на расчет молярной концентрации (См) по схемам ОВР + титрование.Скачать

Преимущества потенциометрического метода анализа
Ученые выделяют основным преимуществом этого метода его быстроту, а также простоту, с которой проводится анализ. Именно эти два качества выгодно выделяют потенциометрию и методы ее анализа среди других.
Время, которое требуется, чтобы установилось равновесие потенциалов индикаторного электрода, довольно маленькое, что, в свою очередь, позволяет с удобством изучать кинетические реакции и реакции автоматического контроля различных технологических процессов.
Если использовать в качестве электродов микроэлектроды, то становится доступным проведение измерений в пробах, объем которых равен десятым долям см³. Кроме того, есть несколько различных растворов, в которых измерения могут быть проведены при помощи потенциометрии.
Существует потенциометрический метод анализа воды, различных мутных и окрашенных растворов, а также различных вязких паст. Огромным его преимуществом является то, что при использовании названного метода нет необходимости в перегонке или фильтрации раствора. А это в некоторых случаях экономит очень много времени.
Видео:Фотометрический метод анализа | Аналитическая химияСкачать

Преимущества потенциометрического титрования
Использование потенциометрического метода анализа титрования выделяется такими преимуществами:
- Данным метод позволяет полностью исключить субъективные ошибки, которые часто связаны с визуальным наблюдением за раствором.
- Данный метод считается более чувствительным. Другими словами при тех же манипуляциях титрование позволяет определять менее концентрированные вещества.
- Кроме того, метод позволяет без проблем проводить титрование в замутненных или цветных растворах. Это очень удобно, так как применять цветные индикаторы в таких растворах, допустим, невозможно вовсе.
- Также данный метод анализа позволяет человеку последовательно определить смесь веществ из одной и той же порции раствора.
Данные преимущества выгодно выделяют титрование на фоне других потенциометрических методов, а потому используется он довольно широко.
🔍 Видео
Алгоритм решения расчетных задач в аналитической химии.Скачать

25. Схема реакции и химическое уравнениеСкачать

Расчет сопротивления проводника. Удельное сопротивление. Реостаты | Физика 8 класс #16 | ИнфоурокСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать