Магний Mg — это щелочной металл. Серебристо-белый, относительно мягкий, пластичный, ковкий металл. На воздухе покрыт оксидной пленкой. Сильный восстановитель.
Относительная молекулярная масса Mr = 24,305; относительная плотность для твердого и жидкого состояния d = 1,737; tпл = 648º C; tкип = 1095º C.
Видео:химическая реакция хлорида магния и нитрата свинца (ll)Скачать

Способ получения
1. В результате электролиза расплава хлорида магния образуются магний и хлор :
2. Нитрид магния разлагается при 700 — 1500º С образуя магний и азот:
3. Оксид магния легко восстанавливается углеродом при температуре выше 2000º С, образуя магний и угарный газ:
MgO + C = Mg + CO
4. Оксид магния также легко восстанавливается кальцием при 1300º С с образованием магния и оксида кальция:
MgO + Ca = CaO + Mg
Видео:В 1830 г. М. Фарадей получил магний электролизом расплавленного хлорида магния.Скачать

Качественная реакция
Качественной реакцией для магния является взаимодействие соли магния с любой сильной щелочью, в результате которой происходит выпадение студенистого осадка:
1. Хлорид магния взаимодействует с гидроксидом калия и образует гидроксид магния и хлорид калия:
MgCl2 + 2KOH = Mg(OH)2 + 2KCI
Видео:Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

Химические свойства
1. Магний — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Магний взаимодействует с азотом при 780 — 800º С образуя нитрид магния:
1.2. Магний сгорает в кислороде (воздухе) при 600 — 650º С с образованием оксида магния:
2Mg + O2 = 2MgO
1.3. Магний активно реагирует при комнатной температуре с влажным хлором . При этом образуется хлорид магния :
1.4. С водородом магний реагирует при температуре 175º C, избыточном давлении и в присутствии катализатора MgI2 с образованием гидрида магния:
2. Магний активно взаимодействует со сложными веществами:
2.1. Магний реагирует с горячей водой . Взаимодействие магния с водой приводит к образованию гидроксида магния и газа водорода:
2.2. Магний взаимодействует с кислотами:
2.2.1. Магний реагирует с разбавленной соляной кислотой, при этом образуются хлорид магния и водород :
Mg + 2HCl = MgCl2 + H2 ↑
2.2.2. Реагируя с разбавленной азотной кислотой магний образует нитрат магния, оксид азота (I) и воду:
2.2.3. В результате реакции сероводородной кислоты и магния при 500º С образуется сульфид магния и водород:
Mg + H2S = MgS + H2
2.3. Магний вступает в реакцию с газом аммиаком при 600 — 850º С. В результате данной реакции образуется нитрид магния и водород:
2.4. Магний может вступать в реакцию с оксидами :
2.4.1. В результате взаимодействия магния и оксида азота (IV) при температуре 150º С в вакууме, в этилацетилене образуется нитрат магния и оксид азота (II):
2.4.2. Магний взаимодействует с оксидом кремния при температуре ниже 800º С в атмосфере водорода образуя силицид магния и оксид магния:
4Mg + SiO2 = Mg2Si + MgO,
а если температуру поднять до 1000º С, то в результате реакции образуется кремний и оксид магния:
2Mg + SiO2 = Si + 2MgO
Видео:Электролиз. 10 класс.Скачать

Электролиз магния
Электролитический магний получают электролизом расплавленной смеси хлоридов магния, калия, натрия и кальция.
Электрохимическая сущность процесса электролитического получения магния заключается в следующем. В хлоридном расплаве в результате электролитической диссоциации образуются катионы металлов Mg 2+ , Na+, K + и анионы хлора Сl – .
Под воздействием постоянного тока на катоде разряжаются только катионы Mg 2+ по электрохимической реакции
Mg 2 + + 2e — →Mg. (160)
Анодный процесс сводится к разряду ионов хлора:
2 Сl – — 2е — →С12. (161)
В процессе электролиза, проводимом при 690—720°С, магний получают в жидком виде. В этих условиях возникает опасность воспламенения магния в атмосфере воздуха и обратного хлорирования магния выделяющимся на аноде хлором. Чтобы избежать этого, необходимо герметизировать электролизную ванну и частично разделить прикатодное и прианодное пространства диафрагмой. Для предотвращения попадания газообразного хлора в атмосферу цеха производится принудительный отсос анодного газа.
Для получения электролитического магния применяют электролизеры диафрагменного типа. По конструкции электролизеры бывают с боковым, верхним и нижним вводом анодов.
Любой магниевый электролизер состоит из нескольких электрохимических ячеек. Под электрохимической ячейкой подразумевается часть объема ванны, заполненного электролитом и ограниченного с двух сторон катодными электродами.
Схематически устройство ячеек магниевых электролизеров показано на рис.166. Каждая ячейка состоит из одного угольного или графитированного анода и двух стальных катодов. Отвод тока от катода осуществляется с помощью изогнутых катодных штанг. Для сбора и отвода анодных газов, состоящих главным образом из хлора, служат диафрагмы (колпаки) из шамотобетона. Все узлы электролизера помещены в железном кожухе, футерованном изнутри шамотом.
Диафрагма погружена в электролит на глубину 15— 25 см. Она служит для предотвращения соединения катодного и анодного продуктов, что может привести к обратному хлорированию магния.
Количество ячеек в промышленных электролизерах может быть различным и определяется их мощностью. Многолетней практикой и рядом исследований доказаны преимущества более мощных электролизеров. В настоящее время созданы электролизеры на силу тока 80—120 тыс. А.
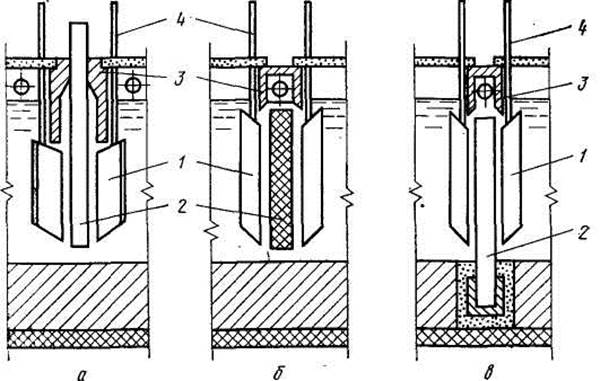 |
| Рис. 166. Принципиальные схемы устройства ячеек магниевых электролизеров с верхним (а), боковым (б) и нижним (в) вводом анодов: 1 — катод; 2 — анод; 3 — диафрагма; 4 — катодная штанга |
Электролизеры с верхним вводом анодов не требуют отключения при замене анодов, что облегчает их обслуживание. Однако срок службы анодов, введенных сверху, примерно в два раза меньше, чем у анодов, введенных сбоку или снизу. Кроме того, при одной и той же плотности тока электролизеры с верхним вводом анодов работают при большем напряжении.
Состав электролита при электролизе магния выбирают в зависимости от вида сырья. Если исходным сырьем является обезвоженный карналлит, содержащий хлориды магния, калия и натрия, то электролит, как правило, состоит в основном из тех же хлоридов. При этом в процессе электролиза получается большое количество отработанного электролита.
При электролизе технического MgCl2(90—95 % MgCl2) или более чистого, полученного при восстановлении тетрахлорида титана, в электролит, кроме указанных компонентов, добавляют СаС12 и ВаСl2. Эти добавки утяжеляют электролит и способствуют улучшению отделения магния.
Концентрация MgCl2 в электролите между загрузками сырья должна изменяться от 12—14 до 5—6 %.
При уменьшении концентрации хлорида магния возможен электролиз других хлоридов, присутствующих в электролите. При высоком содержании MgCl2 ухудшаются свойства электролита.
Электролиз магния ведут при температуре 680—720°С и анодной плотности тока 0,4—0,8 А/см 2 . Образующийся при этом магний всплывает на поверхность электролита и извлекается из ванны один раз в сутки вакуум-ковшом.
Основные технико-экономические показатели работы современных магниевых электролизёров:
Напряжение на электролизере, В 4,0—6,3.
Выход по току, % 77—86
Расход электроэнергии, кВт-ч/т магния 13,5—16,7
Съем магния с 1 м 2 площади пода,кг/сут 60—120
Видео:Галилео. Эксперимент. Магний в кислородеСкачать

Please wait.
Видео:Горение магния - химическая реакция.Скачать

We are checking your browser. gomolog.ru
Видео:💥💥 Вся правда! Целебные свойства магния хлорида 💥💥Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7034d26fd952977f • Your IP : 87.119.247.227 • Performance & security by Cloudflare
🔍 Видео
#30 Магний из Китая / Опыты с МАГНИЕМ!Скачать

Признаки дефицита магния. 99 людей не знают, что причина в нехватке магнияСкачать

МАГНИЕВЫЕ опыты!Скачать

Реакция магния и серы. Получение сульфида магния. Magnesium and sulfur burning! Making MgS.Скачать

Получение оксида магния. Опыт 1Скачать

Шаихова Б.К. Определение эквивалентной массы магния методом вытеснениеСкачать

ЕГЭ по химии: электролиз, гидролизСкачать

§15, 9 кл. Берилий, магний и щелочно-земельные металлыСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

90. Электролиз (часть 1)Скачать

Гидролиз солей. 9 класс.Скачать

Магний- металл. В колёсах, банках, пиротехнике.Скачать
