Наибольшее практическое распространение получили оптические, так называемые фотометрические методы анализа, основанные па способности атомов и молекул поглощать электромагнитное излучение.
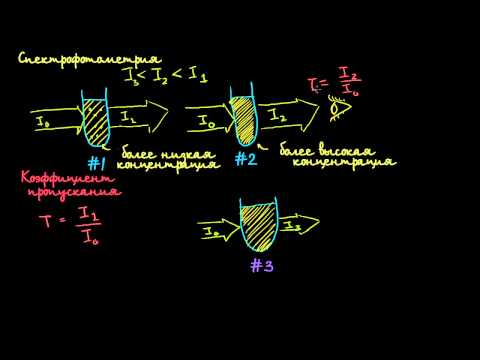
Концентрацию вещества в растворе определяют по степени поглощения светового потока, прошедшего через раствор.
При колориметрическом методе анализа измеряют поглощение световых лучей широких участков видимого спектра или всего видимого спектра (белый свет) окрашенными растворами.
При спектрофотометрическом методе измеряют поглощение монохроматического света. Это усложняет конструкцию приборов, но дает большие аналитические возможности по сравнению с колориметрическим методом.
Интенсивность окраски раствора может быть определена визуально (колориметрия) или с помощью фотоэлементов (фотоколориметрия).
Большинство визуальных методов сравнения интенсивности поглощения основано на различных способах выравнивания интенсивности окраски двух сравниваемых растворов. Это может быть достигнуто изменением концентрации (методы разбавления, стандартного ряда, колориметрического титрования) или изменением толщины поглощающего слоя (метод уравнивания).
Пользуясь методом стандартного ряда, берут ряд колориметрических пробирок с притертыми пробками, готовят постоянный стандартный ряд окрашенных растворов, содержащих последовательно возрастающие количества стандартного раствора. Получается так называемый стандартный ряд или колориметрическая шкала (образцовая шкала). Можно использовать набор специально подобранных цветных стекол.
Этот метод лежит в основе определения цвета нефтепродуктов по шкале стандартных цветных стекол. Приборы — колориметры типа КНС-1, КНС-2, ЦНТ (см. гл. 1).
Выравнивать интенсивности потоков излучений при их сравнении можно также изменением ширины щели диафрагмы, находящейся па пути одного из двух сравниваемых потоков. Этот способ используется в более точных и объективных методах измерения интенсивности окраски раствора в фотоколориметрии и спектрофотометрии.
Для этого используются фотоэлектроколориметры и спектрофотометры.
В основе количественного определения концентрации окрашенного соединения по степени поглощения лежит закон Бугера — Ламберта — Бера:
Шкалы фотометрических приборов градуируют в значениях поглощения А и пропускания Т среды.
Теоретически А изменяется от 0 до °°, а Т — от 0 до 1. Но с достаточной точностью величину А можно измерить в очень узком интервале значений — примерно 0,1-г-1,0.
Измеряя поглощение данной системы монохроматических излучений различных длин волн, можно получить спектр поглощения, т, е. зависимость светопоглощения от длины волны. Логарифм отношения I0 /I также называют оптической плотностью и иногда обозначают D.
Коэффициент поглощения К определяет строение поглощающего соединения. Абсолютное значение К зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя. Если концентрация выражена в моль/дм 3 , а толщина слоя в см, то коэффициент поглощения называется молярным коэффициентом погашения е: при с=1М и 1=1 см ъ = А, т. е. молярный коэффициент погашения численно равен оптической плотности раствора концентрацией 1М, помещенного в кювету с толщиной слоя 1 см. Для фотометрического анализа наибольшее значение имеет.поглощение света в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра.
Бесцветный солнечный луч, так называемый белый свет, проходя через призму, разлагается на несколько цветных лучей. Лучи разных цветов отличаются длиной волны. Длину волны монохроматического луча, т. е. луча определенного цвета, измеряют в нанометрах (нм) или в микрометрах (мкм). В видимую часть спектра входят лучи с длиной волны X от 400 до 760 нм. Лучи с длиной волн от 100 до 400 нм образуют невидимую ультрафиолетовую часть спектра, лучи с длиной волн свыше 760 нм — инфракрасную часть спектра.
Для количественного анализа более удобно проводить измерения в УФ и видимой частях спектра, в которых даже сложные соединения имеют обычно одну или небольшое число полос поглощения (т. е. диапазонов частот световых волн, в которых наблюдается поглощение света).
Для каждого поглощающего вещества можно выбрать такую длину волны, при которой происходит самое интенсивное поглощение лучей света (наибольшее поглощение). Эту длину волны обозначают max
Для многих аналитических определений достаточно выделить полосу спектра шириной от 20 до 100.нм. Этого достигают при помощи светофильтров, обладающих избирательным поглощением лучистой энергии и пропускающих свет в достаточно узком интервале волн. Чаще всего применяют стеклянные светофильтры, причем цвет светофильтра соответствует тому участку спектра, который этот Светофильтр пропускает. Как правило, приборы для колориметрического анализа снабжены набором светофильтров, повышающих точность и чувствительность количественных методов анализа.
Если область максимального поглощения max анализируемого раствора известна, то выбирают светофильтр с областью максимального пропускания, близкой к max
Если max анализируемого раствора точно неизвестна, светофильтр выбирают следующим образом: измеряют оптическую плотность раствора, вводя последовательно все светофильтры; измерение ведут относительно дистиллированной воды. Светофильтр, при использовании которого получается наибольшая оптическая плотность, считается наиболее пригодным для дальнейшей работы.
Таким образом поступают при работе на фотоэлектроколориметрах.
Фотоэлектроколориметры типа ФЭК-М имеют ширину спектрального интервала, пропускаемого светофильтром 80100 нм, типа ФЭК-Н-57, ФЭК-56, ФЭК-60 3040 нм. При работе на спектрофотометрах измеряют поглощение во всем рабочем интервале данного прибора вначале через 1020 им, а найдя границы максимального поглощения, через 1 нм.
Как правило, описание стандартного метода определения, которым руководствуется лаборант в своей работе, содержит точные указания относительно условий, в которых проводится определение вещества.
Любое определение с использованием фотометрического метода анализа состоит из двух стадий: переведения анализируемого вещества в окрашенное состояние и измерения оптической плотности раствора. Наибольшее значение на первой стадии имеют реакции комплексообразования. В случае прочных комплексов для полного связывания определяемого компонента достаточно небольшого избытка комплекоообразователя. Однако нередко применяют интенсивно окрашенные, но малопрочные комплексы. В общем случае в растворе необходимо создать такой избыток реактива, чтобы его концентрация была не менее 10.К <К — константа нестойкости комплекса).
В фотометрическом анализе используются реактивы, изменяющие цвет при изменении рН раствора. Поэтому необходимо поддерживать рН в интервале, по возможности далеком от области цветового перехода.
В основе количественного фотометрического анализа лежит метод градуировочных кривых, показывающих зависимость оптической плотности раствора D от количества вещества с.
Для построения кривой замеряют оптическую плотность пяти-восьми растворов анализируемого вещества различных концентраций. График зависимости оптической плотности от концентрации используется для определения содержания вещества в анализируемом образце.
В большинстве случаев (для разбавленных растворов) градуировочный график выражается прямой, проходящей через начало координат. Нередко наблюдаются отклонения от прямой в положительную или отрицательную сторону; причиной этого может быть сложный характер спектра окрашенного соединения, что приводит к изменению коэффициента поглощения в выбранном интервале длин волн с изменением концентрации раствора. Этот эффект устраняется при использовании монохроматического света, т.е. при работе на спектрофотометрах.
Следует иметь в виду, что соблюдение закона Бугера — Ламберта—Бера, т.е. прямолинейный характер градуировочной кривой не является обязательным условием успешного выполнения количественного определения. Если в определенных условиях установлена нелинейная зависимость D от с, то она все равно может служить градуировочным графиком. Концентрация определяемого компонента может быть определена по этой кривой, но для ее построения необходимо большее число стандартных растворов. Однако линейная зависимость градуировочного графика повышает точность определения.
Коэффициент поглощения слабо зависит от температуры. Поэтому термостатирование в фотометрических измерениях не обязательно. Изменение температуры в пределах ±5°С практически не влияет на оптическую плотность.
Природа растворителя оказывает существенное влияние на оптическую плотность при прочих равных условиях, поэтому построение градуировочных графиков и измерения в анализируемых продуктах необходимо проводить в одном и том же растворителе.
Для работы в УФ-области применяют воду, спирт, эфир, насыщенные углеводороды.
Поскольку оптическая плотность зависит от толщины слоя, выбор кювет должен быть сделан с таким расчетом, чтобы значения оптических плотностей для серии эталонных (стандартных) растворов находились в интервале 0,1 — 1,0, что соответствует наименьшей ошибке измерении.
На практике поступают следующим образом: наполняют кювету средней толщины (2 или 3 см) раствором концентрацией, соответствующей середине ряда стандартных растворов, и используют его для выбора оптимальной длины волны (или оптимального светофильтра). Если оптическая плотность, полученная при этом для области максимального поглощения исследуемой системы, соответствует примерно середине оптимального интервала (0,40,5), то это значит, что кювета выбрана удачно; если выходит за границы этого интерзала или близка к ним, то нужно сменить кювету, увеличив или уменьшив ее толщину. При соблюдении закона Бугера — Ламберта — Бера, в том случае, когда при измерении последних в ряду стандартных растворов получаются значения оптической плотности >1,0, можно измерять оптические плотности в кювете с меньшей толщиной слоя и, пересчитав на толщину слоя, при которой были измерены плотности первых растворов, нанести их на один график зависимости D = f(c).
Аналогично поступают, если кювета не подходит для измерения оптических плотностей растворов начала ряда стандартных растворов.
Интервал концентраций определяемого вещества необходимо также подбирать таким образом, чтобы измеряемая оптическая плотность раствора укладывалась в диапазон 0,1 —1,0.
Для анализа нефтепродуктов, присадок к ним могут быть рекомендованы фотоэлектроколориметры ФЭК-М, ФЭК-56, ФЭК-Н-57, ФЭК-60, КФО, КФК-2, а также спектрофотометры СФ-4А, СФ-26, СФ-46 (см. гл. 1).
Среди оптических методов анализа рассмотрим также рефрактометрический метод, основанный на способности различных веществ по-разному преломлять проходящий свет. Этот метод — один из самых простых инструментальных, требует небольших количеств анализируемого вещества, измерение проводится за очень короткое время. Этим методом можно идентифицировать жидкие вещества по их показателю преломления света, определять содержание вещества в растворе (для тех веществ, показатель преломления которых заметно отличается от показателя преломления растворителя). Показатель преломления является обязательно определяемым в лабораториях свойством нефтяных фракции и нефтепродуктов при их адсорбционном разделении.
В нефтепереработке принято определять показатель преломления nD при длине волны падающего света 589 нм. Измерение ведут с помощью рефрактометра.
Показатель преломления зависит от температуры. С повышением се показатели преломления жидкостей уменьшаются.
Таблица 1. Показатели преломления некоторых соединений при различной температуре
- Фотометрические методы анализа (стр. 2 )
- 1.5.2. Количественный анализ методами фотометрии
- 1.5.3. Основные этапы анализа в фотометрии
- 1.5.4. Метрологические характеристики метода
- 1.5.5. Анализ однокомпонентных систем фотометрическим методом
- Тема: Фотометрический метод анализа. Теоретические основы метода.
- 🎥 Видео
Видео:Хорошо интерпретируемые методы анализа данных ― Алексей НезнановСкачать

Фотометрические методы анализа (стр. 2 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Характерными полосами поглощения обладают соединения, содержащие хромофорные группы (см. раздел 1.3.2). Спектральные исследования в этой области часто дают полезную качественную информацию о наличии или отсутствии некоторых функциональных групп, таких как карбонил, ароматическое кольцо, нитрогруппа или сопряженная двойная связь. Следует иметь в виду, что идентификация надежна, если хромофоры в молекуле изолированы. В присутствии ауксохромов и цепей сопряжения идентификация затрудняется.
1.5.2. Количественный анализ методами фотометрии
В фотометрическом анализе количество вещества определяется по интенсивности окраски или светопоглощению окрашенных соединений. Раствор или предмет кажутся окрашенными, если он по-разному пропускает или поглощает видимый свет различных длин волн. В видимой области цвет раствора обусловлен длиной волны излучения, не поглощенного этим раствором. Например, раствор, поглощающий излучение в синей части спектра (»475 нм), окрашен в желтый цвет, т. е. синий цвет является дополнительным к окраске раствора. В таблице 1.3 приводятся такие данные для всей области видимого излучения.
Абсорбционная спектроскопия, особенно в видимой и УФ-областях – один из наиболее распространенных методов количественного анализа. Фотометрические методы используют для определения веществ с собственным поглощением (органические вещества с хромофорными группами,
переходные металлы), а также для определения непоглощающих веществ.
При определении неорганических компонентов для получения окрашенных соединений чаще всего используют реакции образования (иногда – разрушения) комплексных соединений; значительно реже применяются реакции окисления-восстановления. Для фотометрического определения
Таблица 1.3. Цвета видимого излучения
Область максимального поглощения, нм
органических компонентов чаще всего используют реакции синтеза окрашенных соединений. Такие реакции называют фотометрическими.
Основные требования к реакциям сводятся к следующему: избирательное действие реагента, высокая скорость реакции, большое значение константы равновесия, постоянство состава и устойчивость окрашенных соединений во время проведения анализа. Важное значение в связи с этим имеют рН среды, время реакции, концентрации реагентов, температура.
1.5.3. Основные этапы анализа в фотометрии
Прежде чем приступить к выполнению фотометрического определения необходимо выбрать условия анализа. Можно рекомендовать следующую схему.
– перевод анализируемого образца в раствор и отделение, в случае необходимости, мешающих компонентов;
– выбор фотометрической формы вещества и проведение химических реакций для получения окрашенного соединения (если определяемое вещество не обладает интенсивным собственным поглощением)
– установление области концентраций, в которой выполняется основной закон светопоглощения:
– измерение оптической плотности исследуемого раствора;
– расчет содержания вещества в анализируемой пробе и его метрологическая оценка.
1.5.4. Метрологические характеристики метода
Чувствительность характеризуется углом наклона градуировочного графика. Тангенс угла наклона равен молярному коэффициенту поглощения. Если принять минимальное значение оптической плотности, измеренное с необходимой точностью, Аmin = 0,01, можно рассчитать минимально определяемую концентрацию:
При величинах e » 105 чувствительность определения может составлять 10–7–10–6 М.
Воспроизводимость. Для получения воспроизводимых результатов необходимо учитывать погрешности при измерении оптической плотности. Измерительное устройство фотометрического прибора обычно имеет постоянную по всей шкале погрешность измерения в величине пропускания Т, погрешность измерения величины А не будет одинакова, так как А = – lgТ. Относительная погрешность определения концентрации DС/C имеет минимальное значение при Т = 0,37 или оптической плотности А = 0,435. Для измерения концентрации с погрешностью, не превышающей удвоенной минимальной, нужно проводить измерение А в интервале 0,1–1,0. Для снижения случайной погрешности измерения в области больших и малых значений А существуют специальные приемы, один из них – дифференциальный метод анализа.
Правильность. Систематические погрешности в фотометрии могут возникнуть в связи с отклонениями от закона Бера, в связи с немонохроматичностью светового потока и химическими взаимодействиями в измеряемой системе, а также при наличии примесей, которые поглощают свет в данной области спектра. Для снижения систематической ошибки существуют специальные приемы, как, например, приготовление раствора сравнения, содержащего все компоненты, кроме определяемого.
Точность фотометрических методов зависит от индивидуальных особенностей фотометрической реакции, характеристик применяемого прибора и других факторов. Обычная относительная погрешность фотометрических методов составляет 1–2%.
1.5.5. Анализ однокомпонентных систем фотометрическим методом
Метод сравнения оптических плотностей стандартного и исследуемого соединений. Для анализа вещества этим способом готовят раствор исследуемого вещества и два-три стандартных раствора, затем измеряют оптические плотности этих растворов в одинаковых условиях (длина волны, толщина поглощающего слоя). Погрешность определения будет меньше, если оптические плотности исследуемого и стандартного растворов будут иметь близкие значения. Для этого вначале фотометрируют исследуемый раствор, а затем подбирают нужную концентрацию стандартного раствора. Согласно закону Бера, оптические плотности исследуемого и стандартного растворов равны:
Разделив уравнение (1.9) на (1.10) и учитывая, что оптические плотности измеряют в одних и тех же условиях (l = const, l = const) и в растворе одни и те же светопоглощающие частицы (el = const), получим:
Метод сравнения используется для единичных анализов и требует обязательного соблюдения закона Бера.
Метод молярного коэффициента поглощения. При работе по этому методу определяют оптическую плотность нескольких стандартных растворов Аст, для каждого стандартного раствора рассчитывают молярный коэффициент поглощения:
и полученное значение e усредняют. Поскольку молярный коэффициент светопоглощения не зависит от толщины поглощающего слоя, измерения можно проводить в кюветах разной длины. Затем измеряют оптическую плотность исследуемого раствора Ах и рассчитывают концентрацию Сх:
Метод требует обязательного соблюдения закона Бера хотя бы в области исследуемых концентраций; используется довольно редко.
Метод градуировочного графика. В соответствии с законом Бугера – Ламберта – Бера график зависимости оптической плотности от концентрации должен быть линейным и проходить через начало координат.
Готовят серию стандартных растворов различной концентрации и измеряют оптическую плотность в одинаковых условиях. Для повышения точности определения число точек на графике должно быть не меньше трех-четырех. Затем определяют оптическую плотность исследуемого раствора Ах и по графику находят соответствующее ей значение концентрации Сх (рис.1.7).
Интервал концентраций стандартных растворов подбирают таким образом, чтобы концентрация исследуемого раствора соответствовала примерно середине этого интервала.
Метод является наиболее распространенным в фотометрии. Основные ограничения метода связаны с трудоемким процессом приготовления эталонных растворов и необходимостью учитывать влияние посторонних компонентов в исследуемом растворе. Чаще всего метод применяется для проведения серийных анализов.
 |
Рис.1.7. Градуировочный график зависимости оптической
плотности от концентрации
Метод добавок. Этот метод применяют для анализа сложных растворов, так как он позволяет автоматически учитывать влияние посторонних компонентов анализируемого образца. Сначала измеряют оптическую плотность исследуемого раствора с неизвестной концентрацией
затем в анализируемый раствор добавляют известное количество стандартного раствора определяемого компонента (Сст) и измеряют оптическую плотность А х+ст:
Для повышения точности добавку стандартного раствора определяемого компонента делают дважды и полученный результат усредняют.
 |
Концентрацию анализируемого вещества в методе добавок можно найти графичеcким путем (рис.1.8).
Рис.1.8. Градуировочный график для определения
концентрации вещества по методу добавок
Уравнение (1.16) показывает, что если строить график Ах+ст как функции Сст, то получится прямая, экстраполяция которой до пересечения с осью абсцисс дает отрезок, равный –Сх. Действительно, при Ах+ст = 0 из уравнения (1.16) следует, что –Сст = Сх.
Метод дифференциальной фотометрии. В этом методе оптические плотности исследуемого и стандартных растворов измеряют не по отношению к растворителю или раствору сравнения с нулевым поглощением, а, в отличие от прямых спектрофотометрических методов, по отношению к раствору с известной концентрацией определяемого вещества Со.
В зависимости от способов измерения относительной оптической плотности различают несколько вариантов метода.
1.Метод высокого поглощения – концентрация раствора сравнения меньше концентрации исследуемого раствора (Со Сх). В этом случае применяют обратный порядок измерения: анализируемый и стандартные растворы условно принимают за растворы сравнения и по отношению к ним измеряют оптическую плотность изначального раствора сравнения. При обратном порядке измерения относительная оптическая плотность А¢ равна разности оптических плотностей исследуемого раствора (стандартного) и раствора сравнения:
Концентрацию Сх рассчитывают по формуле:
Видео:Занятие 10. ФотометрияСкачать

Тема: Фотометрический метод анализа. Теоретические основы метода.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Тема: Фотометрический метод анализа.
Теоретические основы метода.
Все вещества, поглощающие электромагнитное излучение, вещества поглощающие излучение видимого спектра характеризуются собственной окраской.
Фотометрический метод основан на измерении интенсивности светового потока, прошедшего через вещество или его раствор. В зависимости от длинны волны, ширина полосы излучения и способы измерения интенсивности светового потока, различают следующие фотометрические методы:
1) Колориметрия – основан на визуальном сравнении интенсивности окраски анализируемого раствора и интенсивности окраски раствора того же вещества известной концентрации ( стандартный раствор). Субъективность визуальных восприятий световых оттенков или интенсивность окраски является недостатком.
2) Фотоэлектроколоримететрия – основан на измерении интенсивности света в видимой части спектра. Для монохромотизации света применяют светофильтры.
3) Спектрофотомерия – основан на применении монохроматического света как в видимой так и в ультрафиолетовыми инфра красной областях света. Для монохроматизации света применяют дифракционные решётки и призмы.
Оптическая плотность зависит от толщины светопоглощающего слоя, от концентрации растворённого светопоглощающего вещества.
Аналитические задачи решаемые фотометрическими методами :
1) Определения, основанные на собственном светопоглощении веществ ( определение кофеина в чае).
2) Определение связанные с образованием интенсивно окрашенных продуктов при добавлении бесцветного реактива к бесцветному раствору определяемого вещества ( определение белков, нитритов).
3) Определения основанные на измерении интенсивности окраски избытка окрашенного реактива ( определение сахаров по избытку дихромата калия).
Спектрофотометрия основана на тех же законах светопоглащения, что и фотоэлектроколорометрия.
Фотонефелометрический анализ и турбодиметрия .
Основаны на исследовании свойств мутных растворов. В них применяются одни и те же реакции различие состоит в том, что в 1 измеряют интенсивность света рассеянного твёрдыми частицами суспензий, а во 2 интенсивность света прошедшего через суспензию. При пропускании света через суспензию часть его лучей поглощается другая часть рассеивается . Интенсивность рассеянного света пропорциональна концентрации анализируемого раствора.
Основная погрешность – трудновоспроизводимый объём взвешенных частиц и изменения этой величины во времени. Для получения воспроизводимых результатов надо строго выполнять условия эксперимента как при приготовлении стандартных растворов так и непосредственно при количественных определениях, для стабилизации суспензий в анализируемый раствор вводят защитные колоиды крахмал, желатин.
🎥 Видео
Фотометрический метод анализа | Аналитическая химияСкачать

Оптические методы анализа. Фотоэлектроколориметрия. Спектрофотометрия.Скачать

АНАЛИТИЧЕСКАЯ ХИМИЯ. ПРЕДМЕТ И ЗАДАЧИ. КЛАССИФИКАЦИЯ АНАЛИТИЧЕСКИХ МЕТОДОВ.Скачать

ФотоколориметрияСкачать

Введение в спектрофотометриюСкачать
Оптические методы анализа. Часть 1.Скачать

Урок 408. Основные понятия фотометрии - 1Скачать

Урок 409. Основные понятия фотометрии - 2Скачать

Методы абсорбционного оптического анализа. Часть 1.Скачать

Фотоколориметрический метод определения концентрации ионов железаСкачать

Фотометрия ч. 1 теорияСкачать

Урок 410. Решение задач по фотометрии - 1Скачать

Методы рентгеноструктурного анализаСкачать
Воронов И.А. Методы анализа многомерных данных (для гуманитариев)Скачать

СпектрофотометрияСкачать

Лекция 9. Введение в спектроскопические методы анализаСкачать

Химия, 12-й класс, Основные понятия количественного анализаСкачать

Атомная спектрометрия. Часть 1. Атомно-абсорбционная спектрометрияСкачать













