Задача 65
В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакйий:
a) 2SО2 = О2 + 2SО2; ∆Н 0 298 = -196,6кДж;
b) N2 + О2 = 2NО; ∆Н 0 298 = +180,7кДж;
c) 3О2 = 2О3; ∆Н 0 298 = +184,6кДж;
d) 2СО + О2 = 2СО2; ∆Н 0 298 = -566,0кДж.
Решение:
В соответствии с принципом Ле Шателье, если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию веществ), то равновесие сместится в сторону протекания той реакции, которая ослабляет это воздействие.
V1прям. – скорость прямой реакции до увеличения давления
V1обр. — скорость обратной реакции до увеличения давления
обозначим [SО2] = а , [О2] = в, [SО3] = с,
тогда V1прям = k . а 2 b; V1обр = k . с 2 .
Допустим, увеличим давление в первой системе в два раза. Тогда
V2прям =k . (2а ) 2 . 2b = k . 8а 2 b
Скорость прямой реакции увеличилась в 8 раз:
V2прям/ V1прям = (k . 4а 2 b)/ (k . а 2 b) = 4.
Изменение скорости обратной реакции:
V2обр = k . (2с) 2 = 4с 2 ;
V2обр /V1обр = 4с 2 /с 2 = 4
Таким образом, смещение при увеличении давления происходит в сторону образования продуктов реакции. Реакция экзотермическая, при увеличении температуры сместится влево.
Константа равновесия для данной реакции:
К = [SО3] 2 /[SО2] 2 [О2]
b) N2 + О2 = 2NО; ∆Н 0 298 = +180,7кДж;
Объем газовой смеси в ходе реакции не меняется, следовательно изменение давления на скорость реакции не влияет. Реакция эндотермическая, следовательно при увеличении температуры равновесие сместится вправо. Константа равновесия для данной реакции:
К = [NО] 2 /[N2][О2].
c) 3О2 = 2О3; ∆Н 0 298 = +184,6кДж;
Объем газовой смеси в ходе реакции уменьшается, следовательно, как и для первой реакции увеличение давления сместит ее равновесие вправо. Реакция эндотермическая, следовательно при увеличении температуры равновесие сместится вправо
Константа равновесия для данной реакции:
К = [О3] 2 /[ О2] 3 .
d) 2СО + О2 = 2СО2; ∆Н 0 298 = -566,0кДж.
Объем газовой смеси в ходе реакции уменьшается, следовательно, как и для первой реакции увеличение давления сместит ее равновесие вправо. Реакция экзотермическая, при увеличении температуры сместится влево.
Константа равновесия для данной реакции:
К=[СО2] 2 /[СО] 2 [О2].
Задача 59
В каких нижеприведенных обратимых реакциях изменение давления не вызовет нарушения равновесия:
а) 2SО2 + О2 ⇔ 2SО3
б) НСl + О2 ⇔ 2Н2О + 2Сl2
в) МgСО3 ⇔ Мg + СО2
г) Н2 + I2 ⇔ 2НI
Решение:
Принцип Ле Шателье (принцип смещения равновесия), устанавливает, что внешнее воздействие, выводящее систему из состояния термодинамического равновесия, вызывает в системе процессы, стремящиеся ослабить эффект воздействия.
При увеличении давления смещение равновесия связано с уменьшением общего объёма системы, а уменьшению давления сопутствуют физ. или хим.процессы, приводящие к увеличению объема.
а) 2SО2 + О2 ⇔ 2SО3 — увеличение давления смещает равновесие в сторону образования продуктов реакции, уменьшение — в сторону обратной реакции, т.к. в результате реакции общий объем смеси уменьшается.
константа равновесия для этой реакции: К = [SО3] 2 /[SО2] 2 [О2]
б) НСl + О2 ⇔ 2Н2О + 2Сl2 — увеличение давления смещает равновесие в сторону исходных продуктов, уменьшение — в сторону образования продуктов реакции, т.к. в результате реакции объем смеси увеличивается. Константа равновесия для этой реакции:
К = [ Н2О] 2 [Сl2] 2 /[НСl][О2]
в) МgСО3 ⇔ Мg + СО2
Константа равновесия для этой реакции: К = [СО2] увеличение давления смещает равновесие в сторону исходных продуктов, уменьшение — в сторону образования продуктов реакции, т.к. в результате реакции объем смеси увеличивается.
г) Н2 + I2 ⇔ 2НI
Так ка объем смеси не меняется, то изменение давления не влияет на течение реакции. Константа равновесия для этой реакции:
К = [НI] 2 /[Н2][I2]
- Помогите,если вам не трудно. заранее большое спасибо))) 1. Смешали равные объемы оксида азота (II) и оксида азота (IV). Началась обратимая реакция, уравнение которой NO(r) + NO2(r) N2O3(r). С течением времени скорость обратной реакции: а) увеличивается; б) уменьшается; в) не изменяется; г) сначала увеличивается, затем остается постоянной.
- Химическое равновесие. Принцип Ле Шателье
- Понятие химического равновесия
- Признаки химического равновесия
- Принцип Ле Шателье
- Влияние температуры на химическое равновесие
- Влияние давления на химическое равновесие
- Влияние концентрации на химическое равновесие
- Константа химического равновесия
- Примеры решения задач
- Задачи для самостоятельного решения
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🌟 Видео
Видео:Химическое равновесие. Видеоурок 40. Химия 9 классСкачать

Помогите,если вам не трудно. заранее большое спасибо)))
1. Смешали равные объемы оксида азота (II) и оксида азота (IV). Началась обратимая реакция, уравнение которой
NO(r) + NO2(r) N2O3(r).
С течением времени скорость обратной реакции:
а) увеличивается;
б) уменьшается;
в) не изменяется;
г) сначала увеличивается, затем остается постоянной.
2. В каком направлении сместится равновесие в обратимом процессе, уравнение которого
2FeCl3(p-p) +2KI(p-p) 2FeCl2(p-p) + I2(p-p),
если увеличить концентрацию хлорида железа (III)?
а) сместится влево;
б) сместится вправо;
в) не сместится.
3. В какой реакции изменение давления не оказывает влия¬ния на положение равновесия?
a) SO2(г) + Cl2(г) SO2Cl2(г);
б)2NO(г) + O2(г) 2NO2(г);
в) SO2(г) + Н2О(ж) H2SO3(p.p);
г) 3Fe2O3(т) + СО(г) 2Fe3O4(т) + СО2(г).
4. По термохимическому уравнению
Fe3O4(т) + 4СО(г) 3Fe(т) + 4СО2(г) — 44 кДж
определите, в каком направлении смещается равновесие при уменьшении температуры реакции:
а) смещается влево;
б) смещается вправо;
в) смещается в сторону образования исходных веществ;
г) не смещается.
5. В каком направлении сместится химическое равновесие в
системе
2SO2(г) + O2(г) 2SO3(г)
при введении катализатора?
а) сместится в сторону исходных веществ;
б) сместится в сторону продуктов реакции;
в) не сместится;
г) сместится влево.
6. В реакции СН3СООН(ж) + СН3ОН(ж) СН3СООСН3(ж) + Н2О(ж)
для смещения равновесия в сторону образования сложного эфира СН3СООСН3 необходимо:
а) увеличить давление;
б) уменьшить концентрацию метанола СН3ОН;
в) увеличить концентрацию метилацетата СН3СООСН3;
г) удалить из реакционной системы воду.
7. Для уравнения какой реакции и увеличение давления, и уменьшение температуры смещают равновесие в одном и томже направлении?
a)2HI(г) H2(г) + I2(г) + Q;
б) CO2(г) + C(т) 2CO(г)-Q;
в) 2Fe(т) + ЗН2О(г) Fe2O3(т) + ЗН2(г) + Q;
г) N2(г) + O2(г) 2NO(г)-Q.
8. Каким образом в реакции
2NO(г) + O2(г) 2NO2(г) + Q
можно максимально сместить равновесие в сторону образова¬ния оксида азота (IV)?
а) увеличить давление, уменьшить температуру;
б) уменьшить давление, уменьшить температуру;
в) увеличить давление, увеличить температуру;
г) уменьшить давление, увеличить температуру.
9. Равновесие в реакции, уравнение которой
СН4(г) + 4S(ж) CS2(г) + 2H2S(г) + Q, сместится влево:
а) при понижении давления;
б) при понижении температуры;
в) при дополнительном введении серы;
г) при увеличении концентрации H2S.
10. Необратимой является химическая реакция, уравнение которой:
а) 2CH3I + 2Na СН3—СН3 + 2NaI;
б) СбН6 + H2SO4(конц) C6H5SO3H + Н2О;
в) 2NaHCO3 Na2CO3 + СО2 + Н2О;
г) HNO2 + NaOH NaNO2 + Н2О.
Видео:Смещение химического равновесия. Принцип Ле Шателье.Скачать

Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Видео:84. Принцип Ле-Шателье. Смещение равновесия (часть 1)Скачать

Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Видео:Решение задач из ЕГЭ и учебника на смещение химического равновесия (Ле Шателье).Скачать

Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Видео:Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Видео:11 класс. Химия. Химическое равновесие. Принцип Ле ШательеСкачать

Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Видео:Химическое равновесиеСкачать

Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Видео:119. Понятие химического равновесия. Смещение химического равновесияСкачать

Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Видео:Принцип Ле Шателье (видео 3) | Химическое равновесие | ХимияСкачать

Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Видео:Принцип смещения равновесия - Ле Шателье-Брауна. Практическая часть. 10 класс.Скачать
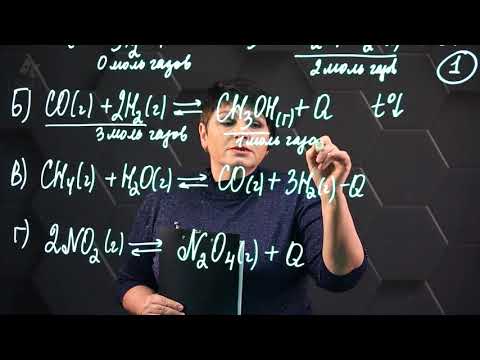
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Видео:Химическое равновесие в промышленных процессах. 10 класс.Скачать

Please wait.
Видео:Химическое равновесие. Смещение равновесия. Принцип Ле ШательеСкачать

We are checking your browser. gomolog.ru
Видео:1 Решение задачи графическим и аналитическим методомСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:124. Правило Вант-Гоффа. Решение задач.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7081a9aa880f9787 • Your IP : 85.95.179.80 • Performance & security by Cloudflare
🌟 Видео
Теорема об изменении кинетической энергии. Расчет механической системы.Скачать

КРУЧЕНИЕ ВАЛА. Касательные напряжения. Сопромат.Скачать

Графики зависимости кинематических величин от времени при равномерном и равноускоренном движенииСкачать

Как запомнить инозитол-3-фосфатный путь? Креативная биохимия от студентов.Скачать
