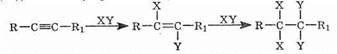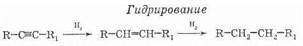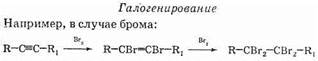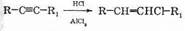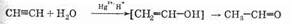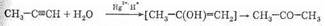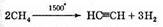По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения образуется замещенный алкен (с более реакционноспособной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
Кроме того, наличие кислотного характера связи С-Н в терминальных алкинах приводит к появлению совершенно нового вида реакций, нехарактерного для алкенов.
Используя специальные катализаторы, можно остановить реакцию на стадии алкена (даже при избытке водорода).
Отсюда видно, что качественная реакция с бромной водой не позволяет отличить алкены от алкинов.
Как уже говорилось, реакционная способность тройной связи ниже, чем двойной. Из-за этого галогеноводороды присоединяются к тройной связи только при наличии катализатора. В качестве катализатора используются кислоты Льюиса, обычно соответствующий галогеноводороду галогенид алюминия. Так, для присоединения хлороводорода используется хлорид алюминия:
Для несимметричных алкинов работает правило Марковникова.
Для гидратации алкинов также необходим катализатор. Им является сочетание солей двухвалентной ртути и кислой среды. Реакция гидратации алкинов с использованием этого катализатора называется реакцией Кучерова:
На первой стадии, как и следовало ожидать, образуется спирт, причем его гидроксильная группа связана с двойной связью. Такие спирты называются енолами. Енолы в свободном виде крайне нестабильны (это отражено в уравнении реакции квадратными скобками) и сразу изомеризуются, как это написано, в соответствующие альдегиды или кетоны. При изомеризации происходит перенос протона с гидроксида на атом углерода, а p-связь перемещается к атому кислорода. Движущей силой этой реакции является большая стабильность двойной связи углерод-кислород
| По сравнению со связью углерод-углерод.
Следует отметить, что в реакции Кучерова альдегид образуется только в случае ацетилена. Из всех остальных алкинов (в том числе и терминальных) образуются кетоны (поскольку первая
стадия процесса — электрофильное присоединение — подчиняется правилу Марковникова):
Как и алкены, алкины легко окисляются (в частности, пер. манганатом калия). Однако при этом обычно сразу образуются продукты с расщепленной С-С связью:
Однако внешние признаки реакции (обесцвечивание перманганата и появление коричневого осадка диоксида марганца) такие же, как для алкенов, и, значит, эта реакция также не пригодна для качественного различения алкенов и алкинов.
Алкины, конечно, сгорают на воздухе или в кислороде, образуя углекислый газ и воду.
Алкины, как и алкены, способны полимеризоваться. В зависимости от условий получаются самые разнообразные продукты. Однако очень важным является тримеризация ацетилена в бензол при 100°С. Катализатором этой реакции является активированный уголь:
Эта реакция важна, поскольку позволяет получить ароматические соединения из неорганических (через стадию карбида кальция).
Как мы уже говорили, в терминальных алкинах (с тройной связью на конце цепи) концевой атом водорода проявляет слабокислотные свойства. Соответственно такие алкины могут вступать в реакции с сильными основаниями и образовывать соли — ацетилениды:
Несколько иного типа реакция происходит между терминальными алкинами и аммиачными растворами оксида серебра или хлорида меди(I):
Образование осадка при реакции с одним из этих растворов может служить для качественного определения алкинов (особенно когда их нужно отличить от алкенов).
Хотя эти реакции также связаны с кислотностью алкинов, получающиеся соединения не являются, строго говоря, солями — характер связи C-Ag или С-Cu в значительной степени ковалент-
Вый. Однако при реакции с сильными кислотами эти соединения ведут себя как соли слабой кислоты:
Ионные ацетилениды (щелочных и щелочноземельных металлов) легко разлагаются даже водой и не могут быть получены реакцией с обычными щелочами.
Реакции образования-разложения ацетиленидов меди или серебра могут служить для выделения алкинов из сложных смесей.
Имеющий важнейшее промышленное значение ацетилен получают в настоящее время частичным термическим разложением метана:
При этом важную роль играет практически мгновенное охлаждение продуктов — иначе процесс пойдет дальше и получатся углерод и водород.
Ранее в промышленности (а сейчас в полевых условиях и в лаборатории) ацетилен получается действием воды на карбид кальция (который, по сути дела, представляет собой ацетиленид кальция):
Общим методом получения алкинов в лаборатории является дегидрогалогенирование дигалогеналканов:
При этом атомы галогена должны располагаться при одном атоме углерода. Получение алкина возможно также из виц-дигалогенида (атомы галогена расположены при соседних атомах углерода), если структура молекулы исключает возможность образования сопряженного диена (иначе получится именно он!).
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза.
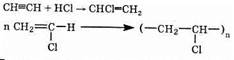
1. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
а отщеплением от последнего молекулы хлороводорода — 1,1,2-трихлорэтен:
Оба этих вещества являются весьма ценными и широко применяемыми растворителями.
2. Полимеры. Из ацетилена получают, в частности, поливинил-хлорид следующими двумя реакциями:
Поливинилхлорид очень широко применяется в промышленности и в быту. Более сложными схемами из ацетилена получают и другие мономеры.
- Разница между алкенами и алкинами
- Видео: Разница между алкенами и алкинами | Сравните разницу между похожими терминами
- Содержание:
- Что такое алкены?
- Природа
- Что такое алкины?
- В чем разница между алкенами и алкинами?
- Резюме — Алкенес против Алкинов
- Урок химии в 10-м классе: «Химические свойства алкенов и алкинов»
- 💡 Видео
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Разница между алкенами и алкинами
Видео:В ЧЕМ РАЗНИЦА — Алкены и Алкины // Органическая Химия 9 классСкачать

Видео: Разница между алкенами и алкинами | Сравните разницу между похожими терминами
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Содержание:
В ключевое отличие между алкенами и алкинами заключается в том, что алкены имеют двойные связи углерод-углерод, тогда как алкины имеют тройные связи углерод-углерод.
И алкены, и алкины представляют собой углеводороды, содержащие атомы углерода и водорода. К этим молекулам могут быть присоединены другие заместители вместо атомов водорода. Следовательно, возможно большое количество молекул. Благодаря множественным связям они могут полимеризоваться и образовывать более крупные цепи. Таким образом, они особенно ценны при синтезе полезных полимеров. Например, ПВХ, резина, различные виды пластика и т. Д.
1. Обзор и основные отличия
2. Что такое алкены
3. Что такое алкины
4. Сравнение бок о бок — алкены и алкины в табличной форме
5. Резюме
Видео:Химия с нуля — Химические свойства АлкеновСкачать

Что такое алкены?
Алкены — это углеводороды с двойными углерод-углеродными связями.. Мы также называем их олефинами. Этен — простейшая молекула алкена, имеющая два атома углерода и четыре атома водорода. Он имеет одну двойную связь углерод-углерод, а его молекулярная формула C2ЧАС4. Химическая структура этой молекулы следующая:
Называя алкены, мы используем суффикс «ен» вместо «ане» в конце названия алкана. Мы должны взять самую длинную углеродную цепь, содержащую двойную связь, и пронумеровать ее таким образом, чтобы дать минимальный номер двойной связи. По физическим свойствам алкены аналогичны соответствующим алканам.
Природа
Обычно алкены с низкой молекулярной массой находятся в газообразной форме при комнатной температуре. Например, этан и пропен — газы. Алкены — относительно неполярные молекулы; поэтому они растворяются в неполярных растворителях или растворителях с очень низкой полярностью. Следовательно, алкены плохо растворяются в воде. Причем плотность алкенов меньше, чем у воды.
Эти соединения претерпевают реакции присоединения за счет двойных связей. Например, в реакции гидрирования два атома водорода, присоединенные к двойной связи, превращают алкен в соответствующий алкан. Эта реакция ускоряется в присутствии металлического катализатора. В такой реакции присоединения, если реагент, который собирается присоединиться к двойной связи, присоединяется к той же стороне молекулы, мы называем это син-присоединением. Если сложение находится на противоположных сторонах, то мы называем это антисложением.
Аналогичным образом, алкены подвергаются различным типам добавок с молекулами, такими как галогены, HCl, вода и т. Д. Добавления могут происходить как по маркониковскому, так и по анти-маркониковскому типу. Более того, мы можем создавать эти молекулы посредством реакций отщепления. При рассмотрении стабильности алкенов, чем более сильно замещены атомы углерода двойной связи, тем выше стабильность. Кроме того, алкены могут содержать диастереоизомеры; следовательно, может проявляться стереоизомерия.
Видео:Правило Марковникова В.В. в реакциях присоединения у алкЕнов и алкИнов.Скачать

Что такое алкины?
Молекулы углеводородов с тройной углерод-углеродной связью являются алкинами. Общее название этого семейства — ацетилены. Этилен — простейшая молекула в этом семействе с двумя атомами углерода и двумя атомами водорода. Он имеет молекулярную формулу C2ЧАС2 и следующая его структура.
H — C ≡ C — H
Мы можем назвать эти соединения почти так же, как алкены. То есть мы можем дать им название, заменив «анэ» на «ин» в конце названия соответствующего алкана. Здесь мы должны пронумеровать углеродную цепочку, чтобы дать атомам углерода тройной связи наименьшее возможное число.
Кроме того, по физическим свойствам алкины аналогичны соответствующим алканам. Обычно алкины с низкой молекулярной массой находятся в газообразной форме при комнатной температуре. Например, этин — это газ. Более того, эти соединения являются относительно неполярными молекулами; поэтому они растворяются в неполярных растворителях или растворителях с очень низкой полярностью. Поэтому они плохо растворяются в воде. Плотность алкинов меньше, чем у воды. Алкины претерпевают реакции присоединения из-за своей тройной связи. Кроме того, мы можем синтезировать их реакциями элиминирования.
Видео:Номенклатура Алкенов и Алкинов. Органическая химия. ЕГЭ.Скачать

В чем разница между алкенами и алкинами?
Алкены и алкины — ненасыщенные углеводороды. Ключевое различие между алкенами и алкинами заключается в том, что у алкенов есть двойные углерод-углеродные связи, тогда как у алкинов есть тройные углерод-углеродные связи. Кроме того, атомы углерода с двойной связью 2 гибридизуются в алкенах, а атомы углерода с тройной связью sp-гибридизуются в алкинах. Еще одно различие между алкенами и алкинами состоит в том, что у алкенов нет кислого водорода, а у алкинов есть кислые атомы водорода.
Инфографика ниже представляет собой табличное представление разницы между алкенами и алкинами.
Видео:химические свойства алкенов и алкинов ( 9 класс, обзорно).Скачать

Резюме — Алкенес против Алкинов
Алкены и алкины представляют собой углеводородные соединения, содержащие атомы углерода и атомы водорода. Более того, они являются ненасыщенными соединениями (имеют двойные или тройные связи). Ключевое различие между алкенами и алкинами состоит в том, что алкены имеют двойные углерод-углеродные связи, тогда как алкины имеют тройные углерод-углеродные связи.
Видео:Номенклатура!Алканы, алкены и алкины!Скачать

Урок химии в 10-м классе: «Химические свойства алкенов и алкинов»
Разделы: Химия
Тип урока: Комбинированный.
Главная – сформировать представление о главном свойстве непредельных углеводородов – реакции присоединения симметричных и несимметричных реагентов (на основе правила В.В. Марковникова).
Сопутствующая – продолжать формирование умений и навыков составления уравнений реакций (на примерах реакциях присоединения). Контролировать и корректировать умения составлять формулы изомеров, решать расчетные задачи, извлекать информацию при наблюдении за химическим демонстрационным опытом, конструировать модели органических соединений.
Развивать у учащихся умения сравнивать и анализировать свойства алкенов, алкинов с алканами на основе их строения. Развивать абстрактное мышление, используя сведения о строении алкенов и алкинов в ходе практической работы, логически излагать свои мысли.
Развивать познавательные способности, потребности и интерес у учащихся, используя данные о применении изучаемых явлений и веществ в отрасли народного хозяйства.
Продолжить формирование химической картины мира, способствовать осознанию реальности существования атомов и молекул, и материального единства на основе этих представлений (показывая многообразие органических соединений).
Методы: частично-поисковый, рефлексия, фронтальный опрос, беседа по проблемным вопросам, практическая работа, самостоятельная работа, демонстрационный опыт.
Оборудование: таблица “Предельных углеводородов”, таблица-схема “Химические свойства алкенов, алкинов”, CD-диск “Органическая химия”, мультимедийный комплекс, пробирки, штатив, газоотводная трубка, хлоркальциевая трубка, спиртовки – 2, штатив, пластилин, спички.
Реактивы: концентрированная серная кислота, вода, этиловый спирт, CaCI2.
Этапы урока
Содержание
1. Общая характеристика химических свойств алкенов и алкинов.
2. Реакции окисления.
3. Присоединение симметричных реагентов.
2. Закрепление знаний, умений и навыков в виде упражнения (незаполненная цепочка превращений).
3. Оценки.
I. Приветствие, постановка задач урока.
II. Проверка домашнего задания:
2. Задачи на нахождение молекулярной формулы вещества
– по относительной плотности газообразного вещества,
– по плотности самого углеводорода.
III. Изложение нового материала.
Таблица № 1. Общая характеристика химических свойств алкенов и алкинов
– Из таблицы можно сделать следующий вывод: углеводороды с кратной связью вступают в реакции окисления, присоединения, полимеризации.
а) – Вспомните определение реакции горения. Самостоятельно запишите уравнение реакции горения ацетилена (демонстрационный опыт). Запишите наблюдения.
б) – Окисление с помощью окислителя KMnO4, условная запись – [О]. Качественная реакция на этилен! Розовый раствор обесцвечивается.
3. – Рассмотрим реакции присоединения симметричных реагентов. Обратите внимание на таблицу, где изображена схема реакций присоединения (таблица № 2 показывается с помощью компьютерного проектора).
Таблица № 2. Реакции присоединения к углеводородам с одной кратной связью (непредельные углеводороды)
– Почему реагенты называются симметричными?
– Посмотрите на запись первого уравнения реакции. Запишите ее в тетрадь и укажите вид этой реакции. Вы видите, что вид реакции – гидрирование. Какие реакции называются гидрированием? Слово “гидрирование” подчеркните. Сформулируйте определение реакции гидрирования. Запишите определение (присоединение водорода).
– Запишите вторую реакцию – присоединения брома. Как называется реакция?
Br2 – это галоген, значит, как в общем виде эта реакция может называться?
Она является качественной реакцией на этилен и ацетилен.
Ш: бромирование, галогенирование.
– Если проследить по схеме, мы можем увидеть генетическую связь. Алкины —> алкены—>алканы.
– А как получить из алкана —> алкен или алкин?
Ш: Реакцией дегидрирования – отщеплением молекулы водорода.
– Итак, что мы изучили?
Ш: реакции окисления, присоединение симметричных реагентов.
– Дана цепочка превращений:
Запишите уравнения реакций (Выборочная проверка тетрадей).
Этапы урока
Содержание
- Реакции присоединения несимметричных реагентов.
- Правило В.В. Марковникова.
Практическая работа с шаростержневыми моделями.
I. – Задачи урока:
1. Присоединение несимметричных реагентов.
2. Правило В.В. Марковникова.
II. – Запишите уравнение присоединения хлороводорода на примере пропена.
– Почему водород присоединяется к атому углерода с частично положительным зарядом? А хлор к атому углерода с частично отрицательным зарядом?
– Это присоединение объяснил наш русский ученый (ученик Бутлерова А.М.) В.В. Марковников, он сформулировал правило. Запишите его: “Атом водорода присоединяется к более гидрированному атому углерода при кратной связи”. По аналогии “Богатеет – богач!”. “Это правило и подтвердила в последующем электронная теория. Так как мы рассматриваем несимметричное перекрытие, из этого мы можем сделать вывод, что происходит смещение p–связи (э/о(Н) 9.12.2003
💡 Видео
Составление формул органических соединений по названиюСкачать

Органическая Химия — Алканы и Цепь из АтомовСкачать

МАГИЯ в Химии — Способы Получения АлкеновСкачать

Химия с нуля — АЛКИНЫ, Тройная связь, Типы Гибридизации // Органическая ХимияСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Изомеры, гомологи, органическая химияСкачать

7 ВАЖНЕЙШИХ РЕАКЦИЙ, которые тебе нужно знать (Алкины)Скачать

АЛКАНЫ АЛКЕНЫ /Ты точно поймёшь отличия!Скачать

Цепочки реакций алкены. Химия 9 класс | TutorOnlineСкачать

Видео №3. Как составить изомерыСкачать

Всё познаётся в сравнении. Алканы. Алкены. Алкины.Скачать