Буферные системы
буферные системы образованы буферными растворами
буферные – растворы, рН которых почти не меняется
при разбавлении или добавлении небольших количеств к-ты или основания
ПР: ацетатный СН3СООН + СН3СООNa
согласно протонной теории буферные системы — сопряженные кислотно-основные пары B/BH + и НА/А —

основание сопряженная к-та к-та сопряженное основание
в живых организмах буферные системы поддерживают кислотно-основный гомеостаз
кислотно-основный гомеостаз — кислотно-основное равновесие внутренней среды организма
рН внутренней среды организма должен быть оптимальным для биохимических реакций
для человека физиологическое значение pH=7,4
кислотно-основное равновесие поддерживают буферные свойства крови и механизмы коррекции
62)Классификация буферных систем.
буферные системы различают по компонентам:
— слабая кислота и ее соль, образованная сильным основанием – буферная система кислотного типа
ПР: ацетатный буфер СН3СООН + СН3СООNa
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: ацетатный буфер СН3СООН/СН3СОО —
— слабое основание и его соль, образованная сильной кислотой – буферная система основного типа
ПР: аммиачный буфер NН4ОН + NH4Cl
по теории Берстреда буферная система основного типа — сопряженная кислотно-основная пара B/BH +
— соли слабых многоосновных кислот – буферная система кислотного типа
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: фосфатный буфер H2PO — /HPO4 2-
— амфолиты – буферная система кислотного типа
ПР: аминокислотный буфер
63)Механизм действия ацетатного буфера.
ацетатный буфер состоит из уксусной кислоты СН3СООН и ацетата натрия СН3СООNa
— уксусная кислота – слабый электролит
 | |
 |  |
где Ка=1,85×10 -5 — коэффициент диссоциации уксусной кислоты
— ацетат натрия – сильный электролит
ацетат натрия увеличивает концентрацию аниона СН3СОО —
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево
диссоциация уксусной кислоты тормозится
практически, анион СН3СОО — образуется только путем диссоциации ацетата натрия СН3СООNa
молярная концентрация аниона СН3СОО — равна молярной концентрации соли [СН3СОО — ]=[СН3СООNa]

 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности уксусной кислоты
— при разбавлении ацетатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН ацетатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и ацетата натрия
СН3СОО — + Na + + H + + Cl — ® СН3СООH + Na + + Cl —
катионы водорода H + связываются анионами уксусной кислоты СН3СОО — + H + ® СН3СООH
рН ацетатного буфера изменится за счет увеличения концентрации уксусной кислоты и уменьшения соли
механизм изменения рН:
*хотя образуется избыток уксусной кислоты СН3СООH и равновесие реакции СН3СООН Û СН3СОО — + Н + смещается вправо,
но по закону Освальда повышение концентрации СН3СООH снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН ацетатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и уксусной кислоты
СН3СООH + Na + + ОН — ® СН3СОО — + Na + + Н2О
гидроксид-ионы ОH — связываются катионами водорода уксусной кислоты ОН — + H + ® Н2О
рН ацетатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона уксусной кислоты СН3СОО — и
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево,
но по закону Освальда снижение концентрации СН3СООH повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя уксусная кислота расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН ацетатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН ацетатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН ацетатного буфера значительно
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
фосфатный буфер состоит из солей ортофосфорной кислоты: однозамещенной NaH2PO4 и двузамещенной Na2HPO4
— соли ортофосфорной кислоты – сильные электролиты
Na2HPO4® NaHPO4 — + Na + NaHPO4 — ® HPO4 2- + Na + HPO4 2- Û PO4 3- + Н + (эта стадия практически, не идет)
важно, что H2PO4 — — слабая кислота и слабый электролит, NaHPO4 — — сильный электролит


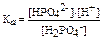
где Ка — коэффициент диссоциации кислоты H2PO4 —
— NaHPO4 — — сильный электролит
NaHPO4 — увеличивает концентрацию аниона HPO4 2-
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево
диссоциация H2PO4 — тормозится
практически, анион HPO4 2- образуется только путем диссоциации NaHPO4 —
молярная концентрация аниона HPO4 2- равна молярной концентрации соли [HPO4 2- ]=[NaHPO4 — ]
— рН фосфатного буфера определяет Ка и соотношение концентрации H2PO4 — и NaHPO4 —
 |
 |
 |
 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности кислоты H2PO4 —
— при разбавлении фосфатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН фосфатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и NaHPO4 —
HPO4 2- + Na + + H + + Cl — ® H2PO4 — + Na + + Cl —
катионы водорода H + связываются анионами HPO4 2- + H + ® H2PO4 —
рН фосфатного буфера изменится за счет увеличения концентрации H2PO4 — и уменьшения HPO4 2-
механизм изменения рН:
*хотя образуется избыток H2PO4 — и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается вправо,
но по закону Освальда повышение концентрации H2PO4 — снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН фосфатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и H2PO4 —
гидроксид-ионы ОH — связываются катионами водорода ОН — + H + ® Н2О
рН фосфатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона HPO4 2- и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево,
но по закону Освальда снижение концентрации HPO4 2- повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя HPO4 2- расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН фосфатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН фосфатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН фосфатного буфера значительно
- Буферные системы крови
- В чем заключается механизм действия фосфатного буфера привести уравнения соответствующих реакций
- Бикарбонатная буферная система. Фосфатная буферная система
- Относительная ёмкость буферов крови
- Фосфатная буферная система
- Механизм буферного действия. Составить в молекулярной и ионной форме уравнения реакций действия фосфатного буфера. Понятие о буферной ёмкости
- 📸 Видео
Видео:pH и буферные растворы | Медицинская химия | МедвузаСкачать

Буферные системы крови
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40 . Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемогло-биновая.
Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3 – , выполняющего роль акцептора протона:
Истинная концентрация недиссоциированных молекул Н2СО3 в крови незначительна и находится в прямой зависимости от концентрации растворенного углекислого газа (СО2 + Н2О Н2СО3). Поэтому удобнее пользоваться тем вариантом уравнения, в котором рКH2СО3 заменена «кажущейся» константой диссоциации Н2СО3, учитывающей общую концентрацию растворенного СО2 в крови:
При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н + взаимодействуют с ионами бикарбоната НСО3 – , что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси).
Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4 – (донор протонов) и иона НРО4 2– (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Для фосфатной буферной системы справедливо следующее уравнение:
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО4 2– ]: [Н2РО4 – ] составляет 4:1. Величина рКН2РО4– равна 6,86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО4 2– с образованием Н2РО4 – (Н + + + НРО4 2– —> Н2РО4 – ), а также ионов ОН – с ионами Н2РО4 – (ОН – + + Н2 Р О4 – —> HPO4 2– + H2O). Буферная пара (Н2РО4 – –НРО4 2– ) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости, величина рН которой в пределах 6,9–7,4. В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Фосфатный буфер в крови находится в тесном взаимодействии с бикарбонатной буферной системой. Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н + (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.
Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Константа диссоциации кислотных групп гемоглобина меняется в зависимости от его насыщения кислородом. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb).
Итак, гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
Именно таким образом превращение калийной соли гемоглобина эритроцитов в свободный ННb с образованием эквивалентного количества бикарбоната обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
Гемоглобин (ННb), попадая в капилляры легких, превращается в окси-гемоглобин (ННbО2), что приводит к некоторому подкислению крови, вытеснению части Н2СО3 из бикарбонатов и понижению щелочного резерва крови . Перечисленные буферные системы крови играют важную роль в регуляции кислотно-основного равновесия. Как отмечалось, в этом процессе, помимо буферных систем крови, активное участие принимают также система дыхания и мочевыделительная система.
Видео:Буферные системы, ацидоз и алкалоз, ур-ие Гендерсона-Гассельбаха (Атриум и Учим химию)Скачать

В чем заключается механизм действия фосфатного буфера привести уравнения соответствующих реакций
| Главная | Видео уроки | Книги |

|
|

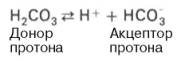
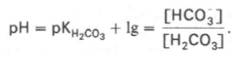
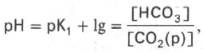
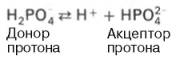
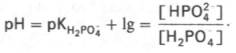

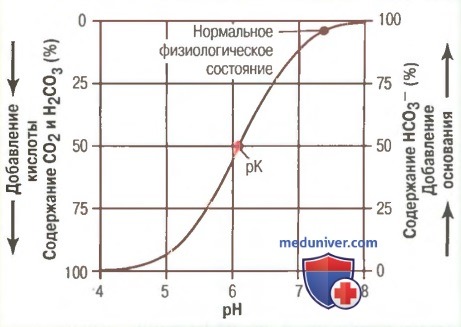 Кривая титрования бикарбонатной буферной системы, отражающая pH внеклеточной жидкости при изменении процентного содержания HCO3 — и CO2 (или H2CO3) в растворе
Кривая титрования бикарбонатной буферной системы, отражающая pH внеклеточной жидкости при изменении процентного содержания HCO3 — и CO2 (или H2CO3) в растворе
















