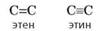этен: Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
Галогенирование:
CH2=CH2 + Cl2 → CH2Cl—CH2Cl
Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения.
Гидрирование:
CH2=CH2 + H — H → CH3 — CH3 (под действием Ni)
Гидрогалогенирование:
CH2=CH2 + HBr → CH3 — CH2Br
Гидратация:
CH2=CH2 + HOH → CH3CH2OH (под действием катализатора)
Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта.
Окисление:
Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений.
Окись этилена — непрочное вещество, кислородный мостик разрывается и присоединяется вода, в результате образуется этиленгликоль:
Горение:
C2H4 + 3O2 → 2CO2 + 2H2O
Полимеризация (получение полиэтилена) :
nCH2=CH2 → (-CH2-CH2-)n
этин: Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова) . В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен) . Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор) , образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
есть еще табл по свойствам
- Разница между этином и этином
- Видео:
- Содержание:
- Главное отличие — Этене против Этина
- Ключевые области покрыты
- Что такое этен
- Что такое этина
- Сходство этена и этина
- Разница между этином и этином
- Определение
- Распространенное имя
- Гибридизация углерода
- Молекулярная формула
- Расстояние между двумя атомами углерода
- Расстояние между атомом углерода и атомом водорода
- Молекулярная геометрия
- Количество Пи Облигаций
- Молярная масса
- Температура плавления
- Угол скрепления
- Заключение
- § 27. Этен и этин — ненасыщенные углеводороды
- Видео:
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разница между этином и этином
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Видео:
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Содержание:
Видео:Химия 10 класс (Урок№3 - Непредельные углеводороды – алкены.)Скачать

Главное отличие — Этене против Этина
Этен и этин — органические соединения, найденные под категорией углеводородов. Они называются углеводородами, потому что эти соединения полностью состоят из атомов C и H. Углеводороды могут быть алифатическими или ароматическими. Алифатические углеводороды имеют линейную или разветвленную структуру, тогда как ароматические углеводороды представляют собой циклические структуры. И этен, и этин являются алифатическими углеводородами. Этен является алкеном и состоит из двух атомов углерода и четырех атомов водорода. Этин является алкином и состоит из двух атомов углерода и двух атомов водорода. Этене это имя IUPAC для этилен, Ethyne — это имя IUPAC для Ацетилен, Основное различие между Ethene и Ethyne заключается в том, что Этен состоит из зр 2 гибридизированные атомы углерода, тогда как Ethyne состоит из sp-гибридизованных атомов углерода.
Ключевые области покрыты
1. Что такое этен
— Определение, свойства, реакции, приложения
2. Что такое Ethyne
— Определение, свойства, реакции, приложения
3. Каковы сходства между этином и этином
— Краткое описание общих черт
4. В чем разница между этином и этином
— Сравнение основных различий
Ключевые термины: ацетилен, алифатический углеводород, алкен, алкин, ароматический углеводород, этен, этилен, этин, углеводороды.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Что такое этен
Этен является алкеном. Общее название для этена этилен, Он состоит из двух атомов углерода и четырех атомов водорода. Химическая формула этена является C2ЧАС4, Два атома углерода связаны друг с другом через двойную связь. Атомы водорода связаны с этими атомами углерода через одинарные связи. Поскольку атомы углерода могут образовывать до 4 ковалентных связей, два атома водорода связаны с каждым атомом углерода. Угол связи между этими связями составляет около 121,3 о .
Рисунок 1: Молекулярная структура этена
Этена плоская. Два атома углерода являются sp 2 гибридизуются с образованием трех сигма-связей. Следовательно, существует одна орбиталь на атом углерода, которая остается негибридизованной, и эти орбитали образуют пи-связь двойной связи. Наличие этой пи-связи обуславливает реакционную способность этена.
Природные источники этена включают природные газы и нефтяное масло. Молярная масса этена составляет около 28 г / моль. При стандартной температуре и давлении этен является бесцветным газом. Это горючий газ, имеющий характерный запах. Температура плавления этена составляет около -169,4 о C. Температура кипения составляет около -103,9 о C.
Этен используется в процессах полимеризации в качестве мономера для производства полиэтилена. Он также используется для производства этиленоксида с целью производства моющих средств, таких как химические вещества.
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

Что такое этина
Общее название этина ацетилен, Этин представляет собой алкин, состоящий из двух атомов углерода и двух атомов водорода. Два атома углерода связаны друг с другом через тройную связь. Другими словами, между двумя атомами углерода существует сигма-связь и две пи-связи. Два атома водорода связаны с каждым атомом углерода через одинарные связи. Атомы углерода этина sp-гибридизованы. Следовательно, в каждом атоме углерода есть две негибридизированные p-орбитали. Эти p-орбитали вместе образуют две пи-связи. Молекулярная форма этина является линейной. Следовательно, угол связи между атомами составляет 180 о C.
Рисунок 2: Молекулярная структура этина
Химическая формула этина является C2ЧАС2, Молярная масса этина составляет около 26,04 г / моль. Это бесцветный газ без запаха при комнатной температуре и давлении. Температура плавления -80,8 о C. Тройная точка этина равна температуре плавления. Следовательно, при температурах ниже тройной точки твердый ацетилен может быть непосредственно превращен в газообразный этин (это называется сублимацией). Сублимационная точка этина -84,0 о C.
Этин обычно используется для производства кислородно-ацетиленового пламени для сварки. Он также используется в качестве исходного материала для производства подобных химических соединений, этанола, этановой кислоты и ПВХ.
Видео:Химия 9 класс (Урок№29 - Непредельные (ненасыщенные) углеводороды.)Скачать

Сходство этена и этина
- Обе молекулы состоят из двух атомов углерода.
- Обе молекулы имеют сигма-связи и пи-связи.
- Атомы углерода обеих молекул имеют негибридизованные п-орбитали.
- Обе молекулы существуют в газовой фазе при комнатной температуре и атмосферном давлении.
- Оба являются углеводородами.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Разница между этином и этином
Определение
Этилен: Этен является углеводородом, состоящим из двух атомов углерода и четырех атомов водорода.
этин: Этин представляет собой углеводород, состоящий из двух атомов углерода и двух атомов водорода.
Распространенное имя
Этилен: Общее название, используемое для этена, является этиленом.
этин:Общее название, используемое для этина — ацетилен.
Гибридизация углерода
Этилен: Атомы углерода sp 2 гибридизуется в этене.
этин: Атомы углерода sp-гибридизованы в этине.
Молекулярная формула
Этилен: Этен дан как С2ЧАС4.
этин: Ethyne дан как C2ЧАС2.
Расстояние между двумя атомами углерода
Этилен: Расстояние между двумя атомами углерода в этене составляет около 133,9 мкм.
этин: Расстояние между двумя атомами углерода в этине составляет около 120,3 мкм.
Расстояние между атомом углерода и атомом водорода
Этилен: Расстояние между С и Н в этене составляет около 108,7 вечера.
этин: Расстояние между С и Н в этине составляет около 106,0 вечера.
Молекулярная геометрия
Этилен: Геометрия этена плоская.
этин: Геометрия этина линейна.
Количество Пи Облигаций
Этилен: В этене есть одна пи-связь.
этин: В этине есть две пи-связи.
Молярная масса
Этилен: Молярная масса этена составляет около 28 г / моль.
этин: Молярная масса этина составляет около 26,04 г / моль.
Температура плавления
Этилен: Температура плавления этена составляет -169,4 ° С.
этин: Температура плавления этина составляет -80,8 о C.
Угол скрепления
Этилен: Угол связи в этене составляет 121,3 о .
этин: Угол связи в этине составляет 180 о .
Заключение
Этен и этин являются важными углеводородными соединениями, используемыми в промышленных целях. Эти молекулы часто используются в качестве мономеров для производства полимеров посредством процессов полимеризации. Основное различие между этином и этином состоит в том, что этен состоит из 2 гибридизированные атомы углерода, тогда как Ethyne состоит из sp-гибридизованных атомов углерода.
Видео:4.1. Алкадиены (диены): Строение, номенклатура, изомерия. ЕГЭ по химииСкачать

§ 27. Этен и этин — ненасыщенные углеводороды
Вспомните: как образуются кратные ковалентные связи (§ 2).
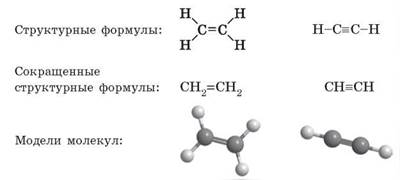
Молекулярная и структурная формулы этена и этина
• Ненасыщенные углеводороды — это углеводороды, в молекулах которых между атомами Карбона есть кратные связи — двойные или тройные.
Этен (этилен) — ненасыщенный углеводород, первый представитель гомологического ряда алкенов, главный признак которых — наличие в молекулах одной двойной связи между атомами Карбона.
Этин (ацетилен) — ненасыщенный углеводород, первый представитель гомологического ряда алкинов, в молекулах которых обязательно есть одна тройная связь между атомами Карбона.
В молекулах этих углеводородов есть по два атома Карбона, о чем можно узнать из их названия: названия «этен» и «этин» происходят от названия алкана этана, в молекуле которого есть два атома Карбона.
Составим структурные формулы этена и этина. Как и в случае с алканами, сначала запишем карбоновую цепь:
У этена каждый атом Карбона уже образует по две связи, следовательно, для соединения с Гидрогеном также остается по две связи. В этине каждый атом Карбона образует по три связи и может присоединить только по одному атому Гидрогена. Итак, для этена и этина:
Теперь мы можем посчитать атомы в молекулах и получаем молекулярные формулы: этен — C2H4, этин — C2H2.
Сравните структурные и молекулярные формулы этена и этина с соответствующими формулами этана: в молекуле этена на два атома Гидрогена меньше, чем в молекуле этана, а в молекуле этина — на четыре атома меньше. По этой причине атомы Карбона в молекулах этена и этина не полностью насыщены атомами Гидрогена, поэтому этен и этин — это ненасыщенные углеводороды.
Физические свойства этена и этина
Физические свойства ненасыщенных углеводородов подобны свойствам насыщенных углеводородов. Этен и этин при обычных условиях газообразны, бесцветны, плохо растворяются в воде (растворимость этена составляет 22,6 мл, а этина — 137 мл в 100 мл воды при 0 °С), хорошо растворяются в органических растворителях, не имеют запаха, температура плавления этена -169,2 °С, этина 80,8 °С; температура кипения этена 103,7 °С, этина — 83,8 °С. Технический этин, добываемый карбидным методом, обладает специфическим резким запахом.
Химические свойства этена и этина
Как и алканы, этен и этин активно вступают в реакцию горения с кислородом. Этен и этин — очень взрывоопасные вещества. Причем этин в воздухе вспыхивает от малейшей искры (даже от статического электричества пальцев руки), поэтому его обычно получают непосредственно перед использованием. Продуктами горения этих углеводородов, как и в случае алканов, являются углекислый газ и вода:
Горение этина широко используют в технике для сварки и резки металлов, поскольку ацетилен — рекордсмен по температуре пламени. Сконструированы специальные ацетиленовые горелки, в которых при правильно подобранном режиме подачи этина и кислорода температура пламени достигает 3000 °С (рис. 27.1).
Рис. 27.1. Пламя ацетиленокислородной горелки (а) и баллон для получения ацетилена из кальций карбида CaC2 перед подачей его в горелку — генератор ацетилена (б)
В отличие от алканов ненасыщенные углеводороды химически очень активны. Причем благодаря ненасыщенности наиболее характерными для них являются реакции присоединения, в результате которых к каждому атому Карбона при двойной или тройной связи присоединяется атом или группа атомов.
Гидрирование (гидрогенизация) — реакция присоединения водорода. Этин реагирует с водородом при нагревании в присутствии никелевого катализатора с образованием этена:
Этен также является ненасыщенным углеводородом и может соединяться с водородом при таких же условиях:
При достаточном количестве водорода этин может сразу присоединять максимальное количество водорода и превращаться в этан:
Если алканы с галогенами вступают в реакцию замещения, то ненасыщенные углеводороды с галогенами реагируют, как с водородом: вступают в реакцию присоединения. Например:
Для этой реакции катализатор не нужен. Она происходит даже в водном растворе брома. При пропускании этена или этина через бромную воду (раствор брома в воде) ее желто-коричневая окраска исчезает. Эту реакцию используют как качественную для выявления ненасыщенных соединений.
Применение ненасыщенных углеводородов
Этен в чистом виде почти не применяют, из него получают другие ценные химические продукты (рис. 27.2). Одно из самых ценных свойств этена — способность полимеризоваться, о чем будет идти речь в следующем параграфе. Благодаря этому свойству из него получают различные пластмассы.
Рис. 27.2. Применение этена
Этен обладает интересным свойством: он является фитогормоном, ускоряющим созревание плодов. Обычно овощи и фрукты, нуждающиеся в длительной транспортировке, например, из стран Африки или Южной Америки, срывают еще зелеными: если их сорвать спелыми, они быстро испортятся. А уже на месте фрукты и овощи помещают в специальную камеру с небольшим содержанием этилена (около 2 мл этилена на 1 л воздуха), где в течение 1-2 суток они дозревают.
Этин используют в ацетиленовых горелках для сварки и резки металлов. Он также является сырьем для синтеза ценных веществ и материалов (рис. 27.3).
Рис. 27.3. Применение этина
Этилен для стимуляции созревания плодов использовали еще в Древнем Египте. Египтяне специально слегка мяли финики, инжир и другие плоды: повреждение тканей стимулирует образование этилена растениями и ускоряет созревание. В Древнем Китае в закрытых помещениях специально сжигали деревянные ароматические палочки или свечи с целью стимулировать созревание фруктов: при сгорании свечей или древесины выделяется не только углекислый газ, но и другие промежуточные продукты неполного сгорания, в частности этилен.
Ключевая идея
Этен и этин, подобно алканам, являются неполярными веществами, но, в отличие от алканов, они более химически активны благодаря ненасыщенности.
Контрольные вопросы
- 307. Какие углеводороды называют ненасыщенными? В чем их главное отличие от насыщенных углеводородов?
- 308. Охарактеризуйте физические свойства этена и этина.
- 309. Изобразите молекулярную и структурную формулы этена и этина.
- 310. Составьте уравнения реакций горения этена и этина.
- 311. Опишите применение этена и этина.
- 312. В чем заключается существенное отличие химических свойств ненасыщенных углеводородов от насыщенных? Составьте уравнения реакций взаимодействия этена и этина: а) с водородом; б) с хлором.
Задания для усвоения материала
313. Определите, у какого углеводорода — этена или этина — плотность больше. Сравните их плотность с плотностью воздуха.
314. Сравните объемы углекислого газа, образующегося при полном сгорании равных объемов этана, этена и этина.
315. На сгорание равных объемов какого углеводорода — этана, этена или этина — расходуется меньше кислорода?
316. Используя информацию параграфа, вычислите массовую долю этена и этина в их насыщенных при температуре 0 °С растворах в воде.
317. Как изменяется растворимость этена и этина в воде при повышении температуры? Наблюдаются ли видимые признаки при нагревании насыщенного при определенной температуре раствора этена? этина?
318. Вычислите объем водорода (н. у.), с которым взаимодействует: а) этен массой 7 г; б) этин объемом 5,6 л (н. у.).
319. Вычислите объем этена (н. у.), необходимый для обесцвечивания бромной воды массой 400 г, в которой массовая доля брома составляет 2 %.
320. Как изменится объем смеси этилена с кислородом, в которой соотношение объемов газов составляет 1 : 3, при условии полного взаимодействия веществ и образования воды: а) жидкой; б) газообразной?
📺 Видео
Образование ионов. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Основания. 8 класс.Скачать

Химия. 10 класс. Натрий, калий и их важнейшие соединения: физические и химические свойстваСкачать

Габриелян О. С. 8 класс §40 "Основания, их классификация и свойства".Скачать

Говори как химик. Ионы. Катионы и АнионыСкачать

Химия (ОГН). Получение этилена и изучение его свойств (лабораторная работа)Скачать

Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]Скачать
![Периодическое изменение свойств химических элементов в ПСХЭ |Таблица Менделеева [Урок 10]](https://i.ytimg.com/vi/N5xnKLO8j4Y/0.jpg)
Таблица Менделеева. Металлические и неметаллические свойства. Радиус атома.Скачать

4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать

Краткий обзор хим. свойств простых веществ | ХИМИЯ ЕГЭ | Лия МенделееваСкачать