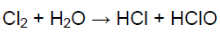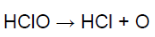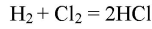Напишите уравнения реакций взаимодействия железа с хлором, с соляной кислотой, с кислородом, с серой. Схематически обозначьте переход электронов. Сравните, в каких случаях железо окисляется более глубоко. Почему?
2 Fe + 3 Cl2 = 2FeCl3
Стрелкой указать от железа к хлору 6ē.
Fe + 2 H Cl = FeCl2 + H2↑
Стрелкой указать от железа к водороду 12ē.
4 Fe + 3 O2 = 2Fe2O3
Стрелкой указать от железа к кислороду 2ē.
Fe + S = FeS
Стрелкой указать от железа к сере 2ē.
Более глубоко железо окисляется хлором и кислородом.
Переход электронов указать таким же образом, как в задании 3-1.
- Вопросы к параграфу 13 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 13. Хлор
- Вопросы и задания
- 1. В виде каких соединений хлор встречается в природе? Назовите наиболее важные из них и покажите их месторождения на карте. Почему хлор в природе не встречается в свободном состоянии? Оцените выполнение этого задания у соседа по парте.
- 2. Охарактеризуйте основные химические свойства хлора. Составьте уравнения химических реакций: а) лития с хлором; б) сгорания порошка железа в хлоре; в) горения водорода в хлоре; г) взаимодействия хлора с водой. Над знаками химических элементов проставьте степени окисления. Укажите окислитель и восстановитель.
- 3. Почему синяя лакмусовая бумага в свежеприготовленной хлорной воде обесцвечивается, а в хлорной воде, которая длительное время находилась на свету, краснеет?
- 4. На каких химических свойствах хлора основано его использование на практике? Напишите уравнения соответствующих реакций.
- 5. В закрытом прочном сосуде смешали 8 л хлора с 12 л водорода (н. у.) и смесь взорвали. Какой объём хлороводорода получился? Какой газ и в каком объёме остался в избытке?
- 6. Рассчитайте объем (н. у.), массу и количество вещества хлора, выделившеюся при взаимодействии оксида марганца(IV) МnO2 массой 17,4 г с соляной кислотой, взятой в избытке.
- 7. Рассмотрите рисунок 11. Используя Интернет или дополнительную литературу, узнайте, какое применение находят хлориды свинца и титана.
- В чем различие реакций железа с хлором и с соляной кислотой составьте уравнения реакций
- Как написать хороший ответ?
- 📺 Видео
Видео:Взаимодействие хлора с железомСкачать

Вопросы к параграфу 13 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Взаимодействие железа с соляной кислотойСкачать

§ 13. Хлор
Вопросы и задания
1. В виде каких соединений хлор встречается в природе? Назовите наиболее важные из них и покажите их месторождения на карте. Почему хлор в природе не встречается в свободном состоянии? Оцените выполнение этого задания у соседа по парте.
Из-за высокой активности хлор в природе встречается только в виде соединений в составе минералов: галита NaCl (Северная Америка), сильвина KCl (Германия, Великобритания, Канада, США, Индия, Италия, Россия, Белоруссия), сильвинита KCL•NaCl (Канада, Россия, Белоруссия, Израиль, Узбекистан, Германия), бишофита MgCL2•6H2O (Германия, Россия, Украина), карналлита KCl•MgCl2•6H2O, каинита KCl•MgSO4•3H2O.
2. Охарактеризуйте основные химические свойства хлора. Составьте уравнения химических реакций: а) лития с хлором; б) сгорания порошка железа в хлоре; в) горения водорода в хлоре; г) взаимодействия хлора с водой. Над знаками химических элементов проставьте степени окисления. Укажите окислитель и восстановитель.
3. Почему синяя лакмусовая бумага в свежеприготовленной хлорной воде обесцвечивается, а в хлорной воде, которая длительное время находилась на свету, краснеет?
Постепенно образовывается соляная кислота, которая создаёт кислую среду раствора и окрашивает лакмус в красный цвет. В свежеприготовленном растворе хлор не успевает среагировать, потому что вода является нейтральной средой, лакмус обесцвечивается.
4. На каких химических свойствах хлора основано его использование на практике? Напишите уравнения соответствующих реакций.
1.В хозяйственной деятельности: отбеливание тканей, очищение питьевой воды:
При взаимодействии хлора с водой образуется хлорноватистая кислота (сильный окислитель). Она разлагается, образуя кислород, обеспечивающий отбеливание.
2.Хлорирование (Получение пластмасс, медикаментов, красителей путём присоединения атомов хлора к органическим соединениям).
3.Производство соляной кислоты:
5. В закрытом прочном сосуде смешали 8 л хлора с 12 л водорода (н. у.) и смесь взорвали. Какой объём хлороводорода получился? Какой газ и в каком объёме остался в избытке?
6. Рассчитайте объем (н. у.), массу и количество вещества хлора, выделившеюся при взаимодействии оксида марганца(IV) МnO2 массой 17,4 г с соляной кислотой, взятой в избытке.
7. Рассмотрите рисунок 11. Используя Интернет или дополнительную литературу, узнайте, какое применение находят хлориды свинца и титана.
Хлорид титана (IV) TiCl4 применяется для:
- Как дымообразователь, для получения титана, оксида TiO2, катализаторов.
- Производства пигментной двуокиси титана, губчатого титана.
Хлорид свинца (II) PbCl2 применяется:
- Как катализатор в химической промышленности.
- Как катодный материал в резервных источниках тока.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

В чем различие реакций железа с хлором и с соляной кислотой составьте уравнения реакций
Вопрос по химии:
Чем различаються продукты реакции железа с соляной кислотой и железа с хлором ?
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
Fe+2HCl=FeCL2+H2
2Fe+3Cl2=2FeCL3
в первой реакции двухвалентное железо образуется, а во второй трехвалентное.
Будут различаться степенями окисления железа.
если добавить хлор то железо будет трех валентное,а если добавить соляную кислоту то железо будет двух валентным
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
📺 Видео
9 класс. Железо. Химические свойства. Ч1Скачать
Взаимодействие хлора с железомСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Растворение ЖЕЛЕЗА в СОЛЯНОЙ КИСЛОТЕ. Получение ХЛОРИДА ЖЕЛЕЗА.Химические опыты.Chemistry experienceСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Взаимодействие металлов с соляной кислотойСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Реакция сероводорода с хлоромСкачать

Опыты по химии. Соляная кислота и металлыСкачать

Химические свойства соляной кислотыСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакции ионного обмена. 9 класс.Скачать

СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать