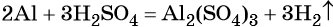Вопрос по химии:
11. Утверждения, справедливые для химической реакции, уравнение которой Mg + 2HCl = MgCl2 + H2 1)реакция обмена 2)реакция замещения 3) протекает с образованием осадка 4) реакция эндотермическая 5) для получения 1 моль водорода требуется 2 моль соляной кислоты
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химическое равновесие (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 |
1. Какое утверждение справедливо: а) в состоянии химического равновесия концентрация исходных веществ и продуктов реакции со временем не изменяются; б) при равновесии масса исходных веществ всегда равна массе продуктов; в) при равновесии никакие химические реакции в системе не протекают; г) в состоянии равновесия всегда равны концентрации исходных веществ и продуктов.
2. Закон, определяющий соотношение между равновесными концентрациями, называется:
1) законом сохранения масс;
2) законом Рауля;
3) законом Вант-Гоффа.
3. Чтобы записать выражение для константы равновесия, необходимо знать:
1) полное стехиометрическое уравнение реакции;
2) механизмы прямой и обратной реакции;
3) изменение энтальпии для реакции;
4) кинетические уравнения для прямой и обратной реакции.
4. Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций:
1) введение катализатора,
2) изменение концентраций реагирующих веществ,
3) изменение температуры.
4) введение катализатора и повышение температуры.
5. Какие из перечисленных факторов влияют на константу равновесия реакции, если она протекает между веществами в газообразном состоянии: а)Р, б) Т, в) присутствие инертного газа, г) природа реагирующих, д) парциальные давления взятых для реакции веществ.
6. Изменится ли и как значение константы равновесия реакции: А +2В↔АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в газообразном состоянии.
1) увеличится в 4 раза,
2) увеличится в 2 раза,
3) уменьшится в 4 раза,
7. Если система находится в состоянии равновесия, то какое из следующих утверждений является верным:
8. При каком соотношении ∆Н и Т ∆ S система находится в равновесии:
9. Для некоторой реакции ∆ G ›0. Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают продукты реакции, г) в равновесной смеси преобладают исходные вещества.
10. Для некоторой реакции ∆ G ‹0. . Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают исходные вещества, г) в равновесной смеси преобладают продукты реакции.
11. Как изменится энтропия изолированной системы, в которой обратимо кристаллизуются вещества?
4) достигает максимального значения.
12. Влияние различных факторов на химическое равновесие определяет:
1) принцип Ле-Шателье,
2) константа химического равновесия,
3) закон действующих масс,
4) закон Вант-Гоффа.
13. Какие факторы влияют на смещение химического равновесия, если реакция протекает в жидкой фазе: а) концентрации реагирующих веществ, б) давление, в) температура, г) время, д) катализатор?
14. Какие воздействия на систему 2 SO 2(г)+ O 2(г)↔ 2 SO 3(г)уменьшают выход продукта реакции: а) увеличение концентрации O 2, б) увеличение концентрации SO 3, в) повышение давления, г) возрастание объема реакционного сосуда.
15. В каком направлении сместится равновесие в системе 4 Fe + 3 O 2↔2 Fe 2 O 3 при увеличения давления?
1) в сторону прямой реакции;
3) в сторону обратной реакции;
4) в сторону увеличения давления.
16. В какую сторону будет смещаться равновесие при повышении температуры в системе: N 2(г)+3 H 2(г)↔2 NH 3(г), ∆Н‹0?
4) в сторону эндотермической реакции.
17. В каких из ниже приведенных реакций изменение давления не вызовет нарушения равновесия: а) H 2(г)+ I 2(г)↔2 HI (г); б) 2 SO 2(г)+ O 2(г)↔ 2 SO 3(г); в) 4 HCl (г)+ O 2(г)↔2 H 2 O (г)+ 2 Cl 2(г)?
18. Если объем закрытого реакционного сосуда, в котором установилось равновесие 2 SO 2(г)+ O 2(г)↔ 2 SO 3(г), уменьшить в 2 раза, то..э
1) равновесие не сместится,
2) равновесие сместится влево;
3) равновесие сместится вправо;
4) недостаточно данных для ответа.
19. Вследствие каких реакций повышение температуры и давления приведет к смещению равновесия вправо: а) 3О2(г)↔2О3(г), ∆Н298= 184,6кДж; б) N 2(г)+ O 2(г)=2 NO , ∆Н=180,7 кДж; в) COCl 2(г)↔ CO (г)+ Cl 2(г), ∆ H = 112,5 кДж; г) 2 CO (г)↔ CO 2(г)+С(г), ∆ H =-172,5 кДж; д) CO 2(г)+ 2 H 2(г)↔С H 3 OH (г), ∆ H =193,3кДж.
20. В каком направлении сместиться равновесие в системе Hb + O 2↔ Hb O 2, при увеличении парциального давления кислорода?
1) в сторону прямой реакции;
2) равновесие не сместится;
3) в сторону обратной реакции;
4) в сторону увеличения давления.
21. Биохимическое равновесное состояние системы характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
22. стационарное состояние для живого организма характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
23. Условия химического равновесия:
24. Для открытых систем стационарное состояние характеризуется приростом энтропии в единицу времени, которое:
1) 
2) 
3) 
4) 
25. Биологические системы в стационарном состоянии характеризуются тем, что:
1) далеки от равновесия;
2) близки к равновесию;
3) близки к равновесию;
4) далеки от равновесия.
26. В соответствии с принципом Пригожина для стационарного состояния рассеяние энергии Гиббса открытой системой:
4) не происходит.
27. Несколько одновременно существующих равновесий можно рассматривать как изолированные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
28. Несколько одновременно существующих равновесий можно рассматривать как совмещенные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
29. В биологических системах протекают совмещенные равновесия, в которых преобладающим становится процесс, характеризующийся:
1) большим значением константы равновесия, т. е. меньшей убылью энергии Гиббса;
2) меньшим значением константы равновесия, т. е. меньшей убылью энергии Гиббса;
3) большим значением константы равновесия, т. е. большей убылью энергии Гиббса;
4) меньшим значением константы равновесия, т. е. большей убылью энергии Гиббса.
30. Гидроксид алюминия – антацидное вещество, снижение кислотности желудочного сока обусловлено реакцией: Al ( OH )3+ H + ↔ Al ( OH )+ H 2 O . Растворение прекращается при pH =4. Укажите преобладающий конкурирующий процесс: а) при pH ‹ 4 преобладает протолитическое равновесие; б) при pH › 4 преобладает гетерогенное равновесие; в) при pH › 4 преобладает протолитическое равновесие; г) при pH ‹ 7 преобладает гетерогенное равновесие.
1. Что изучает кинетика?
1) возможность протекания химических процессов;
2) энергетические характеристики физических и химических процессов;
3) скорости протекания химических превращений и механизмы этих превращений;
4) тепловые эффекты биохимических процессов.
2. Что называют истинной скоростью химической реакции?
1) количество вещества, прореагировавшего в единицу времени в единице объема;
2) производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
3. Что называют средней скоростью химической реакции?
1) количество вещества, прореагировавшего в единицу времени в единице объема;
2) производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
4. Какое уравнение можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации (с) или количества вещества (п) продуктов реакции: а) υ=; б) υ= — ; в) υ = 
5. Какое уравнение можно использовать для вычисления средней скорости гетерогенной реакции по изменению количества вещества исходных веществ: а) υ= — 

6. какое уравнении можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации или количества вещества исходных веществ: а) υ=; б) ) υ= — ; в) υ= 

7. Как изменяются скорости прямой и обратной реакции во времени от начала реакции?
1) прямой – увеличивается, обратной – уменьшается;
2) прямой– уменьшается, обратной– увеличивается;
3) прямой и обратной – увеличивается;
4) прямой и обратной– уменьшается.
8. Скорость химической реакции зависит от:
1) температуры, времени, концентрации;
2) природы реагирующих веществ, температуры, концентрации;
3) времени, температуры, концентрации, природы реагирующих веществ;
4) времени, температуры, концентрации.
9. Какие из следующих факторов влияют на скорость химической реакции: а) природа реагирующих веществ, б) концентрация реагирующих веществ, в) катализатор, г) растворитель, д) температура:
10. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз для реакций:
3) протекающих в газовой фазе;
4) протекающих в твердой фазе.
11. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема для реакции:
3) на границе твердое тело – жидкость;
4) на границе газ – жидкость.
12. Единицы измерения скорости химической реакции: а) мольл-1с-1, б) лмоль-1, в) смоль-1, г) мольл-1мин-1.
13. Сформулируйте основной закон химической кинетики:
1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии;
2) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции;
3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема;
4) скорость реакции увеличивается при увеличении температуры.
14. Закон действующих масс устанавливает зависимость между скоростью химической реакции и:
2) концентрацией реагирующих веществ;
3) массой реагирующих веществ;
4) количеством реагирующих веществ.
15. От каких факторов зависит величина константы скорости химической реакции?
1) от времени реакции, температуры, катализатора;
2) от природы реакции, температуры, концентрации;
3) от природы реакции, температуры, катализатора;
4) от природы реакции и температуры.
16. Когда численное значение константы скорости и скорости совпадают?
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
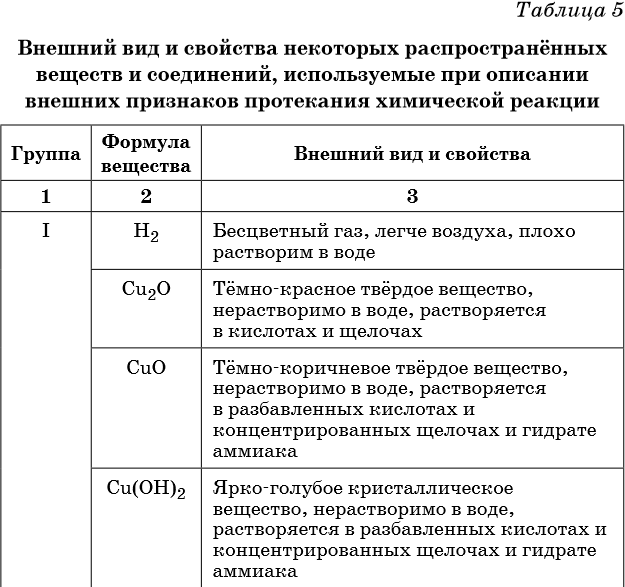
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
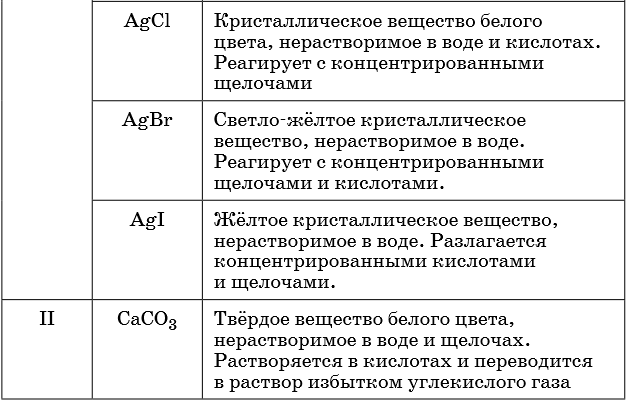
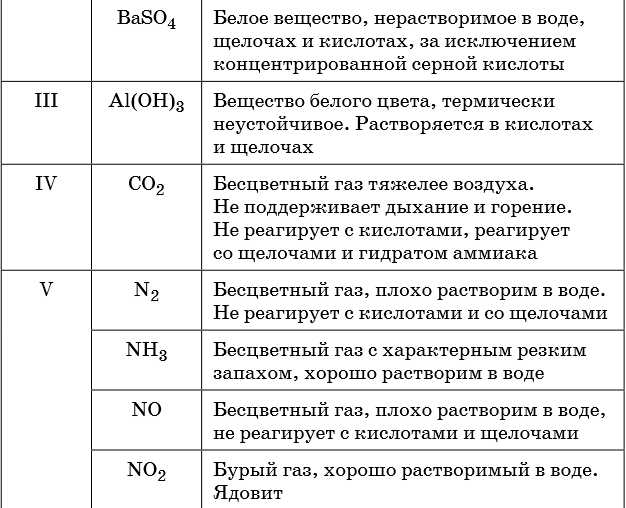
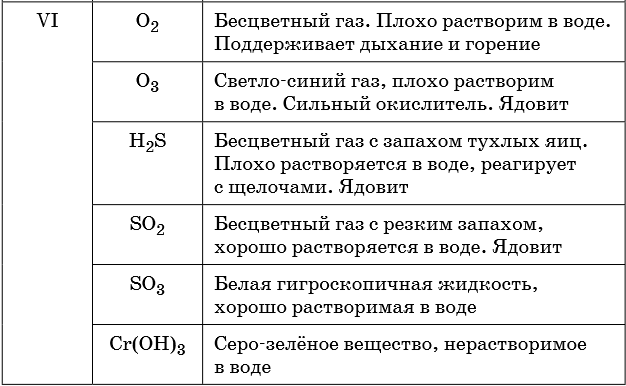
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
🔍 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 класс. Составление уравнений химических реакций.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать