22. Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||
| А) | соединения | 1) | 2СН4 → С2Н2 + 3Н2 |
| Б) | разложения | 2) | 2SO2 + O2 = 2SO3 |
| В) | замещения | 3) | СН4 + Cl2 → СН3Cl + HCl |
| Г) | обмена | 4) | AgNO3 + KCl = AgCl↓ + KNO3 |
| А | Б | В | Г |
23.Установите соответствие между типом реакции и уравнением, по которому она протекает.
| ТИП РЕАКЦИИ | УРАВНЕНИЕ РЕАКЦИИ | ||
| А) | соединения, эндотермическая | 1) | Cu(OH)2 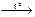 CuO + H2O CuO + H2O |
| Б) | соединения, экзотермическая | 2) | CaO + H2O = Ca(OH)2 |
| В) | разложения, эндотермическая | 3) | N2 + O2  2NO 2NO |
| Г) | обмена, экзотермическая | 4) | 2K + 2H2O = 2KOH + H2 |
| 5) | HCl + NaOH = NaCl + H2O | ||
| А | Б | В | Г |
Тепловой эффект химической реакции
Базовый уровень сложности
1.В результате реакции, термохимическое уравнение которой
2Mg + O2 = 2MgO + 1200 кДж,
выделилось 600 кДж теплоты. Объем (н.у.) вступившего при этом в реакцию кислорода равен
| 1) | 44,8 л | 2) | 22,4 л | 3) | 11,2 л | 4) | 112 л |
2.В результате реакции, термохимическое уравнение которой
2Сa + O2 = 2CaO + 1270 кДж,
образовалось 56 г оксида кальция. Количество выделившейся при этом теплоты равно
| 1) | 635 кДж | 2) | 2540 кДж | 3) | 317,5 кДж | 4) | 254 кДж |
3.В соответствии с термохимическим уравнением реакции
количество теплоты, выделяющееся при сгорании 270 г алюминия, равно
| 1) | 6704 кДж | 2) | 1340,8 кДж | 3) | 8380 кДж | 4) | 838 кДж |
4.В результате реакции, термохимическое уравнение которой
выделилось 1188 кДж теплоты. Объем (н.у.) образовавшегося при этом сернистого газа равен
| 1) | 44,8 л | 2) | 89,6 л | 3) | 890 л | 4) | 112 л |
5.В результате реакции, термохимическое уравнение которой
выделилось 990 кДж теплоты. Масса вступившего в реакцию сернистого газа равна
| 1) | 1280 г | 2) | 1600 г | 3) | 320 г | 4) | 640 г |
6.В соответствии с термохимическим уравнением реакции
количество теплоты, выделившейся при сгорании 11,2 л (н.у.) оксида углерода(II), равно
| 1) | 113,6 кДж | 2) | 142 кДж | 3) | 284 кДж | 4) | 838 кДж |
7.В результате реакции, термохимическое уравнение которой
образовалось 224 л (н.у.) кислорода. Количество теплоты, выделившейся при этом, равно
| 1) | 450 кДж | 2) | 270 кДж | 3) | 300 кДж | 4) | 150 кДж |
8.В результате реакции, термохимическое уравнение которой
выделилось 46 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 67, 2 л | 2) | 44,8 л | 3) | 11,2 л | 4) | 33,6 л |
9.В результате реакции, термохимическое уравнение которой
выделилось 160,4 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 4,48 л | 2) | 13,44 л | 3) | 8,96 л | 4) | 11,2 л |
10.В результате реакции, термохимическое уравнение которой
выделилось 451 кДж теплоты. Объем (н.у.) вступившего в реакцию аммиака равен
| 1) | 44,8 л | 2) | 112 л | 3) | 67,2 л | 4) | 22,4 л |
11.В результате реакции, термохимическое уравнение которой
образовалось 22,4 л (н.у.) азота. Количество выделившейся при этом теплоты равно
| 1) | 1532 кДж | 2) | 766 кДж | 3) | 306,4 кДж | 4) | 3064 кДж |
12.В результате реакции, термохимическое уравнение которой
образовалось 7,2 г воды. Количество выделившейся при этом теплоты равно
| 1) | 114,4 кДж | 2) | 57,2 кДж | 3) | 143 кДж | 4) | 228,8 кДж |
13.В результате реакции, термохимическое уравнение которой
выделилось 373 кДж теплоты. Объем (н.у.) вступившего в реакцию водорода равен
| 1) | 448 л | 2) | 56 л | 3) | 112 л | 4) | 224 л |
14.В результате реакции, термохимическое уравнение которой
поглотилось 34,6 кДж теплоты. Объем (н.у.) образовавшегося при этом оксида углерода(II) равен
| 1) | 22,4 л | 2) | 4,48 л | 3) | 8,96 л | 4) | 11,2 л |
15.В результате реакции, термохимическое уравнение которой
образовалось 11,2 л (н.у.) хлороводорода. Количество выделившейся при этом теплоты равно
| 1) | 18,46 кДж | 2) | 37,92 кДж | 3) | 46,15 кДж | 4) | 92,3 кДж |
16.В соответствии с термохимическим уравнением реакции
количество теплоты, выделяющееся при окислении 36 г глюкозы, равно
| 1) | 560 кДж | 2) | 280 кДж | 3) | 140 кДж | 4) | 420 кДж |
17.В соответствии с термохимическим уравнением реакции
количество теплоты, выделяющееся при образовании 8,8 г углекислого газа, равно
| 1) | 705 кДж | 2) | 70,5 кДж | 3) | 282 кДж | 4) | 141кДж |
18.В соответствии с термохимическим уравнением реакции
при сгорании 112 л (н.у.) этана количество выделившейся теплоты равно
| 1) | 15600 кДж | 2) | 7800 кДж | 3) | 3900 кДж | 4) | 1560 кДж |
19.В соответствии с термохимическим уравнением реакции
при сгорании 26 г ацетилена количество выделившейся теплоты равно
| 1) | 1305 кДж | 2) | 5220 кДж | 3) | 522 кДж | 4) | 652,5 кДж |
20.В результате реакции, термохимическое уравнение которой
выделилось 458 кДж теплоты. Объем (н.у.) вступившего в реакцию кислорода равен
| 1) | 144,4 | 2) | 33,6 л | 3) | 67,2 л | 4) | 22,4 л |
21.В результате реакции, термохимическое уравнение которой
выделилось 570 кДж теплоты. Объем (н.у.) вступившего в реакцию оксида азота(II) равен
| 1) | 144,4 | 2) | 336 л | 3) | 112 л | 4) | 224 л |
22.В результате реакции, термохимическое уравнение которой
образовалось 56 л (н.у.) оксида азота(II). Количество поглотившейся при этом теплоты равно
| 1) | 90,4 кДж | 2) | 113 кДж | 3) | 226 кДж | 4) | 452 кДж |
23.В результате реакции, термохимическое уравнение которой
образовалось 10,8 г серебра. Количество поглотившейся при этом теплоты равно
| 1) | 31,7 кДж | 2) | 15,85 кДж | 3) | 63,4 кДж | 4) | 12,68 кДж |
Термодинамика химических процессов. Закон Гесса. Понятие об энтальпии, энтропии, энергии Гиббса*
1*.Определите ΔН о образования этилена по следующим данным:
| С(графит) + О2(г) = СО2(г), | ΔН º = — 393,5 кДж |
| Н2 + 1/2 О2(г) = Н2О(г), | ΔН о = — 241,8 кДж |
| С2Н4(г) + 3О2(г) = 2СО2(г) + 2Н2О(г), | ΔН о = — 1323 кДж |
2*. Вычислите ΔН о образования карбоната магния, используя следующие данные:
| С(графит) + О2(г) = СО2(г), | ΔНº = — 393,5 кДж |
| 2Мg(тв) + О2(г) = 2МgО(тв), | ΔНº = — 1203,6 кДж |
| МgО(тв) + СО2(г) = МgСО3(тв), | ΔНº = — 117,7 кДж |
3*. Рассчитайте ΔНº реакции 2Р(белый) + 5Cl2(г.) = 2РCl5(г.), используя следующие данные:
| 2Р(белый) + 3Cl2(г) = 2РCl3(г), | ΔНº = — 558,9 кДж |
| РCl3(г) + Cl2(г) = РCl5(г) | ΔНº = — 90,5 кДж |
4*. Оксид серы (VI) трудно получить при непосредственном сгорании серы в кислороде. Определите энтальпию образования SO3(г.), зная, что энтальпия образования SO2(г.) составляет – 297,1 кДж/моль, а энтальпия реакции окисления 1 моль SO2(г.) газообразным кислородом до SO3(г.) равна – 99,0 кДж.
5*. Определите энтальпию образования глюкозы по следующим данным:
| С(графит) + О2(г) = СО2(г), | ΔНº = — 393,5 кДж |
| Н2 + 1/2 О2(г) = Н2О(г), | ΔН о = — 241,8 кДж |
| С6Н12О6(тв) + 6О2(г) = 6СО2(г) + 6Н2О(г), | ΔН о = — 2538,8 кДж |
6*.Определите, какой из сульфидов можно растворить в разбавленной соляной кислоте, используя следующие данные:
| ZnS(тв) + 2HCl(р-р) = H2S(г) + ZnCl2(р-р), | ΔGº = — 462,6 кДж |
| PbS(тв)+ 2HCl(р-р) = H2S(г) + PbCl2(р-р), | ΔGº = + 31,0 кДж |
7*.Определите, можно ли синтезировать хлориды фосфора из простых веществ при стандартных условиях, используя следующие данные:
| Р(белый) + 3/2Cl2 = РCl3(г), | ΔGº = — 286,7 кДж |
| Р(белый) + 5/2Cl2 = РCl5(г), | ΔGº = — 325,1 кДж |
8*.Определите, какой из углеводородов можно получить из простых веществ при стандартных условиях, используя следующие данные:
| С(графит) + Н2(г) = СН4(г), | ΔGº = — 50,5 кДж |
| 2С(графит) + 2Н2(г) = С2Н4(г), | ΔGº = + 68,1 кДж |
| 2С(графит) + Н2(г) = С2Н2(г), | ΔGº = + 209,9 кДж |
9*.Определите, какие из тетрагалогеналканов можно получить из простых веществ при стандартных условиях, используя следующие данные:
| С(графит) + 2F2(г) = СF4(г), | ΔGº = — 636,0 кДж |
| С(графит) + 2Cl2(г) = СCl4(г), | ΔGº = — 64,1 кДж |
| С(графит) + 2Br2(г) = СBr4(г), | ΔGº = + 36,0 кДж |
| С(графит) + 2I2(г) = СI4(г), | ΔGº = + 124,9 кДж |
10*.Определите, какой из гидроксидов (II) наиболее устойчив к окислению при стандартных условиях, используя следующие данные:
| Fe(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Fе(ОН)3(тв), | ΔGº = — 92,2 кДж |
| Со(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Со(ОН)3(тв), | ΔGº = — 23,7 кДж |
| Ni(OH)2(тв) + 1/4О2(г) + 1/2Н2О(ж) = Ni(ОН)3(тв), | ΔGº = + 22,9 кДж |
11*.Энтропия системы возрастает в процессах
| 1) | СаО(тв) + SO2(г) = CaSO3(тв) |
| 2) | Fe3O4(тв) + 4Н2(г) = 3Fe(тв) + 4Н2О(ж) |
| 3) | С6Н12О6(тв) + 6О2(г) = 6СО2(г) + 6Н2О(г) |
| 4) | 2H2(г) + О2(г) = 2Н2О(ж) |
| 5) | СаСО3(тв) = СаО(тв) + СО2(г) |
| 6) | 2Сu(NO3)2(тв) = 2CuO(тв) + 4NO2(г) + О2(г) |
12*. Энтропия системы возрастает в процессах
| 1) | (NH4)2Cr2O7(тв) = Cr2O3(тв) + N2(г) + 4H2O(г) |
| 2) | Fe2O3(тв) + 3Н2(г) = 2Fe(тв) + 3Н2О(ж) |
| 3) | NH4NO2(тв) = N2(г) + 2Н2О(г) |
| 4) | NH4Сl(тв) = NH3(г) + НСl(г) |
| 5) | СаО(тв) + СО2(г) = СаСО3(тв) |
| 6) | 2Fe(тв) + 3Cl2(г) = 2FeCl3(тв) |
13*.Энтропия системы уменьшается в процессах
| 1) | N2(г) + 3Н2(г) = 2NН3(г) |
| 2) | 2KClO3(тв) = 2KCl(тв) + 3O2(г) |
| 3) | 4Al(тв) + 3O2(г) = 2Al2O3(тв) |
| 4) | СН4(г) = С(тв) + 2Н2(г) |
| 5) | NH4NO3(тв) = N2O(г) + 2Н2О(г) |
| 6) | MgО(тв) + СО2(г) = MgСО3(тв) |
14*.Энтропия системы уменьшается в процессах
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Please wait.
Видео:ОГЭ химия. Установите соответствие между веществом и возможными реагентамиСкачать

We are checking your browser. gomolog.ru
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 701aa281d86200cd • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
|






 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5














