Установите соответствие между способом воздействия на равновесную систему
4 HCl (г) + O 2(г) 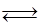
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Видео:Условия смещения химического равновесия. 9 класс.Скачать

зачет по теме «Скорость химических реакций. Химическое равновесие» (11 класс)
материал для подготовки к егэ (гиа) по химии (11 класс) на тему
Данный материал позволяет проверить знания учащихся по теме «Скорость химических реакций. Химическое равновесие». Может использоваться как тренировочный тест при подготовке к ЕГЭ.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Скачать:
| Вложение | Размер |
|---|---|
| zachet_no2_po_teme_skorostprofil.docx | 59.57 КБ |
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 2 часть. 9 класс.Скачать

Предварительный просмотр:
Зачет «Скорость химических реакций. Химическое равновесие» Вариант №1
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Концентрация 4) Форма сосуда, в котором протекает реакция
А2. Фактор, влияющий на смещение химического равновесия:
1) Вид химической связи 2) Катализатор 3) Природа реагирующих веществ 4) Температура
А3. С увеличением концентрации азота в 2 раза скорость прямой реакции, уравнение которой N 2 (г)+O 2 (г)↔2NO(г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С увеличением давления в 5 раз скорость прямой реакции, уравнение которой 2NO(г)+O 2 (г)↔2NO 2 (г), увеличится в:
1) 5 раз 2) 25 раз 3) 75 раз 4) 125 раз
А5. При повышении температуры на 10°С (температурный коэффициент равен 2) скорость химической реакции увеличивается:
1) в 2 раза 2) в 4 раза 3) в 8 раз 4) в 16 раз
А6. С увеличением давления равновесие обратимой реакции, уравнение которой C 2 H 4(г) +H 2 O (г) ↔C 2 H 5 OH (г)
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции 2SO 2 (г)+O 2 (г)↔2SO 3 (г)+Q в сторону исходных веществ необходимо :
1) Увеличить давление 2) Повысить температуру 3) Понизить температуру 4) Ввести катализатор
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) Zn(гранулы) + HCl 2) Zn(пыль) + HCl 3) Pb + HCl 4) Fe + HCl
А9. Повышение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2H 2 + O 2 ↔ 2H 2 O + Q 2) SO 2 + H 2 O ↔ H 2 SO 3 + Q
3) 2NO + O 2 ↔ 2NO 2 + Q 4) C 4 H 10 ↔ C 4 H 8 + H 2 – Q
А10. Скорость химической реакции, уравнение которой Mg + 2HCl = MgCl 2 + H 2 ↑, при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль/л равна:
1) 0,00004 моль/(л•с) 2) 0,0004 моль/(л•с) 3) 0,004 моль/(л•с) 4) 0,04 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) C(т) + O 2 (г) = CO 2 (г)
Б) С(т) + CO 2 (г) = 2CO(г)
В) Mg(т) + 2HCl(ж) = MgCl 2 (г) + H 2 (г)
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой C 2 H 4 (г)+H 2 (г)↔C 2 H 6 (г) + Q
А) Повышение давления
1) Сместится вправо
Б) Увеличение температуры
2) Сместится влево
В) Увеличение концентрации C 2 H 4
Г) Уменьшение концентрации C 2 H 6
Д) Применение катализатора
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Почему, если смешать твердый нитрат свинца (Pb(NO 3 ) 2 ) и йодид калия (KI), признаки реакции можно наблюдать через несколько часов, а если слить растворы этих солей, признаки реакции появятся сразу. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Вычислите, какое количество теплоты выделилось, если сгорело 25 кг угля? Термохимическое уравнение реакции: С + О 2 = СО 2 + 402,24 кДж
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №2
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Способ получения реагентов 4) Температура
А2. Фактор, не влияющий на смещение химического равновесия:
1) Давление 2) Концентрация 3) Температура 4) Природа реагирующих веществ
А3. С увеличением концентрации хлора в 2 раза скорость реакции, уравнение которой CO(г)+Cl 2 (г)=COCl 2 (г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С уменьшением давления в 3 раз скорость прямой реакции, уравнение которой N 2 (г)+O 2 (г)↔2NO(г), уменьшится в:
1) 3 раза 2) 9 раз 3) 27 раз 4) 81 раз
А5. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент равен 2) надо повысить температуру на :
1) 30 °С 2) 40 °С 3) 50 °С 4) 60 °С
А6. С увеличением концентрации SO 2 равновесие обратимой реакции, уравнение которой 2SO 2(г) +O 2(г) ↔2SO 3(г) + Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции N 2 (г)+3H 2 (г)↔2NH 3 (г)+Q в сторону продуктов реакции необходимо :
1) Увеличить концентрацию NH 3 2) Повысить температуру 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) С 2 H 5 OH(ж) + О 2 2) С 2 H 5 OH(г) + О 2 3) N 2 + O 2 4) CuO + H 2 SO 4
А9. Понижение давления смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) CH 4 (г) + Н 2 O(ж) ↔ 3H 2 + СО 2) СO 2 (г) + H 2 O(ж) ↔ H 2 СO 3 (г)
3) 3Н 2 (г) + N 2 (г) ↔ 2NH 3 (г) 4) 2CO(г) + O 2 (г) ↔ 2CO 2 (г)
А10. Скорость химической реакции, уравнение которой CuO + H 2 SO 4 = CuSO 4 + H 2 O, при уменьшении концентрации кислоты за каждые 10 с на 0,03 моль/л равна:
1) 0,1 моль/(л•с) 2) 0,001 моль/(л•с) 3) 0,002 моль/(л•с) 4) 0,003 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) СO 2 (г) + H 2 O(ж) ↔ H 2 СO 3 (г)
Б) 2CO(г) + O 2 (г) ↔ 2CO 2 (г)
В) CH 4 (г) + Н 2 O(ж) ↔ 3H 2 + СО
4)
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой 4HCl(г)+O 2 (г)↔2H 2 O(г) +2Cl 2 (г) + Q
А) Повышение температуры
1) Сместится вправо
Б) Увеличения давления
2) Сместится влево
В) Увеличение концентрации О 2
Г) Уменьшение концентрации HCl
Д) Применение катализатора
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Приведите примеры химических реакций, иллюстрирующих влияние катализатора на направление химического процесса: а) для неорганических веществ; б) для органических соединений. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Используя термохимическое уравнение: 2Н 2 + О 2 = 2Н 2 О + 484 кДж, определите массу образовавшейся воды, если в ходе реакции выделилось 520 кДж теплоты.
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №3
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Концентрация 4) Форма сосуда, в котором протекает реакция
А2. Фактор, влияющий на смещение химического равновесия:
1) Катализатор 2) Концентрация 3) Тип связи 4) Природа реагирующих веществ
А3. С увеличением концентрации кислорода в 2 раза скорость реакции, уравнение которой СH 4 (г)+2O 2 (г)=CO 2 (г) + 2H 2 O(г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С увеличением давления в 4 раз скорость прямой реакции, уравнение которой 2СО(г)+O 2 (г)↔2СO 2 (г), увеличится в:
1) 4 раза 2) 16 раз 3) 64 раза 4) 128 раз
А5. При повышении температуры на 20 °С (температурный коэффициент равен 3) скорость химической реакции увеличится в :
1) 3 раза 2) 9 раз 3) 27 раз 4) 81 раз
А6. С увеличением температуры равновесие обратимой реакции, уравнение которой СO 2(г) +С (г) ↔2СO (г) – Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции 2NО(г)+О 2 (г)↔2NО 2 (г)+Q в сторону исходных веществ необходимо :
1) Увеличить концентрацию NО 2 2) Понизить температуру 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) BaCl 2 (т) + H 2 SO 4 2) BaCl 2 (р-р) + H 2 SO 4 3) BaO + H 2 SO 4 4) CaCO 3 + H 2 SO 4
А9. Понижение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2NO(г) + O 2 (г) ↔ 2NO 2 (г) + Q 2) С 2 H 6 (г) ↔ 2C(т) + 3H 2 (г) –Q
3) 2HBr(г) ↔ H 2 (г) + Br 2 (ж) – Q 4) 2HI(г) ↔ H 2 (г) + I 2 (т)
А10. Скорость химической реакции, уравнение которой CaCO 3 + 2HCl = CaCl 2 + CO 2 + H 2 O, при уменьшении концентрации кислоты за каждые 20 с на 0,05 моль/л равна:
1) 2,5 моль/(л•с) 2) 0,25 моль/(л•с) 3) 0,025 моль/(л•с) 4) 0,0025 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) S(т) + O 2 (г) ↔ SO 2 (г)
Б) 2HBr(г) ↔ H 2 (г) + Br 2 (ж)
В) N 2 (г) + O 2 (г) ↔ 2NO(г)
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой 2CO(г)+O 2 (г)↔2CO 2 (г) + Q
А) Увеличения давления
1) Сместится вправо
Б) Увеличение концентрации О 2
2) Сместится влево
В) Повышение температуры
Г) Применение катализатора
Д) Увеличение концентрации CO 2
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Почему реакция между кислотой и гладкой гранулой цинка идет медленнее, чем с этой же кислотой и шероховатой гранулой. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Какое количество теплоты выделится при сжигании 25г водорода, взятого при нормальных условиях? Термохимическое уравнение реакции: 2Н 2 + О 2 = 2Н 2 О + 484 кДж
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №4
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Размер пробирки 2) Катализатор 3) Концентрация 4) Природа реагирующих веществ
А2. Фактор, не влияющий на смещение химического равновесия:
1) Катализатор 2) Концентрация 3) Давление 4) Температура
А3. С увеличением концентрации оксида углерода (II) в 2 раза скорость реакции, уравнение которой 2СО(г)+O 2 (г)=2CO 2 (г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С уменьшением давления в 2 раз скорость прямой реакции, уравнение которой N 2 (г)+3H 2 (г)↔2NH 3 (г), уменьшится в:
1) 2 раза 2) 8 раз 3) 16 раз 4) 32 раза
А5. Для увеличения скорости химической реакции в 27 раза (температурный коэффициент равен 3) надо повысить температуру на :
1) 30 °С 2) 40 °С 3) 50 °С 4) 60 °С
А6. С увеличением давления равновесие обратимой реакции, уравнение которой СO (г) +2Н 2(г) ↔2СН 3 ОН (г) + Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции в сторону продуктов реакции необходимо СH 3 COOH(ж)+C 2 H 5 OH(ж)↔CH 3 COOC 2 H 5 (ж) + H 2 O(ж)
1) Увеличить концентрацию C 2 H 5 OH 2) Увеличить концентрацию H 2 O 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) H 2 (г) + О 2 (г) 2) S(т) + О 2 (г) 3) N 2 (г) + O 2 (г) 4) С 5 Н 12 (г) + О 2 (г)
А9. Повышение давления смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2NO 2 (г) ↔ N 2 O 4 (г) 2) N 2 (г) + O 2 (г) ↔ 2NO(г)
3) CaCO 3 (т) ↔ CaO(т) + CO 2 (г) 4) СН 4 (г) ↔ С(т) + 2Н 2 (г)
А10. Скорость химической реакции, уравнение которой Zn + 2HCl = ZnCl 2 + H 2 , при уменьшении концентрации кислоты за каждые 30с на 0,06 моль/л равна:
1) 0,001 моль/(л•с) 2) 0,002 моль/(л•с) 3) 0,004 моль/(л•с) 4) 0,02 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) CaO(т) + CO 2 (г) = CaCO 3 (т)
Б) Н 2 (г) + Сl 2 (г) ↔ 2HCl(г)
В) СO(г)+2Н 2 (г)↔2СН 3 ОН(г)
3)
Видео:Смещение химического равновесия. Принцип Ле Шателье.Скачать

Задания 24. Химическое равновесие. Смещение равновесия под действием различных факторов.
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||||||||
| ВЗАИМОДЕЙСТВИЕ РАСТВОРОВ | ТИП РЕАКЦИИ | ||||||||||||||||||||||||
| ВЗАИМОДЕЙСТВИЕ | ТИП РЕАКЦИИ | ||||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||||
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ | ||
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
















