Видео:Тема 7 Моделирование равновесного восстановления металлов из оксидовСкачать

Химические свойства основных оксидов
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:
Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO
Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
CuO + CO = Cu + CO2
4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O
4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
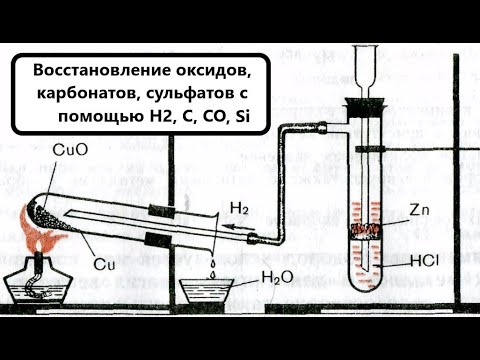
Получение металлов из оксидов с помощью восстановителей: водорода, алюминия, оксида углерода (II). Роль металлов и сплавов в современной технике
Для получения металлов из оксидов используются различные восстановители. Использование водорода позволяет получать активные металлы, не восстанавливаемые оксидом углерода (II). Также этот способ применяется для получения металлов с низким содержанием примесей, например, для химической лаборатории. Стоимость этого способа довольно высока. В качестве примера можно привести реакцию восстановления меди из оксида меди (II) при нагревании в струе водорода:
С указанием степени окисления элементов:
Cu +2 O + H2 0 = Cu 0 + H2 +1 O
Хотя реакция обратимая, но проведение ее в токе водорода, и, как следствие, удаление паров воды из зоны реакции позволяет сместить равновесие вправо и добиться полного восстановления меди.
Железо, поступающее в школьную лабораторию, часто на этикетке имеет надпись: «Восстановлено водородом»:
Способ восстановления металлов алюминием получил название «алюминотермия» или «алюмотермия». Алюминий является еще более активным восстановителем. Этим способом получают хром, марганец:
При реакции оксида железа (III) с порошком алюминия (смесь необходимо поджечь магниевой лентой) выделяется много тепла:
Алюминотермией получают некоторое количество кальция. Обратите внимание, что в электрохимическом ряду напряжений кальций находится левее алюминия, но это не делает невозможным данный способ — не следует забывать, что ряд напряжений говорит о возможности или невозможности протекания реакций только в растворах.
Оксид углерода (II) применяется наиболее широко. Например, при выплавке чугуна в доменной печи восстановителями являются кокс и образующийся оксид углерода(II). Суммарное уравнение получения железа из красного железняка:
Чистые металлы в современной технике используются сравнительно редко. Чистые медь и алюминий применяются для изготовления электрических проводов. Цинк, никель, хром, золото наносятся на поверхность стальных изделий для защиты от коррозии и придания красивого внешнего вида.
Сплавы обладают более высокой прочностью. Легкие сплавы на основе алюминия, например, дуралюмины (содержат медь и магний) — особенно широко применяются в изготовлении летательных аппаратов, автомобилей, скоростных судов.
Сплавы на основе железа — чугун и сталь — основные конструкционные материалы современной техники. Чугун, благодаря более низкой стоимости, устойчивости к коррозии, хорошим литейным качествам широко применяется для изготовления станков, печных плит, декоративных садовых решеток и пр.
Сталь хорошо обрабатывается и обладает высокой прочностью. Добавление в сталь легирующих добавок позволяет придавать ей особые свойства: высокую твердость, устойчивость к коррозии (нержавеющие стали), кислотам (кислотоупорные), высоким температурам (жаропрочные) и т. д.
Сплавы на основе меди — латуни и бронзы — обладают хорошей теплопроводностью, устойчивостью к коррозии (в том числе в морской воде), красивым внешним видом. Применяются для изготовления радиаторов, в судостроении, для декоративных целей.
Сплавы олова и свинца — припо́и — обладают более низкой температурой плавления, чем олово и свинец в отдельности. Используются при пайке.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

ВОССТАНОВЛЕ́НИЕ МЕТА́ЛЛОВ
В книжной версии
Том 5. Москва, 2006, стр. 746
Скопировать библиографическую ссылку:
ВОССТАНОВЛЕ́НИЕ МЕТА́ЛЛОВ, процесс получения металлов из руд и/или промежуточных продуктов металлургич. произ-ва с помощью реакций восстановления. В общем случае сводится к присоединению электронов к ионам металлов: $ce <Me^+ ne = Me>$ , где $ce$ – металл, $ce$ – электрон, $ce<Me^>$ – ион металла, $ce$ – количество электронов. Применяется на разных этапах металлургич. произ-ва: при обжиге, плавке, электролизе, цементации, рафинировании и др. В. м. осуществляется: в результате реакций с посторонним восстановителем, при воздействии электрич. тока, разложением (чаще всего термическим) неустойчивых соединений до исходного металла; проводится на воздухе (напр., доменный процесс), в растворе или расплаве (электролиз), в вакууме (рафинирование), инертной атмосфере (металлотермия) и плазме (плазменная плавка).
🎦 Видео
Коррозия металла. Химия – ПростоСкачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Получение металлов. 9 класс.Скачать

Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Практическое занятие 7 Моделирование равновесного восстановления металлов из оксидовСкачать

Оксиды. Химические свойства. 8 класс.Скачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Проклятая химическая реакция 😜 #shortsСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

способы получения металловСкачать

Химия 9 класс (Урок№23 - Щелочные металлы. Физические и химические свойства. Оксиды и гидроксиды.)Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать











