Термодинамика — наука об энергии и ее свойствах — представляет собой важнейшую отрасль естествознания. Основой термодинамики служат два экспериментально установленных закона, называемых иначе первым и вторым началом термодинамики. Термодинамика как самостоятельная наука получила развитие, когда были открыты эти два закона. Первый из них рассматривается как приложение к тепловым явлениям всеобщего закона сохранения и превращения энергии, а второй характеризует направление протекающих в окружающей нас природе процессов.
В технической термодинамике рассматривают частный случай общего закона сохранения и превращения энергии, устанавливающий эквивалентность между теплотой и механической работой. По этому закону теплота может превращаться в механическую работу или, наоборот, работа в теплоту в строго эквивалентных количествах. Это означает, что из данного количества теплоты в случае ее полного превращения в работу получается строго определенное и всегда одно и то же количество ра-
боты, точно так же, как и из данного количества работы при ее полном превращении в тепло получается строго определенное и всегда одно и то же количество теплоты.
Поскольку в системе СИ теплота и работа выражаются в одних и тех же единицах, приведенное выше положение может быть записано следующим образом:

где Q — тепло; L — полученная в результате его использования работа.
Первый закон термодинамики устанавливает взаимозависимость между количеством сообщенного рабочему телу или отведенного от него тепла, величиной изменения его внутренней энергии и совершенной рабочим телом работы изменения объема.
Из первого закона термодинамики следует, что полная энергия термодинамической системы в конце любого термодинамического процесса равна алгебраической сумме энергий ее в начале процесса и количества энергий, подведенных к системе и отведенных от нее в ходе процесса. Применительно к рассматриваемым в технической термодинамике процессам энергия к рабочему телу подводится или отводится от него лишь в форме тепла или механической работы. Поэтому

Применительно к 1 кг рабочего тела уравнение (32) принимает вид
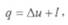
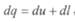
Выражения (32), (32′), (32″) представляют собой общее уравнение первого закона термодинамики и означают, что в общем случае все подводимое к термодинамической системе тепло расходуется на изменение ее внутренней энергии и на работу изменения объема системы.

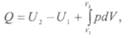
Второй закон термодинамики представляет собой обобщение изложенных выше положений и заключается в том, что: 1) самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой; 2) самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении от более высокого потенциала к более низкому; 3) ход самопроизвольно протекающих процессов происходит в направлении, приводящем к установлению равновесия термодинамической системы с окружающей средой, и по достижении этого равновесия процессы прекращаются; 4) процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Формулировки второго закона термодинамики, данные различными учеными, вылились в форму постулатов, полученных в результате развития положений, высказанных французским ученым Сади Карно.
В частности, постулат немецкого ученого Клаузиуса состоит в том, что теплота не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой.

Рис. 18. Цикл Карно.
Выбор для цикла Карно двух изотерм и двух адиабат вполне обоснован, ибо процессы подвода и отвода теплоты в цикле могут осуществляться только по изотермам, так как изотермический процесс — это единственный обратимый процесс, который может находиться под воздействием одного источника теплоты.
Очевидно, работа в цикле Карно Ац в pv-диаграмме измеряется площадью 1-2-3-4, ограниченной двумя изотермами 1-2 и 3-4 и двумя адиабатами 2-3 и 4-1, а полезная теплота qw в Ts-диаграмме измеряется площадью прямоугольника 1-2-3-4.

Водяной пар чрезвычайно широко применяется в различных отраслях промышленности главным образом в качестве теплоносителя в теплообменных аппаратах и как рабочее тело в паросиловых установках. Это
объясняется повсеместным распространением воды, ее дешевизной и безвредностью для здоровья человека.
Имея высокое давление и относительно низкую температуру, пар, используемый в тепловых агрегатах, близок к состоянию жидкости, поэтому пренебрегать силами сцепления между его молекулами и их объемом, как в идеальных газах, нельзя. Следовательно, не представляется возможным использовать для определения параметров состояния водяного пара уравнения состояния идеальных газов, т. е. для napapv Ф RT, ибо водяной пар является реальным газом.

Являясь приближенным при количественных расчетах, уравнение Ван-дер-Ваальса качественно хорошо отображает физические особенности газов, так как позволяет описать общую картину изменения состояния вещества с переходом его в отдельные фазовые состояния. В этом уравнении а и b для данного газа являются постоянными величинами, учитывающими: первая — силы взаимодействия, а вторая — размер молекул.
Учеными М. П. Вукаловичем и И. И. Новиковым в 1939 году было получено уравнение для реальных газов с учетом ассоциации и диссоциации их молекул.
Это уравнение можно применять к любому реальному газу, и в частности к перегретому водяному пару. Но в связи с тем, что практически это сложное уравнение использовать трудно, с его помощью были вычислены основные физические величины перегретого водяного пара при различных р и Т, составлены таблицы и построена диаграмма в is-координатах, на основании которых и проводятся расчеты процессов изменения состояния водяного пара.
Пары бывают насыщенные и перегретые. Насыщенные пары разделяются на сухие насыщенные (или просто сухие) и влажные насыщенные (или просто влажные).
Испарением называется парообразование, происходящее только с поверхности жидкости и при любой температуре. Процесс, обратный парообразованию, называется конденсацией. Этот процесс превращения пара в жидкость также происходит при постоянной температуре, если давление остается постоянным. Жидкость, образующаяся при конденсации пара, называется конденсатом.
При испарении жидкости в ограниченное пространство (а это бывает в паровых котлах) одновременно происходит и обратное явление -конденсация пара, обусловленная тем, что некоторые из молекул пара, движущиеся в паровом пространстве по всем направлениям, ударяясь о поверхность жидкости, попадают в сферу влияния ее молекул и остаются в ней. Если скорость конденсации станет равной скорости испарения, то в системе наступает динамическое равновесие. Пар в этом состоянии имеет максимальную плотность и называется насыщенным. Следовательно, под насыщенным понимают пар, находящийся в равновесном состоянии с жидкостью, из которой он образуется. Основное свойство этого пара состоит в том, что он имеет температуру, являющуюся функцией его давления, одинакового с давлением той среды, в которой происходит кипение.
Если объем пара уменьшается, то часть пара переходит в жидкость (конденсация больше испарения). Но в обоих случаях давление пара остается постоянным. Пар образуется до тех пор, пока не испарится последняя капля жидкости.
Видео:Работа с диаграммой воды и водяного параСкачать

Теплофизические свойства воды и водяного пара
Автор: С.Л. Ривкин. .
Тип документа: Справочник .
Год издания: 1980 .
Введение
Часть первая. ИСХОДНЫЕ МАТЕРИАЛЫ ДЛЯ СОСТАВЛЕНИЯ ТАБЛИЦ ТЕПЛОФИЗИЧЕСКИХ СВОЙСТВ ВОДЫ И ВОДЯНОГО ПАРА
Раздел первый. Термодинамические свойства
1-1. Международная система уравнений для точного описания термодинамических свойств воды и водяного пара
1-2. Описание таблиц термодинамических
свойств воды и водяного пара
Раздел второй. Коэффициенты переноса, число Прандтля и поверхностное натяжение
2-1. Динамическая вязкость воды н водяного пара
2-2. Теплопроводность воды и водяного пара
2-3. Число Прандтля для воды и водяного пара
2-4. Поверхностное натяжение воды
Раздел третий. Единицы величин, входящих в таблицы. Соотношения между единицами теплофизических величин
3-1. Единицы величин, входящих в таблицы
3-2. Соотношения между единицами тепло-физических величин
Список литературы
Часть вторая. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА (таблицы в Международной системе единиц)
Таблица II-I. Термодинамические свойства воды и водяного пара в состоянии насыщения (по температурам)
Таблица II-II. Термодинамические ‘ свойства воды и водяного пара в состоянии насыщения (по давлениям)
Таблица II-III. Термодинамические свойства воды и перегретого пара
Таблица II-IV. Истинная изобарная теплоемкость воды и водяного пара
Таблица II-IV. Динамическая вязкость воды и водяного пара
Таблица II-VI. Теплопроводность воды н водяного пара
Таблица II-VII. Число Прандтля для воды и водяного пара
Таблица II-VIII. Поверхностное натяжение воды, изобарная теплоемкость, теплопроводность, динамическая вязкость, число Прандтля воды и водяного пара в состоянии насыщения
Часть третья. ТЕПЛОФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА (таблицы, составленные с применением килокалории в качестве единицы теплоты)
Таблица Термодинамические свойства воды и водяного пара в состоянии насыщения (по температурам)
Таблица III-II. Термодинамические свойства воды и водяного пара в состоянии насыщения (по давлениям)
Таблица III-II. Термодинамические свойства воды и перегретого пара
Таблица III-IV. Истинная изобарная теплоемкость воды- и водяного пара
Таблица III-V. Динамическая вязкость воды и водяного пара
Таблица III-VI. Теплопроводность воды и водяного пара
Таблица III-VII. Число Прандтля для воды и водяного пара
Таблица III-VIII. Поверхностное натяжение воды, изобарная теплоемкость, теплопроводность, динамическая вязкость, число Прандтля воды и водяного пара в состоянии насыщения
Приложение 1. Международные скелетные таблицы (1963)
П-1-1. Термодинамические свойства воды и водяного пара на линии насыщения
П-1-2. Удельный объем воды и перегретого водяного пара, см3/г
П-1-3. Удельная энтальпия воды и перегретого водяного пара, Дж/г
Приложение 2. Международная таблица усредненных экспериментальных значений динамической вязкости, мкПа-с, воды и водяного пара (1975)
Приложение 3. Международные таблицы усредненных экспериментальных значений теплопроводности, мВт/(м-К), (1977)
П-3-1. ВоДа и водяной пар в состоянии насыщения
П-3-2. Вода и водяной пар
Приложение 4. Международная таблица усредненных экспериментальных значений поверхностного натяжения воды, Н/м, (1976)
Приложение 5. Изобарная теплоемкость, ккал/(кг-°С), воды при параметрах, близких к критическим.
Видео:Термодинамические процессы водяного параСкачать

Уравнения термодинамических свойств воды и водяного пара
Вода — однородное химическое соединение, молекула которой состоит из трех атомов, принадлежащих двум химическим элементам — водороду и кислороду. Вода является прекрасным растворителем, поэтому все природные воды представляют собой растворы, содержащие разнообразные вещества — соли, газы.
Вода и водяной пар как рабочее тело и теплоноситель получили наибольшее применение в промышленности. Это объясняется широким распространением воды в природе, а также тем, что вода и водяной пар обладают относительно хорошими термодинамическими характеристиками.
Так, теплоемкость воды выше теплоемкости многих других жидкостей и твердых тел и в пределах от 0 до 100 °С при атмосферном давлении она равна 4,19 кДж/(кг- К), или 4,19 кДж/(кг °С). Теплопроводность воды Вт/(м-К), в отличие от теплопроводности других жидких и твердых тел с повышением температуры до 120. 140°С увеличивается, а при дальнейшем повышении температуры — уменьшается. Плотность воды изменяется с температурой. Наибольшей плотностью вода обладает при 4 °С.
Процесс перехода воды из жидкого состояния в газообразное (пар) называется испарением, а из газообразного в жидкое — конденсацией. Превращение воды в пар может протекать как при испарении, так и при кипении. Испарение — это процесс образования пара, происходящий с поверхности жидкости при любой температуре. При испарении молекулы воды отрываются от поверхности жидкости, имея относительно большие скорости. Вследствие этого средняя скорость движения молекул в массе воды уменьшается и температура жидкости понижается.
При подводе теплоты в процессе нагревания температура жидкости и интенсивность ее испарения увеличиваются, и при определенных температуре и давлении жидкость закипает.
Кипение — это процесс интенсивного парообразования во всей массе жидкости, который получает развитие при ее нагревании, т.е. подводе к системе определенного количества теплоты. При атмосферном давлении температура кипения составляет приблизительно 100 °С. С повышением давления температура кипения возрастает и, наоборот, в условиях пониженного давления (высоко в горах) температура кипения снижается.
Количество теплоты, которое необходимо сообщить воде для превращения ее из жидкого состояния в парообразное при температуре кипения, называется скрытой теплотой парообразования г. С повышением давления скрытая теплота парообразования уменьшается (табл. 1.1).
Ранее было отмечено, что конденсация — это процесс превращения пара в жидкость, называемую конденсатом.
Таблица 1.1 Свойства воды и сухого насыщенного пара
📺 Видео
Урок 187. Испарение и конденсация. Насыщенный пар и его свойстваСкачать

Насыщенный пар. Зависимость давления пара от температуры | Физика 10 класс #35 | ИнфоурокСкачать

Основы теплотехники. Термодинамические процессы. Изохорный, изобарный, изотермический, адиабатный.Скачать

Пар водяной. Насыщенный и перегретый пар. Обучение персонала. Часть 1Скачать

Основы теплотехники. Реальные газы. Уравнение Ван дер Ваальса. Решение задач.Скачать

Насыщенный и ненасыщенный пар. Влажность воздуха. 10 класс.Скачать

12. Основы теплотехники. Паросиловые установки. Цикл Ренкина. Диаграмма водяного пара.Скачать

Олимпиадная физика 2023 | Водяной пар, влажность - с ЛЕГКИМ паром!Скачать

ОЛИМПИАДНАЯ ФИЗИКА Водяной пар Влажный воздухСкачать

Урок 189. Влажность воздуха. Абсолютная и относительная влажностьСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Урок 172. Применение 1 закона термодинамики для различных процессовСкачать

Урок 170. Количество теплоты. Первый закон термодинамикиСкачать

ФИЗИКА ЗА 5 МИНУТ - ТЕРМОДИНАМИКАСкачать

Термодинамика Объяснение критической точкиСкачать

Основные уравнения движенияСкачать

Физика 8 класс (Урок№8 - Испарение и конденсация. Насыщенный пар. Кипение.)Скачать

Давление водяных паровСкачать

