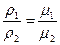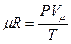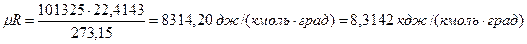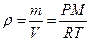Идеальным газом называется такой газ, у которого отсутствуют силы взаимного притяжения и отталкивания между молекулами и пренебрегают размерами молекул. Все реальные газы при высоких температурах и малых давлениях можно практически считать как идеальные газы.
Уравнение состояния как для идеальных, как и для реальных газов описываются тремя параметрами по уравнению (1.7).
Уравнение состояния идеального газа можно вывести из молекулярно-кинетической теории или из совместного рассмотрения законов Бойля-Мариотта и Гей-Люссака.
Это уравнение было выведено в 1834 г. французким физиком Клапейроном и для 1 кг массы газа имеет вид:
где: R — газовая постоянная и представляет работу 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Уравнение (2.7) называют термическим уравнением состояния или характеристическим уравнением.
Для произвольного количества газа массой m уравнение состояния будет:
В 1874 г. Д.И.Менделеев основываясь на законе Дальтона («В равных объемах разных идеальных газов, находящихся при одинаковых температурах и давлениях, содержится одинаковое количество молекул») предложил универсальное уравнение состояния для 1 кг газа, которую называют уравнением Клапейрона-Менделеева:
где: μ — молярная (молекулярная) масса газа, (кг/кмоль);
Rμ = 8314,20 Дж/кмоль (8,3142 кДж/кмоль) — универсальная газовая постоянная и представляет работу 1 кмоль идеального газа в процессе при постоянном давлении и при изменении температуры на 1 градус.
Зная Rμ можно найти газовую постоянную R = Rμ/μ.
Для произвольной массы газа уравнение Клапейрона-Менделеева будет иметь вид:
Смесь идеальных газов.
Газовой смесью понимается смесь отдельных газов, вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же оюъеме и при той же температуре, что и в смеси.
Газовая смесь подчиняется закону Дальтона:
║Общее давление смеси газов равно сумме парциальных давлений ║отдельных газов, составляющих смесь.
где Р1 , Р2 , Р3 . . . Рn – парциальные давления.
Состав смеси задается объемными, массовыми и мольными долями, которые определяются соответственно по следующим формулам:
где V1 ; V2 ; … Vn ; Vсм –объемы компонентов и смеси;
m1 ; m2 ; … mn ; mсм – массы компонентов и смеси;
ν1 ; ν2 ; … νn ; νсм – количество вещества (киломолей)
компонентов и смеси.
Для идеального газа по закону Дальтона:
Связь между объемными и массовыми долями следующее:
где: μ1 , μ2 , … μn , μсм – молекулярные массы компонентов и смеси.
Молекулярная масса смеси:
Газовая постоянная смеси:
Удельные массовые теплоемкости смеси:
Удельные молярные (молекулярные) теплоемкости смеси:
Тема 3. Второй закон термодинамики.
Основные положения второго закона термодинамики.
Первый закон термодинамики утверждает, что теплота может превращаться в работу, а работа в теплоту и не устанавливает условий, при которых возможны эти превращения.
Превращение работы в теплоту происходит всегда полностью и безусловно. Обратный процесс превращения теплоты в работу при непрерывном её переходе возможен только при определенных условиях и не полностью. Теплота сам собой может переходит от более нагретых тел к холодным. Переход теплоты от холодных тел к нагретым сам собой не происходит. Для этого нужно затратить дополнительную энергию.
Таким образом для полного анализа явления и процессов необходимо иметь кроме первого закона термодинамики еще дополнительную закономерность. Этим законом является второй закон термодинамики. Он устанавливает, возможен или невозможен тот или иной процесс, в каком направлении протекает процесс, когда достигается термодинамическое равновесие и при каких условиях можно получить максимальную работу.
Формулировки второго закона термодинамики.
Для существования теплового двигателя необходимы 2 источника – горячий источник и холодный источник (окружающая среда). Если тепловой двигатель работает только от одного источника то он называется вечным двигателем 2-го рода.
1 формулировка (Оствальда):
| «Вечный двигатель 2-го рода невозможен».
Вечный двигатель 1-го рода это тепловой двигатель, у которого L>Q1, где Q1 — подведенная теплота. Первый закон термодинамики «позволяет» возможность создать тепловой двигатель полностью превращающий подведенную теплоту Q1в работу L, т.е. L = Q1. Второй закон накладывает более жесткие ограничения и утверждает, что работа должна быть меньше подведенной теплоты (L 0), то системе подводится тепло.
Если энтропия системы уменьшается (Ds ht . (3.10)
Тема 4. Термодинамические процессы.
Видео:Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Уравнения состояния реальных газов
Вопрос №1
Идеальный газ. Законы идеальных газов
Идеальным называется газ, у которого объемы молекул бесконечно малы и отсутствуют силы межмолекулярного взаимодействия. Молекулы идеального газа представляют собой материальные точки, взаимодействие между которыми ограничено молекулярными соударениями.
Любой реальный газ тем ближе к идеальному, чем ниже его давление и выше температура. Например, окружающий нас воздух можно считать идеальным газом. Понятие идеального газа и законы идеальных газов полезны в качестве предела законов реального газа.
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
На практике часто приходится иметь дело с газами при невысоких давлениях, поэтому расчеты различных термодинамических процессов с достаточной степенью точности можно проводить по уравнениям идеального газа.
Закон Авогадро
Согласно этому закону, все газы при одинаковых температурах и одинаковом давлении содержат в одном и том же объеме одинаковое число молекул. Большую техническую значимость имеет следствие из закона Авогадро: объемы киломолей различных газов равны, если они находятся при одинаковых температурах и давлениях. При нормальных физических условиях (Т= 273,15 К, р = 760 мм рт. ст.) объем киломоля любого вещества равен Vµ=µν=22,4 м 3 /кмоль.Напомним, что киломолем называется количество вещества в килограммах, численно равное его молекулярной массе.
Этот закон был открыт независимо друг от друга английским физиком Р. Бойлем и французским ученым Э. Мариоттом. Ими было доказано, что при постоянной температуре газа произведение давления газа на его объем есть величина постоянная, т.е. при
рV= const и рv = const.
Закон Гей-Люссака
Этот закон устанавливает, что если в процессе нагрева или охлаждения газа давление подцерживается постоянным, то объем изменяется пропорционально абсолютной температуре, т.е. если
Р = const, то и v/ Т = const.
Если же мы рассмотрим процесс нагрева или охлаждения газа в сосуде постоянного объема (v= const), то р/Т = const.
Уравнение состояния идеального газа
Для 1 кг газа Клапейроном установлено уравнение состояния рv = RT, в котором газовая постоянная Rимеет для каждого газа свое постоянное значение. Измеряется Rв Дж/кг-К и имеет вполне определенный физический смысл — это работа, совершаемая 1 кг газа при его нагреве на один кельвин при постоянном давлении. Для газа с произвольной массой M/(кг) уравнение состояния имеет вид
Для одного киломоля вещества уравнение состояния (получено Д.И. Менделеевым) имеет вид рVµ =µRT, где µR— универсальная газовая постоянная, которая одинакова для всех газов и равна 8314 Дж/кмольК.
Во всех этих уравнениях давление подставляется в Па, температура — в К, объем — в м 3 и удельный объем — в м 3 /кг.
В резервуаре объемом 10 м 3 находится азот при избыточном давлении 100 кПа и при температуре 27 °С. Атмосферное давление равно 750 мм рт. ст. Требуется найти массу и плотность азота.
Выразим атмосферное давление в паскалях: рб = 10 5 Па.
Абсолютное давление газа равно:p =ри +рб = 100 • 10 3 + 10 5 = = 2 • 10 5 Па.
Газовая постоянная азота равна (µ = 28 кг/кмоль)
R = 8314/28 = 297 Дж/кгЧК. Масса газа равна
М =рV/RT= 2*10 5* 10/297 • (273,15 + 27) = 22,43 кг.
р = M/V= 22,43/10 = 2,243 кг/м 3 .
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
РЕАЛЬНЫЕ ГАЗЫ
Свойства реальных газов
Свойства реальных газов значительно отличаются от свойств идеальных газов, причем отличия тем значительнее, чем выше давление и ниже температура газа. Это объясняется тем, что молекулы реальных газов имеют конечный объем и между ними существуют силы межмолекулярного взаимодействия. Уравнение состояния 1 кг реального газа имеет вид
где z= φ(р, T) — коэффициент сжимаемости, который может быть как больше, так и меньше единицы.
При проведении термодинамических расчетов с реальными газами нужно учитывать зависимость внутренней энергии, энтальпии и теплоемкости не только от температуры, но и от давления газа. При одном и том же давлении какое-либо вещество в зависимости от температуры может находиться в разных состояниях.
Из физики известно, что любое вещество может находиться в твердом, жидком или газообразном состоянии. Эти состояния будем называть фазами, а процесс перехода из одного состояния в другое — фазовым переходом.
При определенных условиях могут существовать одновременно две фазы вещества, например, лед и жидкость, пар и жидкость. Если пар и жидкость находятся в состоянии равновесия, то пар называется насыщенным.
У всех веществ фазовые переходы происходят при определенных физических параметрах, поэтому рассмотрение свойств реальных газов можно начать на примере вещества, которое является основным рабочим телом в циклах тепловых электростанций, в том числе и атомных. Этим рабочим телом является вода, и не только потому, что она относительно дешева и нетоксична, а потому, что она обладает благоприятными для работы термодинамическими свойствами.
Рассмотрим диаграмму «v—p» воды и водяного пара, на которой изобразим границы между фазами (рис. 1.1). В области а находится в равновесии смесь льда и некипящей воды, в области Ь находится некипящая вода, в области с находится смесь кипящей воды и водяного пара, в области d— перегретый водяной пар. Прямой 1-2 показан изобарный процесс подвода теплоты.
Показанные на рис. 1.1 кривые называются пограничными; кривые, ограничивающие с двух сторон область с, называются левой и правой пограничными кривыми. Им соответствуют кипящая вода (левой) и сухой насыщенный пар (правой). Область между этими кривыми называется областью влажного насыщенного пара — в этой области находятся в равновесии сухой насыщенный пар и кипящая вода. Смесь сухого насыщенного пара и кипящей воды называют влажным насыщенным паром. Масса влажного насыщенного пара равна
где М’ — масса кипящей воды и М» — масса сухого насыщенного пара.
В дальнейшем все параметры, относящиеся к кипящей жидкости, будут иметь индекс «штрих» (р’, h’и т.д.), а все параметры, относящиеся к сухому насыщенному пару,— индекс «два штриха» (р’, h» и т.д.).
Температуру и давление насыщенного пара принято обозначать Тн и рн. В то же время в ряде литературных источников их обозначают Тs и рs (буква s является первой буквой английского слова sаturation — насыщение). Отношение массы сухого насыщенного пара к общей массе влажного насыщенного пара называется степенью сухости и обозначается х. Ясно, что на левой пограничной кривой х = 0, а на правой — х = 1. Разность <1-х) называется степенью влажности.
Чем выше давление пара, тем меньше расстояние по горизонтали между левой и правой пограничными кривыми, а при определенном давлении пара эти кривые смыкаются. Точка, в которой исчезают различия в свойствах кипящей жидкости и сухого насыщенного пара, называется критической (точка к на рис. 1.1).
Термические параметры различных веществ в критической точке различны. Эти параметры для ряда химических веществ приведены в табл. 1
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Таблица 1 Критические параметры веществ
| Вещество | Tкр, К | pкр,МПа | ρкр, кг/м 3 |
| Азот N2 | 3,40 | ||
| Водород Н2 | 33,2 | 1,29 | |
| Водяной пар H2O | 647,12 | 22,115 | |
| Кислород О2 | 5,05 | ||
| Ртуть Нg | — | ||
| Диоксид углерода СО2 | 7,38 |
При сверхкритическом давлении не может быть влажного насыщенного пара. Если давление пара больше критического и постоянно по величине (р > ркр), то при подводе (или отводе) теплоты физические параметры (удельный объем, энтальпия и др.) меняются плавно, в то же время наблюдается резкое изменение тепло-емкостей сp исvв тех процессах, где сверхперегретая вода переходит в сверхперегретый водяной пар.
Уравнения состояния реальных газов
Известно значительное число уравнений состояния реальных газов, и одна из самых удачных попыток была сделана Ван-дер-Ваальсом, который получил уравнение в виде
Слагаемое a/v 2 учитывает внутреннее давление, обусловленное силами взаимодействия молекул газа, а величина b— уменьшение объема, в котором движутся молекулы реального газа. Если по этому уравнению находить величины удельных объемов реальных газов, то уравнение (1) имеет три действительных корня при Т Ткр . Точность вычислений по этому уравнению невелика.
В самой общей форме уравнение состояния реальных газов имеет вид
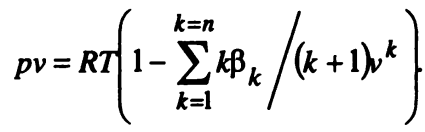
где 𝛽k — вириальные коэффициенты, зависящие от температуры газа.
Число членов ряда в уравнении (2) может быть достаточно велико, поэтому расчеты по этому уравнению вызывают значительные трудности.
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
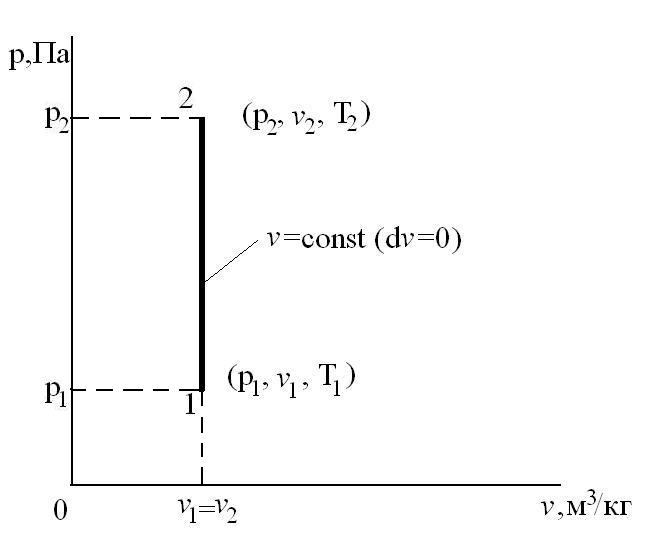
Изохорный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном объеме v=const.
Этот процесс используется как подготовительный процесс в циклах.
Соотношение между параметрами для конечного участка процесса 1-2 определяется законом Шарля: 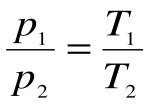
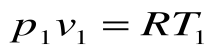
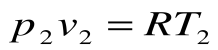
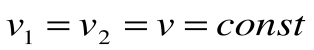
Поскольку работа расширения в этом процессе равна нулю: 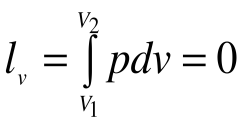
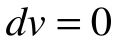
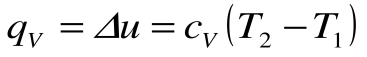
Таким образом, подведенная к газу в изохорном процессе теплота целиком идет на увеличение его внутренней энергии. Для ТП 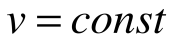
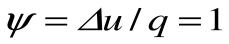

| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
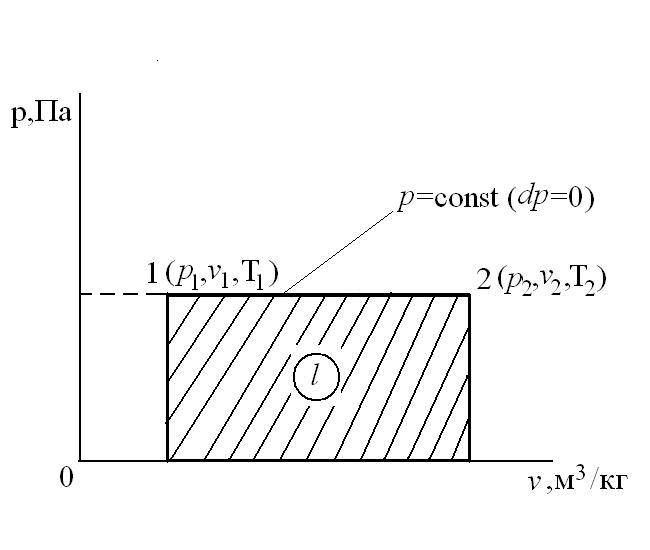
Изобарный процесс – это процесс сообщения или отнятия теплоты от газа при постоянном давлении р=const.
Соотношение между параметрами в процессе р=const: 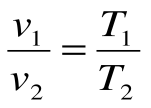


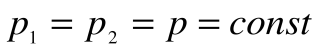
Работа расширения 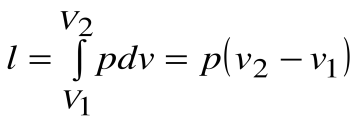
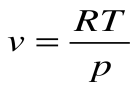
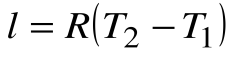
Следовательно, удельная газовая постоянная R— это работа, совершаемая 1кг газа в процессе p=const при его нагревании на один градус. Размерность R: Дж/кгК. Уравнение 1-го закона термодинамики в этом случае имеем вид:
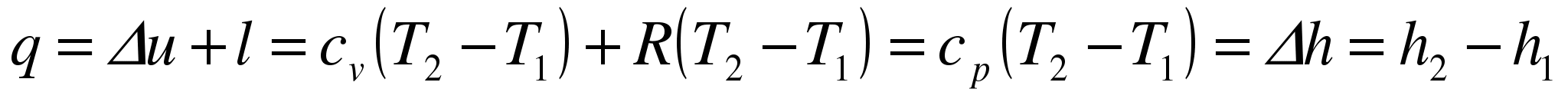
Таким образом, вся теплота, подведенная к газу в изобарном процессе, расходуется на увеличение его энтальпии.
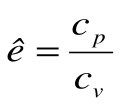
Коэффициент распределения теплоты в процессе р=const равен:
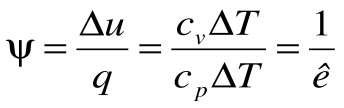
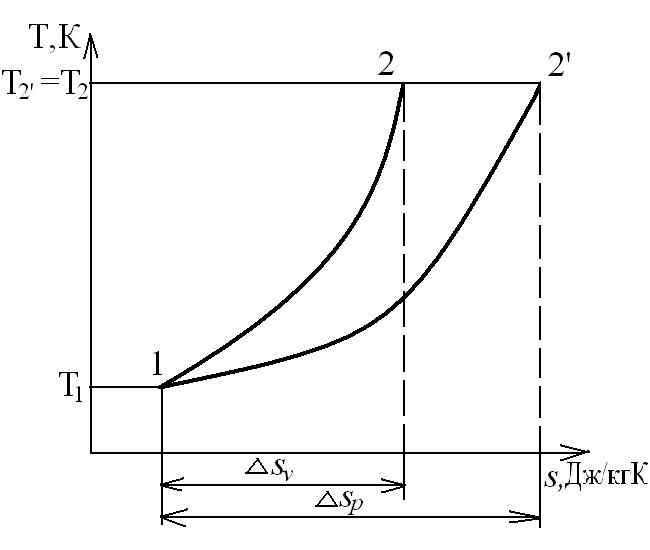
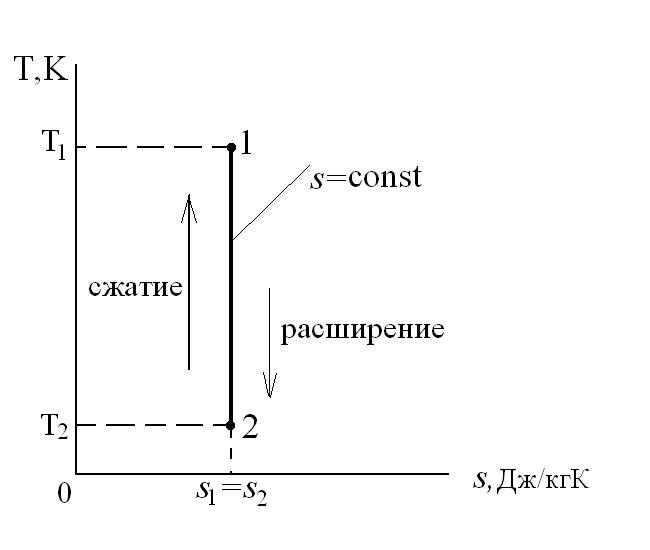
В T-s координатах взаимное положение изобары и изохоры имеет вид:
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
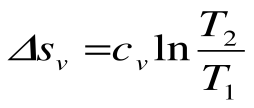
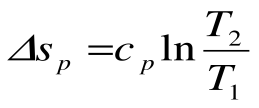
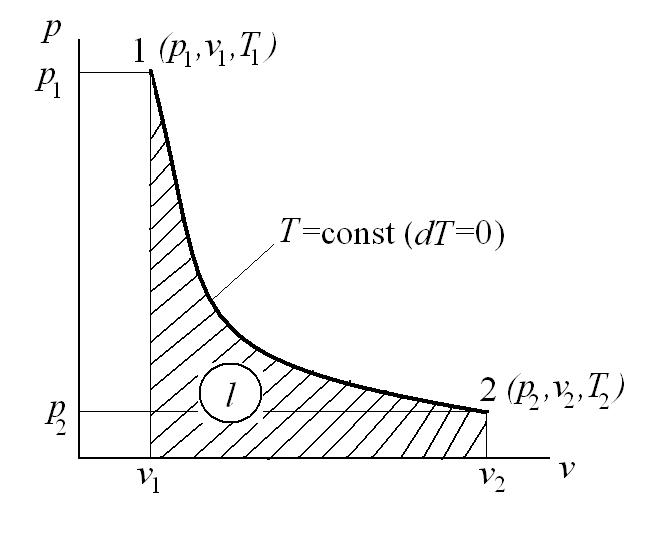
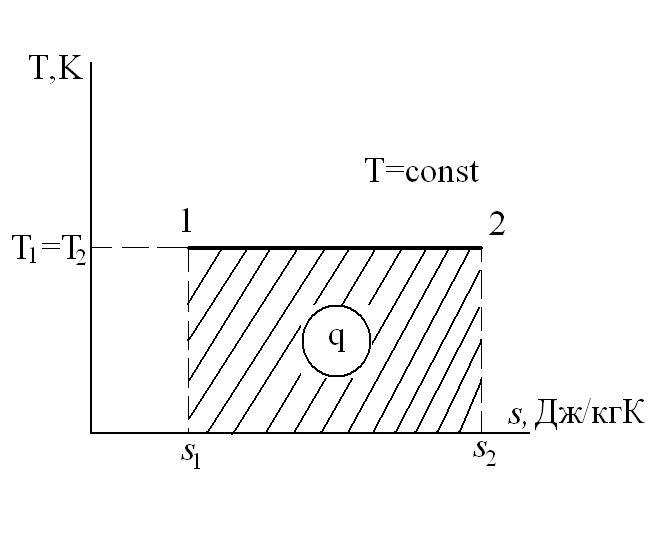
Изотермический процесс – это процесс сообщения или отнятия теплоты от газа при постоянной температуре
При Т=const из уравнения состояния 
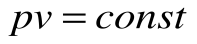
Тогда 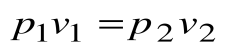
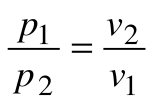
Из уравнения 1-го закона термодинамики 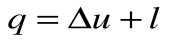
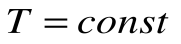
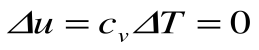
Изменение энтальпии в процессе T=const равно:
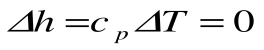
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Работа расширения 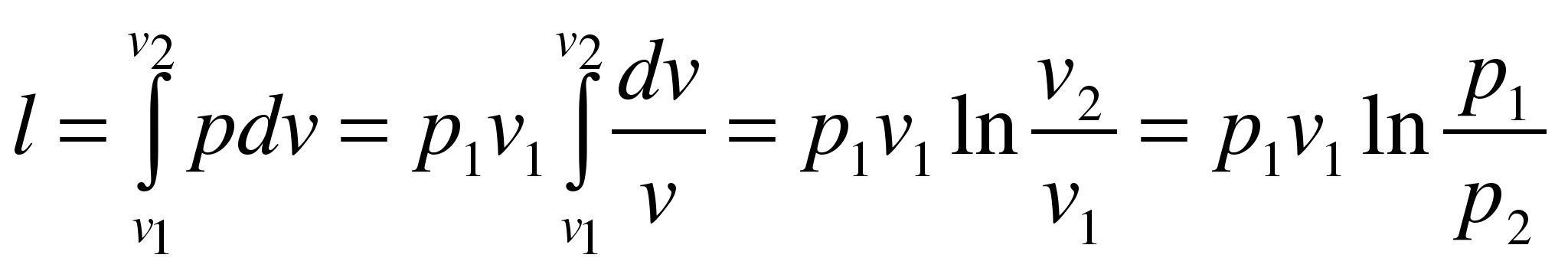
Коэффициент распределения теплоты
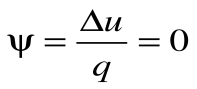
Тогда теплоемкость 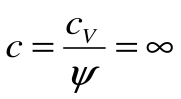
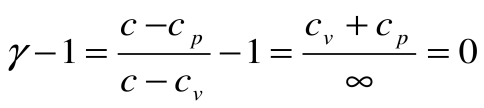
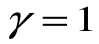
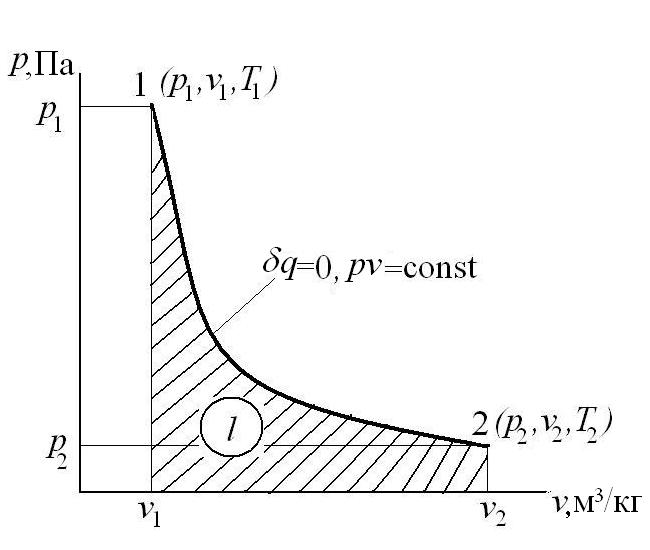
Адиабатный процесс – это процесс, протекающий без внешнего теплообмена, т.е. q=0 и 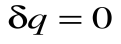
Если записать для этого случая уравнения 1-го закона термодинамики в виде:
1. 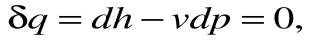
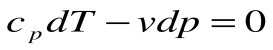
2. 
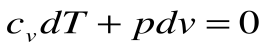

Тогда после интегрирования выражения 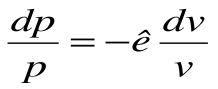

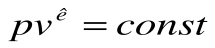
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
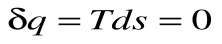
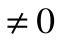
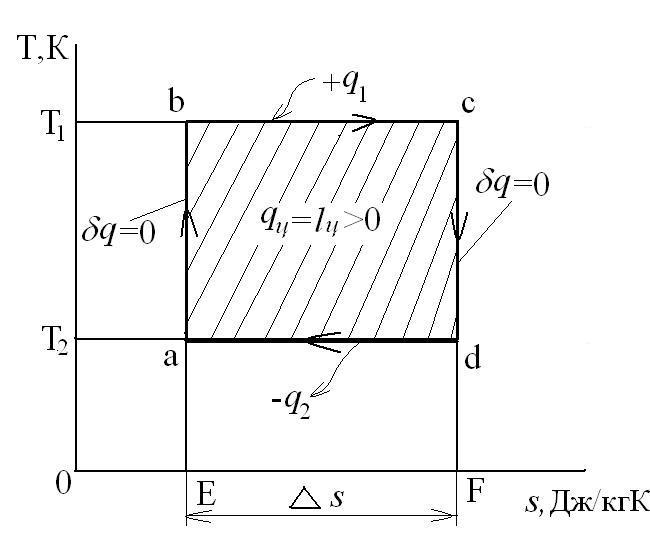
Для теплового двигателя цикл Карно – прямой цикл, состоящий из двух адиабат и двух изотерм, а для тепловых трансформаторов используется обратный цикл Карно. Тепловые машины, работающие по циклу Карно, имеют наибольшие значения термических кпд по сравнению с любым другим циклом при одинаковых предельных температурах цикла Т1 и Т2.
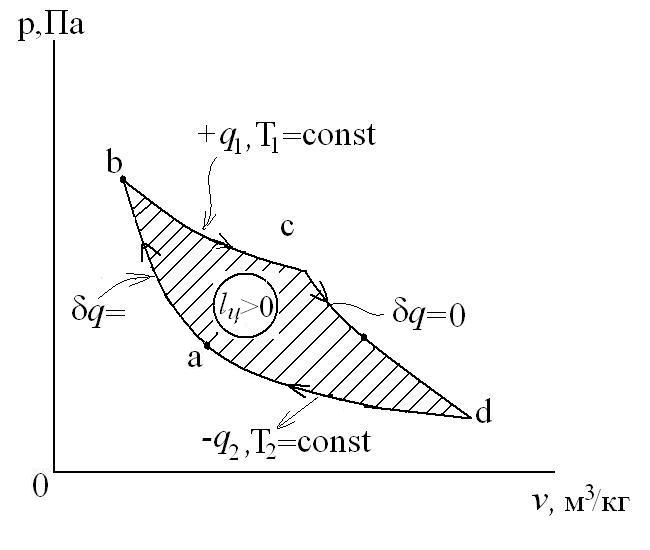
Рассмотрим прямой цикл Карно.
Графически в p-v и T-s координатах этот цикл можно представить в виде:
где ab – адиабатное сжатие ТРТ;
bc – подвод теплоты q1 в изотермическом процессе при Т1=const;
cd – адиабатное расширение ТРТ;
da – отвод теплоты 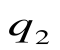
q1 = площадь bсFEb – теплота, затраченная на совершение цикла 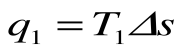
q2 = площадь adFЕa – теплота, отведенная в холодильник 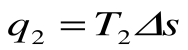
| Изм. |
| Лист |
| № докум. |
| Подпись |
| Дата |
| Лист |
Тогда термический кпд прямого цикла Карно будет равен:
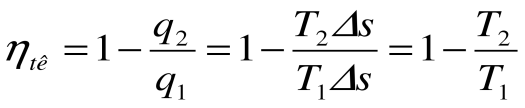
Таким образом, термический кпд цикла Карно зависит только от предельных температур источника и холодильника и не зависит от рода рабочего тела. (Первая теорема Карно). Температура Т1 и Т2 являются основными параметрами цикла Карно, которые полностью определяют этот цикл.
При Т1=Т2 термический кпд цикла Карно 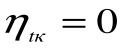
При Т2=0 или Т1= 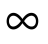
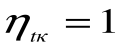
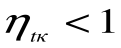
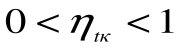
Любое заключение, вытекающее из анализа прямого цикла Карно, можно рассматривать как формулировку второго закона термодинамики.
В двух разобщенных между собой теплоизолированных сосудах А и В содержатся газы, в сосуде А – аргон, в сосуде В– водород, объем сосуда А– 150 л, сосуда В – 250 л. Давление и температура аргона – р1, t1, водорода – р2, t2. Определить давление и температуру, которые установятся после соединения сосудов и смешения газов. Теплообменом с окружающей средой пренебречь
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Универсальное уравнение состояния идеального газа
Уравнению Клапейрона можно придать универсальную форму, если газовую постоянную отнести не к 1 кг газа, а к 1 кмоль.
Итальянский ученый Авогадро в 1811 г. доказал, что при одинаковых температурах и давлениях в равных объемах различных идеальных газов содержится одинаковое количество молекул. Из закона Авогадро вытекает, что плотности газов, находящихся при одинаковых температурах и давлениях, прямо пропорциональны их молекулярным массам:
где μ1 , μ2 — молекулярные массы газов.
Молекулярной массой таза называется численное выражение отношения массы молекулы данного вещества к 1/12 массы атома изотопа углерода 12 С.
Количество вещества, содержащее столько же молекул (атомов частиц) сколько атомов содержится в нуклиде углерода 12 С массой 12 кг (точно) называется килограмм-молекулой или киломолем, газа (кмоль).
Отношение плотностей газов в уравнении (а) можно заменить обратным отношением удельных объемов.
тогда 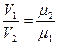
Это соотношение показывает, что при одинаковых физических условиях произведение удельного объема газа на его молекулярную массу есть величина постоянная и не зависит от природы газа:
Произведение Vμ есть объем 1 кмоль идеального газа, а уравнение показывает, что объемы киломолей всех газов при равных температурах и давлениях одинаковы.
Напишем уравнение состояния для. 1 кмоль газа: PVμ = μRT
Откуда
Произведение μR называют универсальной газовой постоянной.
Универсальная газовая постоянная μR есть работа 1 кмоль идеального газа в процессе при постоянном давлении и при изменении температуры на 1 0 .
При так называемых нормальных физических условиях (давлении 101325 н/м 2 и температуре 273,15 0 К) объем 1 кмоль газа равен 22,4143 м 3 /кмоль, а универсальная газовая постоянная оказывается равной
Универсальное уравнение состояния, отнесенное к 1 кмоль газа, имеет следующий вид:
Это уравнение называют уравнением состояния Клапейрона — Менделеева, так как оно впервые было предложено Д. И. Менделеевым в 1874 г. Уравнение Клапейрона — Мендеелеева является наиболее общим для идеальных газов, так как связывает три закона идеальных газов (Гей-Люссака, Бойля—Мариотта и Авогадро) и включает универсальную газовую постоянную, не зависящую от природы газа.
Зная универсальную газовую постоянную μR, можно подсчитать известную уже нам величину R:
Физические постоянные некоторых газов приведены в табл. 2.
| Газ | Химическая формула | Масса 1 кмоль, кг/кмоль | Газовая постоянная R, дж/кг град) | Плотность газа при Нормальных физических условиях, кг/м 3 |
| Кислород | о2 | 259,8 | 1,429 | |
| Водород | н2 | 2,016 | 4124,3 | 0,090 |
| Азот | N2 | 28,02 | 296,8 | 1,250 |
| Окись углерода | СО | 296,8 | 1,250 | |
| Воздух | — | 28,96 | 287,0 | 1,293 |
| Углекислый газ | со2 | 189,9 | 1,977 | |
| Водяной пар | н2о | 18,016 | 461,6 | 0,804 |
| Гелий | Не | 4,003 | 2077,2 | 0,178 |
| Аргон | Аг | 39,944 | 208,2 | 1,784 |
| Аммиак | NH3 | 17,031 | 488,2 | 0,771 |
Выведем основной закон идеальных газов по другому.
Из уравнений [5] и [8] следует, что
Рассмотрим 1 кг газа. Произведение концентрации молекул п, т. е. числа молекул в единице объема, и объема одного моля газа Vмоля равно числу молекул в одном моле, т. е. числу Авогадро N А.. NA = пVмоля .
Вместо двух постоянных: универсальной газовой постоянной R и числа Авогадро NA — была введена постоянная k равная отношению 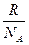
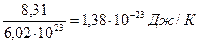
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
Полученное соотношение представляет собой уравнение Клапейрона (1834г.).
Умножив [11] на m, получим уравнение состояния для произвольной массы газа m:
Используя вес G = mg где g =9.8 м/с 2 PV = GRT [13]
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ.
Положив в (1.10) М = μ, и V = Vμ, получим для одного моля уравнение Клапейрона — Менделеева
Здесь Vμ — объем киломоля газа, а μR— универсальная газовая постоянная — работа, совершаемая 1 кг газа при нагревании его на 1 0 С при Р = const.
В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м 3 , поэтому
μR =PVμ/T =101,325 . 22,4136/273,15 = 8314 Дж/(кмоль . К). [15]
Газовая постоянная 1 кг газа составляет R = 8314/μ ; (1.12)
Плотность идеального газа может быть рассчитана с некоторой степенью точности на основе уравнения состояния идеальных газов
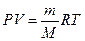
Из уравнения следует
Объем занимаемый единицей массы газа или удельный объем можно определить по уравнению
🎦 Видео
Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Уравнение состояния идеального газа. Практическая часть. 10 класс.Скачать

идеальный газ УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗАСкачать

Уравнение состояния идеального газаСкачать

Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

Уравнение состояния идеального газаСкачать

10 класс урок №39 Уравнение состояния идеального газаСкачать

Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Идеальный газ. Основное уравнение молекулярно-кинетической теории газов. 10 класс.Скачать

Физика. 10 класс. Уравнение состояния идеального газа /23.11.2020/Скачать

Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

ЕГЭ по физике. Теория #25. Идеальный газ. Уравнение состояния идеального газаСкачать

ЕГЭ. Физика. Уравнение состояния идеального газа. ПрактикаСкачать

Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Урок 147. Задачи на основное уравнение МКТ идеального газаСкачать