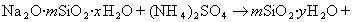Получение коллоидных растворов (золей) требует соблюдения следующих условий: 1) нерастворимость веществ дисперсной фазы в дисперсионной среде; 2) наличие в среде стабилизаторов — веществ, способных стабилизировать дисперсные частицы.
Получить коллоидные растворы можно измельчением вещества до коллоидного состояния (диспергация) и укрупнением молекул и ионов в агрегаты коллоидных размеров (конденсационные методы).
Диспергирование проводят физическими методами: механическим, ультразвуковым, электрическим.
Механическое диспергирование — дробление, истирание проводят в шаровых мельницах при медленном вращении полого цилиндра, заполненного на 30—40% шарами из стали, камня или фарфора. Более тонкое раздробление проводят коллоидными мельницами, где в зазоре между быстро вращающимся ротором и неподвижным кожухом происходит истирание частиц. Использование поверхностно-активных веществ при получении коллоидных растворов диспергированием определяется их способностью понижать сопротивление твердых тел механическому разрушению (эффект Ребиндера, 1928 г.). ПАВ облегчает развитие микротрещин в поверхностных слоях разрушаемого тела, чем способствует повышению степени дисперсности.
Диспергирование ультразвуком происходит за счет возникновения разрывающих усилий при прохождении через твердое тело колебаний с частотой 20000 Гц/с. Этот метод применяют для диспергирования серы, графита, красок.
Коллоидные растворы металлов получают электрическим диспергированием путем распыления в вольтовой дуге металлических электродов, погруженных в воду.
Рыхлые, студенистые, свежеприготовленные осадки можно диспергировать химическим методом пептизации — промыванием небольшим количеством раствора пептизатора с образованием высокодисперсной системы. При этом нарушаются связи между слипшимися частицами, частицы приобретают заряд вследствии диссоциации.
Условием получения коллоидных растворов конденсационными методами является получение пересыщенных систем физическими или химическими методами. Такие системы образуются при конденсации паров, например, ртути при получении гидрозоля ртути и некоторых других металлов.
Пересыщенные растворы можно получить методом заучены растворителя, вследствие низкой растворимости вещества в новом растворителе. Так, из исходных спиртовых растворов получают коллоидные растворы серы, фосфора, канифоли в воде.
Химической конденсацией получают дисперсную фазу в ходе реакций обмена, окисления-восстановления, гидролиза. Например, в кипящей воде в результате гидролиза солей железа(Ш) можно получить коллоидные частицы его гидроксида:
Для повышения устойчивости коллоидов в раствор вводят стабилизаторы — ионы вещества, из которого состоит частица. Например, если при получении золя иодида серебра но уравнению
растворы нитрата серебра и иодида калия взяты в эквивалентных количествах, то устойчивой коллоидной системы не образуется. Образующиеся частицы не несут электрических зарядов, т.е. L, = 0. Чтобы получить коллоидный раствор иодида серебра, необходимо взять избыток одного из электролитов, который станет по- тенциалопределяющим, придаст частицам заряд, стабилизирует коллоидную систему. Например, избыток нитрата серебра ведет к образованию положительно заряженных коллоидных частиц в результате адсорбции ионов Ag + .
- 1.7. Примеры получения коллоидных систем методом конденсации
- Получение коллоидных растворов
- Что такое получение коллоидных растворов
- Конденсационные методы получения коллоидных растворов
- Способы получения коллоидный растворов
- Примеры образования коллоидных растворов
- Дисперсные системы
- Как устроена мицелла
- Свойства коллоидных систем
- Как разрушить коллоидные растворы
- Что вызывает коагуляцию
- Кто открыл коллоидные растворы
- Майкл Фарадей
- Томас Грэм
- Похожие страницы:
- Leave a Comment
- Уравнения реакций в результате которых возможно образование коллоидных растворов методом
- 🎦 Видео
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

1.7. Примеры получения коллоидных систем методом конденсации
В исследовательской практике золи получают как физическими методами конденсации, так и химическими. В ряде случаев можно получать золи непосредственной конденсацией паров, например, ртути, серы, селена и других веществ, не окисляющихся при испарении. В тех случаях, когда при испарении на воздухе возможно окисление, проводят одновременное испарение в вакууме как дисперсной фазы, так и дисперсионной среды, после чего конденсируют их на охлажденной поверхности, а затем нагревают до расплавления дисперсионной среды и получают лиозоль. Таков, например, метод Рогинского и Шальникова получения органозолей щелочных металлов.
Для образования золей из растворов используют метод снижения растворимости, например, так называемый метод замены растворителя. Можно вливать раствор вещества в растворителе, неограниченно смешивающимся с водой, в охлажденную воду или изменять растворяющую способность, вводя осадитель в водный раствор. Такой метод применяется не только для получения золей, но и при формовании волокон из растворов.
Можно получать золи путем охлаждения пересыщенных водных растворов, например, вливанием горячего раствора в холодную воду. В тех случаях, когда растворенное вещество имеет на кривой растворимости критическую температуру смешения, вблизи этой температуры при охлаждении или нагревании образуется лиофильный золь.
Наиболее важное значение для технологии получения дисперсных систем имеют процессы конденсации в жидкой среде, основанные на образовании дисперсной фазы при химическом взаимодействии растворимых веществ. Необходимым условием получения лиозолей является малая растворимость дисперсной фазы.
В принципе может быть использована любая химическая реакция — восстановления, окисления, двойного обмена, гидролиза. Во время становления коллоидной химии как науки было предложено бесконечное число химический реакций, которые могут привести к образованию коллоидных систем. Большинство способов получения золей были обобщены Зигмонди. Мы остановимся только на тех, которые имеют промышленное значение. Например, при химической очистке воды перед использованием ее в технологических процессах используют реакцию гидролиза солей железа или алюминия:
Fe 3+ + H2O Þ [Fe(OH)] 2+ + H + , (2.1.53)
Полный гидролиз солей железа (III) протекает медленно и равновесие достигается за пять — шесть месяцев. Поэтому в золях гидроксида железа (III) формируются частицы переменного состава. В технологической практике часто используют соль железа (II) — железный купорос FeSO4·7H2O, гидролиз которого можно описать схемой
Гидроксид железа (II) Fe(OH)2 хорошо растворим в воде, поэтому для перевода его в гидроксид железа (III) требуется создавать щелочную среду, например, при использовании гидроксида кальция. Гидролиз ускоряется при нагревании. Мицелла гидроксида железа (III) может быть изображена схемой
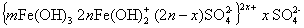
Промежуточными продуктами, стабилизирующими золь, могут быть в кислой среде
Cтепень гидролиза зависит от концентрации солей и температуры. В щелочной среде в зависимости от степени гидролиза возможны такие промежуточные продукты как
В этой связи строение мицеллы гидроксида алюминия может быть изображена схемой:
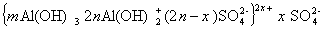
в щелочной среде
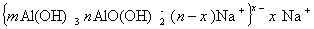
Таким образом, частицы гидроксида алюминия могут нести отрицательный или положительный заряд в зависимости от рН среды. Как установил Кольтгоф точка электрической нейтральности (точка нулевого заряда) золя гидроксида алюминия соответствует рН = 6,5¸7,5. Наибольшая скорость гидролиза солей алюминия наблюдается при рН = 4,95¸5,40.
В процессах беления текстильных материалов в качестве стабилизатора пероксида водорода используют силикат натрия. Стабилизирующее действие связывают обычно с образованием золя оксида кремния. Можно полагать. что в щелочной среде образуется кремнезоль, мицеллы которого изображают схемой
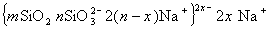
Стабилизирующие ионы SiO3 2 — образуются при диссоциации поверхностных групп Na2O2SiO-, а диоксид кремния, достраивающий ядро мицеллы, образуется в результате реакций
Ионы Н + , образующиеся при распаде пероксида водорода, связываются с силикатом, имеющим высокую буферную емкость. В присутствии солей жесткости Са 2+ или Mg 2+ возможна коагуляция гидрозоля и образование силикатных осадков, что влечет за собой проблемы, связанные с отложением коагулюма на тканях и деталях оборудования. Гидролиз силиката с образованием диоксида ускоряется при нагревании, в частности, паром отбеливаемой ткани, пропитанной белящим раствором, содержащим в качестве стабилизатора пероксид силиката натрия. Осадки диоксида кремния на ткани, возникающие при коагуляции кремнезоля, могут привести к непрокрасу ткани и ухудшают ее гриф.
Приведенная схема получения золя диоксида кремния только приближенно описывает процесс, так как силикат натрия часто находится в полимеризованном виде Na2O·mSiO2·xH2O.
В практике очистки воды от первичных загрязнений используют золи диоксида кремния, которые получают из активной кремнекислоты, а ту, в свою очередь, образуют из силиката натрия при использовании различных реакций, например
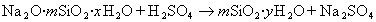
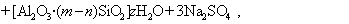
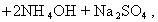
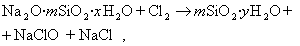
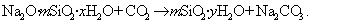
Частицы золей активной кремнекислоты состоят из разветвленных цепочек или колец тетраэдров SiO2, соединенных силоксановыми связями =Si-O-Si=. На поверхности частиц сохраняются атомы кремния, связанные с группами =Si-OH. В результате диссоциации этих групп поверхность частиц приобретает отрицательный заряд, а вокруг частиц диффузионно располагаются катионы. Схему мицеллы золей диоксида кремния, полученной по любой из приведенных реакций, можно изобразить одной и той же формулой
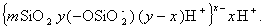
По реакции (2.1.67) наряду с золем диоксида кремния образуется золь алюмосиликата. Все эти золи имеют отрицательный заряд частиц и используются обычно для улучшения коагуляции положительно заряженных золей гидроксидов алюминия и железа с целью уменьшения объема образующихся осадков и повышения качества очистки воды.
При синтезе коллоидных систем в аппаратах, применяемых при очистке сточных вод от красителей, текстильно-вспомогательных веществ и ПАВ, в присутствии хлорида натрия или сульфата натрия получают золи гидроксидов железа или алюминия в результате следующих реакций на электродах:
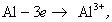
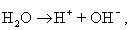

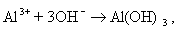
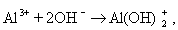
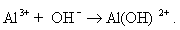
Мицеллы имеют переменный состав в зависимости от степени окисления алюминия
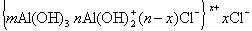
В результате такого процесса формируются положительно заряженные частицы, необыкновенно адсорбционно-активные в момент образования, поэтому способные к замещению противоионов Cl — анионами красителей или анионактивными ПАВ. После такого замещения агрегативная устойчивость нарушается и золи коагулируют.
Аналогичная схема может быть использована и при получении золей гидроксида железа. Как недостаток метода можно отметить выделение водорода при электролизе воды, в результате чего возникает опасность взрыва.
Если при получении лиозолей (в воде или какой-либо другой полярной или неполярной жидкости) образуются коллоидные частицы, не имеющие на своей поверхности достаточного для агрегативной устойчивости количества стабилизатора, или в водной фазе находится избыток электролита, то коллоидные частицы при взаимодействии друг с другом сформируют осадок.
Этот осадок может быть вновь переведен в устойчивое состояние с образованием лиозоля при восстановлении структуры стабилизирующего слоя на поверхности частиц или его создании. Такой процесс называют пептизацией. Пептизация может происходить при промывке осадков от излишнего электролита, при введении химически активного компонента, при добавлении электролита, ионы которого способны достраивать частицу, или при добавлении ПАВ, которые на поверхности частиц формируют адсорбционно-сольватные оболочки. Таким образом, пептизация — это процесс получения лиозолей из осадков частиц, уже имеющих коллоидный размер. Следовательно, этот способ образования лиозолей не относится ни к диспергационным, ни к конденсационным.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Получение коллоидных растворов
Получение коллоидного раствора это процесс в результате которого образуются коллоидные частички которые и составляют этот раствор в растворителе.
Укрупнение этих частит приводит к слипанию вещества, в результате чего вещество переходит в осадок,примером служит коллоидное золото.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Что такое получение коллоидных растворов
Коллоидные растворы могут быть получены различными методами.
Некоторые вещества, обладающие сложным составом и большими молекулами, как, например, белок, желатина, гуммиарабик, образуют коллоидные растворы уже при длительном соприкосновении с водой.
Другие можно превратить в коллоидное состояние путем растирания с жидкостью. Грубые частицы можно также измельчать до коллоидных размеров в так называемых коллоидных мельницах.
Эти мельницы широко применяются на практике при изготовлении различных красок, наполнителей для бумаги и резины, в фармацевтической промышленности, в пищевой промышленности и т. д.
Раздробление веществ на коллоидных мельницах может быть доведено до частиц с диаметром, равным всего только 0,01
Указанные методы основаны на превращении крупных частиц в более мелкие и потому получили название дисперсионных методов.
Но можно идти и противоположным путем, создавая условия, при которых простые молекулы соединяются в более крупные агрегаты, не переходящие, однако, известного предела.
Конденсационные методы получения коллоидных растворов
В основе их лежат химические реакции, протекающие в водных растворах.
Соответственно регулируя условия реакций, во многих случаях, можно добиться, чтобы образующееся при реакции нерастворимое вещество выделялось в виде коллоидных частиц того или иного размера, и таким образом получить коллоидный раствор.
Так, например, описанный выше коллоидный раствор золота легко получить восстановлением хлорного золота формалином.
Способы получения коллоидный растворов

Нагрев раствор до кипения, вольем в него 2—3 мл очень слабого раствора формалина.
Жидкость приобретает красивый пурпурный цвет вследствие выделения коллоидных частиц золота:
Конечно, золото выделяется в этом случае сначала в виде отдельных атомов, которые, однако, сейчас же связываются в более крупные агрегаты.
Примеры образования коллоидных растворов
Приведем еще примеры образования коллоидных растворов при химических реакциях.
1. Нагреем в стакане до кипения некоторое количество де-стиллированной воды и будем прибавлять к ней по каплям раствор хлорного железа FeCl3.
Вследствие гидролиза большая часть хлорного железа превращается в гидрат окиси железа:
Одновременно получается некоторое количество основной соли FeOCl.
Хотя гидрат окиси железа нерастворим в воде, но при этих условиях он не выпадает в осадок, а остается в растворе в виде мельчайших частиц.
Получается прозрачный золь Fe(OH)3, имеющий окраску крепкого чая.
2. В раствор мышьяковистой кислоты будем пропускать некоторое время сероводород:
Получается прозрачный золотисто-желтый золь сульфида мышьяка.
3. К конденсационным методам должен быть отнесен и метод получения металлов при помощи электрической дуги.
Изучение этого явления показало, что при проскакивании искры металл непосредственно превращается в пар, состоящий из отдельных атомов; образование же коллоидных частиц металла происходит уже в результате конденсации пара.
Дисперсные системы
Дисперсные системы – гетерогенные системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом (дисперсионная среда).
Свойства вещества в раздробленном (дисперсном) состоянии значительно отличаются от свойств того же вещества, находящегося в виде твердого тела или некоторого объема жидкости.
Существует несколько различных классификаций дисперсных частиц: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды,.
По характеру взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды, по термодинамической и кинетической устойчивости.
Как устроена мицелла
Коллоидная частица представляет собой ядро из малорастворимого вещества коллоидной дисперсности, на поверхности которого адсорбируются ионы электролита раствора.
Ионы электролита обеспечивают устойчивость золя, поэтому данный электролит называют ионным стабилизатором. Значит, коллоидная частица представляет собой комплекс, состоящий из ядра, вместе с адсорбционным слоем противоионов.
Рис. 2. Структура мицеллы As2S3
Агрегат частицы или ядро представляет собой вещество кристаллического строения, состоящий из сотен или тысячи атомов, ионов или молекул, окружённый ионами. Ядро вместе с адсорбированными ионами называется гранулой.
Так гранула имеет определённый заряд. Вокруг неё собираются противоположно заряженные ионы, придающие ей в целом электронейтральность. Вся система, состоящая из гранулы и окружающих её ионов называется мицеллой и является электронейтральной.
Свойства коллоидных систем
Это свойство рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
Опалесценция становится особенно заметной, если, как это делал Тиндаль (через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу.
При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
Как разрушить коллоидные растворы
Процесс укрупнения коллоидных частиц, приводящий к уменьшению степени дисперсности диспергированного вещества, называется коагуляцией.
Примером может служить реакция восстановления золота из его раствора, сначала образуется коллоидный раствор золота, а затем раствор укрупняется и выпадает в осадок.
Коагуляция, или слипание частиц, приводит к осаждению (седиментации) крупных агрегатов в виде осадка.
Что вызывает коагуляцию
Снижение устойчивости коллоидных систем вызывают введением электролитов, которые изменяют структуру диффузного слоя ионов.
Причем коагулирующим действием в электролите обладают только те ионы, (коагуляторы), которые несут заряд, по закону одноименной с зарядом противоиона коллоидной частицы.
Коагулирующее действие иона коагулятора тем больше, чем больше его заряд.
Коагуляция – самопроизвольный процесс, возникающий из-за стремления системы перейти в состояние с более низкой поверхностной энергией и более низким значением изобарного потенциала.
Процесс седиментации скоагулированного вещества также протекает самопроизвольно. Коагуляция может быть обусловлена различными причинами, наиболее эффективно действие электролитов.
Минимальная концентрация электролита в растворе, вызывающая коагуляцию, называется порогом коагуляции. Коагуляция также возникает при смещении двух золей с различными знаками зарядов частиц. Это явление называется взаимной коагуляцией.
Кто открыл коллоидные растворы
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм(1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия.
Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус, итальянский химик Франческо Сельми. В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.).
Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком.
Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Майкл Фарадей
Английский ученый Майкл Фарадей в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид».
Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами (NaCl, сахароза).
В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки.
Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей).
Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Статья на тему Получение коллоидных растворов
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Калужских А.Г. Лекция №7 «Методы получения коллоидных растворов»Скачать

Уравнения реакций в результате которых возможно образование коллоидных растворов методом
Фенол в отличие от этанола реагирует с раствором …
Для уменьшения в 32 раза скорости реакции, температурный коэффициент которой равен 2, необходимо понизить температуру на …
Уравнения реакций, в результате которых происходит образование коллоидных растворов методом химической конденсации, имеют вид …
Системами, для которых математическое выражение закона действующих масс имеет вид 
Уравнения реакций, в результате которых возможно образование коллоидных систем, имеют вид …
При электролизе водного раствора, содержащего нитраты ртути (II), меди (II), никеля (II) и калия в стандартных условиях, последовательность выделения веществ на катоде имеет вид …
Уравнения реакций, в результате которых возможно образование коллоидных растворов, имеют вид …
Для физической адсорбции характерна(о) …
Энтальпия образования 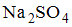
Уравнение Pосм = CRT, характеризующее зависимость осмотического давления от концентрации раствора неэлектролита и температуры, называется законом …
🎦 Видео
Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Получение коллоидных растворовСкачать

Коллоидные растворы. Дисперсные системыСкачать

10 класс § 10 "Коллоидные растворы"Скачать

8 класс. Составление уравнений химических реакций.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Суспензии, коллоиды и растворыСкачать
Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Как понять что вещество выпадает в осадок или образуется газСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции ионного обмена. 9 класс.Скачать