Получение коллоидного раствора это процесс в результате которого образуются коллоидные частички которые и составляют этот раствор в растворителе.
Укрупнение этих частит приводит к слипанию вещества, в результате чего вещество переходит в осадок,примером служит коллоидное золото.
- Что такое получение коллоидных растворов
- Конденсационные методы получения коллоидных растворов
- Способы получения коллоидный растворов
- Примеры образования коллоидных растворов
- Дисперсные системы
- Как устроена мицелла
- Свойства коллоидных систем
- Как разрушить коллоидные растворы
- Что вызывает коагуляцию
- Кто открыл коллоидные растворы
- Майкл Фарадей
- Томас Грэм
- Похожие страницы:
- Leave a Comment
- Урок №13. Коллоидные растворы
- Тема: Физико-химия дисперсных систем
- З А Н Я Т И Е N 16
- МЕТОДЫ ПОЛУЧЕНИЯ ЗОЛЕЙ
- ПОЛУЧЕНИЕ ЗОЛЕЙ МЕТОДОМ ХИМИЧЕСКОЙ КОНДЕНСАЦИИ
- СТРОЕНИЕ КОЛЛОИДНОЙ МИЦЕЛЛЫ
- Рассмотрим строение мицеллы AgI в избытке KI:
- СХЕМА СТРОЕНИЯ МИЦЕЛЛЫ ЗОЛЯ AgI
- КОАГУЛЯЦИЯ ЛИОФОБНЫХ ЗОЛЕЙ
- ЛАБОРАТОРНАЯ РАБОТА N 1
- 📽️ Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Что такое получение коллоидных растворов
Коллоидные растворы могут быть получены различными методами.
Некоторые вещества, обладающие сложным составом и большими молекулами, как, например, белок, желатина, гуммиарабик, образуют коллоидные растворы уже при длительном соприкосновении с водой.
Другие можно превратить в коллоидное состояние путем растирания с жидкостью. Грубые частицы можно также измельчать до коллоидных размеров в так называемых коллоидных мельницах.
Эти мельницы широко применяются на практике при изготовлении различных красок, наполнителей для бумаги и резины, в фармацевтической промышленности, в пищевой промышленности и т. д.
Раздробление веществ на коллоидных мельницах может быть доведено до частиц с диаметром, равным всего только 0,01
Указанные методы основаны на превращении крупных частиц в более мелкие и потому получили название дисперсионных методов.
Но можно идти и противоположным путем, создавая условия, при которых простые молекулы соединяются в более крупные агрегаты, не переходящие, однако, известного предела.
Конденсационные методы получения коллоидных растворов
В основе их лежат химические реакции, протекающие в водных растворах.
Соответственно регулируя условия реакций, во многих случаях, можно добиться, чтобы образующееся при реакции нерастворимое вещество выделялось в виде коллоидных частиц того или иного размера, и таким образом получить коллоидный раствор.
Так, например, описанный выше коллоидный раствор золота легко получить восстановлением хлорного золота формалином.
Способы получения коллоидный растворов

Нагрев раствор до кипения, вольем в него 2—3 мл очень слабого раствора формалина.
Жидкость приобретает красивый пурпурный цвет вследствие выделения коллоидных частиц золота:
Конечно, золото выделяется в этом случае сначала в виде отдельных атомов, которые, однако, сейчас же связываются в более крупные агрегаты.
Примеры образования коллоидных растворов
Приведем еще примеры образования коллоидных растворов при химических реакциях.
1. Нагреем в стакане до кипения некоторое количество де-стиллированной воды и будем прибавлять к ней по каплям раствор хлорного железа FeCl3.
Вследствие гидролиза большая часть хлорного железа превращается в гидрат окиси железа:
Одновременно получается некоторое количество основной соли FeOCl.
Хотя гидрат окиси железа нерастворим в воде, но при этих условиях он не выпадает в осадок, а остается в растворе в виде мельчайших частиц.
Получается прозрачный золь Fe(OH)3, имеющий окраску крепкого чая.
2. В раствор мышьяковистой кислоты будем пропускать некоторое время сероводород:
Получается прозрачный золотисто-желтый золь сульфида мышьяка.
3. К конденсационным методам должен быть отнесен и метод получения металлов при помощи электрической дуги.
Изучение этого явления показало, что при проскакивании искры металл непосредственно превращается в пар, состоящий из отдельных атомов; образование же коллоидных частиц металла происходит уже в результате конденсации пара.
Дисперсные системы
Дисперсные системы – гетерогенные системы, в которых одно вещество (дисперсная фаза) равномерно распределено в другом (дисперсионная среда).
Свойства вещества в раздробленном (дисперсном) состоянии значительно отличаются от свойств того же вещества, находящегося в виде твердого тела или некоторого объема жидкости.
Существует несколько различных классификаций дисперсных частиц: по размеру частиц, по агрегатному состоянию дисперсной фазы и дисперсионной среды,.
По характеру взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды, по термодинамической и кинетической устойчивости.
Как устроена мицелла
Коллоидная частица представляет собой ядро из малорастворимого вещества коллоидной дисперсности, на поверхности которого адсорбируются ионы электролита раствора.
Ионы электролита обеспечивают устойчивость золя, поэтому данный электролит называют ионным стабилизатором. Значит, коллоидная частица представляет собой комплекс, состоящий из ядра, вместе с адсорбционным слоем противоионов.
Рис. 2. Структура мицеллы As2S3
Агрегат частицы или ядро представляет собой вещество кристаллического строения, состоящий из сотен или тысячи атомов, ионов или молекул, окружённый ионами. Ядро вместе с адсорбированными ионами называется гранулой.
Так гранула имеет определённый заряд. Вокруг неё собираются противоположно заряженные ионы, придающие ей в целом электронейтральность. Вся система, состоящая из гранулы и окружающих её ионов называется мицеллой и является электронейтральной.
Свойства коллоидных систем
Это свойство рассеивание света (опалесценция) (указывает на неоднородность, многофазность системы).
Опалесценция становится особенно заметной, если, как это делал Тиндаль (через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с раствором линзу.
При этом растворы, прозрачные в проходящем свете, в боковом освещении проявляют все свойства мутных сред. В коллоидной жидкости, наблюдаемой сбоку, образуется яркий светящийся конус (конус Тиндаля).
Как разрушить коллоидные растворы
Процесс укрупнения коллоидных частиц, приводящий к уменьшению степени дисперсности диспергированного вещества, называется коагуляцией.
Примером может служить реакция восстановления золота из его раствора, сначала образуется коллоидный раствор золота, а затем раствор укрупняется и выпадает в осадок.
Коагуляция, или слипание частиц, приводит к осаждению (седиментации) крупных агрегатов в виде осадка.
Что вызывает коагуляцию
Снижение устойчивости коллоидных систем вызывают введением электролитов, которые изменяют структуру диффузного слоя ионов.
Причем коагулирующим действием в электролите обладают только те ионы, (коагуляторы), которые несут заряд, по закону одноименной с зарядом противоиона коллоидной частицы.
Коагулирующее действие иона коагулятора тем больше, чем больше его заряд.
Коагуляция – самопроизвольный процесс, возникающий из-за стремления системы перейти в состояние с более низкой поверхностной энергией и более низким значением изобарного потенциала.
Процесс седиментации скоагулированного вещества также протекает самопроизвольно. Коагуляция может быть обусловлена различными причинами, наиболее эффективно действие электролитов.
Минимальная концентрация электролита в растворе, вызывающая коагуляцию, называется порогом коагуляции. Коагуляция также возникает при смещении двух золей с различными знаками зарядов частиц. Это явление называется взаимной коагуляцией.
Кто открыл коллоидные растворы
Обычно считают, что основателем коллоидной химии является английский ученый Томас Грэм(1805-1869), который в 50-60-е годы позапрошлого столетия ввел в обращение основные коллоидно-химические понятия.
Однако не следует забывать, что у него имелись предшественники, и прежде всего – Яков Берцелиус, итальянский химик Франческо Сельми. В 30-е годы XIX века Берцелиус описал ряд осадков, проходящих при промывании через фильтр (кремниевая и ванадиевая кислоты, хлористое серебро, берлинская лазурь и др.).
Эти проходящие через фильтр осадки Берцелиус назвал «растворами», но в то же время он указал на их близкое сродство с эмульсиями и суспензиями, со свойствами которых он был хорошо знаком.
Франческо Сельми в 50-е годы XIX века продолжил работы в этом направлении, ища физико-химические различия между системами, образованными осадками, проходящими через фильтр (он назвал их «псевдорастворами») и обычными истинными растворами.
Майкл Фарадей
Английский ученый Майкл Фарадей в 1857 г. синтезировал коллоидные растворы золота – взвесь Au в воде размерами частиц от 1 до 10 нм. и разработал методы их стабилизации.
Эти «псевдорастворы» рассеивают свет, растворенные в них вещества выпадают в осадок при добавлении небольших количеств солей, переход вещества в раствор и осаждение из него не сопровождаются изменением температуры и объема системы, что обычно наблюдается при растворении кристаллических веществ.
Томас Грэм
Томас Грэм развил эти представления о различии между «псевдорастворами» и истинными растворами и ввел понятие «коллоид».
Грэм обнаружил, что вещества, способные к образованию студнеобразных аморфных осадков, такие как гидроокись алюминия, альбумин, желатина, диффундируют в воде с малой скоростью по сравнению с кристаллическими веществами (NaCl, сахароза).
В то же время кристаллические вещества легко проходят в растворе через пергаментные оболочки («диализируют»), а студнеобразные вещества не проходят через эти оболочки.
Принимая клей за типичный представитель студнеобразных не диффундирующих и не диализирующих веществ, Грэм дал им общее название «коллоид», т.е. клееобразный (от греческого слова колла – клей).
Кристаллические вещества и вещества, хороши диффундирующие и диализирующие он назвал «кристаллоидами».
Статья на тему Получение коллоидных растворов
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Урок №13. Коллоидные растворы
Посмотрите видео — фильмы
Дисперсные системы
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой . Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой . Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
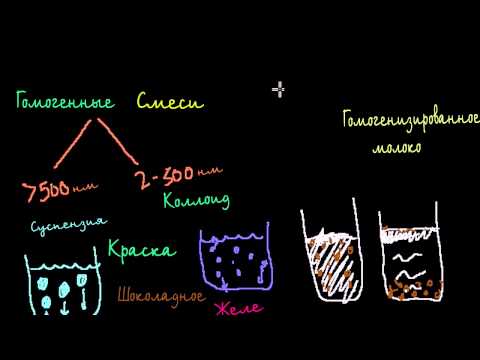
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм (1 нм = 10 -9 м) и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Тема: Физико-химия дисперсных систем
Видео:10 класс § 10 "Коллоидные растворы"Скачать

З А Н Я Т И Е N 16
ТЕМА: Физико-химия дисперсных систем
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

МЕТОДЫ ПОЛУЧЕНИЯ ЗОЛЕЙ
Гидрофобные золи получают 2-мя методами:
I метод диспергирования или дисперсионный (дробление);
II метод конденсации (укрупнения).
Методы диспергирования осуществляются путем механического, электрического или ультразвукового дробления веществ до размеров коллоидных частиц. Для этих целей используют специальные коллоидные мельницы.
Конденсационные методы основаны на переходе молекулярных и ионных растворов в коллоидные путем образования труднорастворимых веществ в результате химических реакций или изменения физических условий среды.
К методам конденсации относятся:
1) химические методы (гидролиз, реакция двойного обмена, окисление-восстановление);
2) методы замены растворителя, когда дисперсионная среда, в которой вещество дисперсной фазы образует молекулярный раствор, заменяется средой, в которой вещество нерастворимо.
Видео:Дисперсные системы (образование, свойства и устойчивость коллоидных растворов)Скачать

ПОЛУЧЕНИЕ ЗОЛЕЙ МЕТОДОМ ХИМИЧЕСКОЙ КОНДЕНСАЦИИ
1) Реакции обмена:
AgNO3 + KI = AgI + KNO3
4 FeCl3 + 3 K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12 KCl
2) Гидролиз соли: FeCl3 + 3 H2O = Fe(OH)3 + 3 HCl
При получении золей методом химической конденсации соблюдаются следующие условия:
1) золи получают при смешивании очень разбавленных растворов реагирующих веществ (например, AgI), т. к. при более высокой концентрации в эквивалентных количествах образуются осадки;
2) для получения золя необходим стабилизатор. При химических методах получения коллоидных систем в качестве стабилизатора выступают продукты реакции.
Видео:Коллоидные растворы. Дисперсные системыСкачать

СТРОЕНИЕ КОЛЛОИДНОЙ МИЦЕЛЛЫ
Видео:Получение коллоидных растворовСкачать

Рассмотрим строение мицеллы AgI в избытке KI:
AgNO3 + KI изб. → АgI ↓ + KNO3
Если одно из исходных веществ взято в небольшом избытке, то оно служит стабилизатором, т. е. сообщает устойчивость коллоидным частицам AgI. Коллоидная частица имеет сложную структуру и состоит из агрегата (совокупность большого количества молекул). Ионы I — будут продолжать достраивать кристаллическую решетку агрегата, сообщая ему электрический заряд. Этот ион называется потенциалопределяющим ионом (ПОИ). Затем начинают адсорбироваться противоионы К+ (ПРИ). Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с пои адсорбированный слой, а часть противоионов (10%) уходят в объем растворителя и образуют диффузный слой.
Схематически строение мицеллы AgI при избытке KI выразится так:

 |  |
агрегат пои при диффузный



 |
Коллоидная частица с диффузным слоем образует мицеллу: m – число молекул иодида серебра в ядре
n – число потенциалопределяющих ионов I¯
(n – x) – число связанных противоионов К+, входящих в адсорбционный слой
х – число ионов К+, входящих в диффузный слой.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

СХЕМА СТРОЕНИЯ МИЦЕЛЛЫ ЗОЛЯ AgI
с отрицательно заряженными частицами



 |



КОАГУЛЯЦИЯ ЛИОФОБНЫХ ЗОЛЕЙ
КОАГУЛЯЦИЯ – процесс укрупнения коллоидных частиц за счет слипания под влиянием молекулярных сил притяжения.
Этому процессу препятствует наличие у коллоидных частиц одноименного заряда. Чтобы вызвать коагуляцию золя, необходимо нейтрализовать заряд коллоидной частицы, тогда частицы будут сталкиваться и слипаться. Коагуляцию золя можно вызвать различными способами, легче всего при помощи электролитов.
При коагуляции золей электролитами происходит сжатие диффузного слоя, что позволяет коллоидным частицам подходить друг к другу на расстояние, на котором уже действуют силы межмолекулярного притяжения.
Различают 2 стадии коагуляции: скрытую и явную. При явно коагуляции изменяется окраска золя за счет укрупнения частиц, появляется муть, а дальше происходит седиментация – свободное оседание агрегатов коллоидных частиц под действием силы тяжести.
Для наступления явной коагуляции концентрация электролита должна быть равна или больше порога коагуляции золя.
Коагулирующая способность электролитов характеризуется ПОРОГОМ КОАГУЛЯЦИИ (γс), т. е. минимальной концентрацией электролита в миллимолях на 1 л золя, при которой начинается явная коагуляция. Обратная величина порога коагуляции называется КОАГУЛИРУЮЩИМ ДЕЙСТВИЕМ (1/γс).
Коагулирующим действием обладает только тот ион электролита, который имеет заряд, противоположный заряду коллоидной частицы.
Например, на положительно заряженный золь железа гидроксида коагулирующее действие оказывают анионы, а на отрицательно заряженный золь Fe4[Fe(CN)6]3 (берлинской лазури) – катионы.
Коагулирующая способность иона тем больше, чем выше его валентность.
ПРАВИЛО ШУЛЬЦЕ-ГАРДИ (правило значности) гласит: из 2-х ионов электролита коагулирующим действием обладает тот, знак которого противоположен знаку заряда коллоидных частиц, причем это действие тем сильнее, чем выше валентность коагулирующего иона.
Зависимость между порогом коагуляции (γс) и валентностью (Z) коагулирующего иона выражается уравнением:
где γс – порог коагуляции
а – коэффициент пропорциональности.
По теории Дерягина, порог коагуляции изменяется обратно пропорционально валентности коагулирующего иона в шестой степени:
УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА N 16
ЛАБОРАТОРНАЯ РАБОТА N 1
Получение коллоидных растворов гидроксида железа (III)
и берлинской лазури
1. Получение золя Fe(OH)3 реакцией гидролиза
В конической колбе (250 мл) на электроплитке нагревают до кипения 150 мл дистиллированной воды (мерным цилиндром). Не снимая колбы, плитку выключают и небольшой струей вливают в воду пипеткой 5 мл концентрированного раствора железа (III) хлорида. Происходит гидролиз FeCl3, в результате чего образуется коллоидный раствор железа (III) гидроксида интенсивного красно-коричневого цвета, стабилизированный FeCl3.
Полученный золь охлаждают под краном до комнатной температуры. Если необходимо, то фильтруют через складчатый фильтр. Золь должен быть прозрачным в проходящем свете!
2. Получение золя берлинской лазури реакцией обмена
В коническую колбу (250 мл) наливают 25 мл дистиллированной воды и добавляют микропипетками (1 мл и 2 мл) 0,2 мл концентрированного раствора FeCl3 и 2 мл насыщенного раствора желтой кровяной соли при перемешивании. В результате реакции обмена образуется нерастворимая в воде берлинская лазурь (железа (III) гексацианоферрат (II)) Fe4[Fe(CN)6]3 в виде густого геля. К образовавшемуся гелю берлинской лазури добавляют 150 мл дистиллированной воды, встряхивают и фильтруют золь через складчатый фильтр, смоченный дистиллированной водой. Золь должен быть совершенно прозрачным в проходящем свете и иметь интенсивно синюю окраску!
В данном случае золь берлинской лазури, для которого стабилизатором является желтая кровяная соль, образуется в результате пептизации геля.
Результаты данной работы зависят от умения обращаться с пипетками.
ЛАБОРАТОРНАЯ РАБОТА N 2
Определение порога коагуляции полученных золей
Чтобы определить, какой ион электролита-коагулятора должен оказывать коагулирующее действие на золь, нужно определить знаки зарядов коллоидных частиц золей Fe(OH)3 и Fe4[Fe(CN)6]3.
Сопоставление коагулирующей способности электролитов необходимо производить при одинаковом анионе, если ионом-коагулятором является катион и наоборот, при одинаковом катионе, если ион-коагулятор – анион.
Чтобы определить пороги коагуляции золя железа (III) гидроксида, готовят раствор электролитов с убывающей концентрацией. Для этого берут три ряда пробирок по 6 штук. В пробирки каждого ряда наливают из бюретки заданный объем дистиллированной воды и растворы электролитов в соответствии с таблицей 1. Растворы электролитов отмеряют пипеткой (5 мл).
Разведение раствора электролита в 3-х рядах одинаково, поэтому, чтобы рационально использовать время, рекомендуется заполнять пробирку так: взяв в руки одновременно вторые пробирки всех 3-х рядов, наливают в них по 1 мл дистиллированной Н2О; в третьи – по 2 мл дистиллированной воды и т. д. Затем в пробирки каждого ряда пипеткой добавляют объемы раствора заданного электролита в убывающем количестве 5, 4, 3, 2, 1 и 0,5.
Заполнение пробирок золем производится из бескрановой бюретки (100 мл). Передвигая под бюреткой штатив с пробирками, добавляют по 5 мл золя по возможности одновременно во все пробирки каждого ряда. Содержимое пробирок перемешивают встряхиванием, записывают время начала опыта и оставляют на 30 мин. для прохождения явной коагуляции.
Готовят контрольный раствор золя железа (III) гидроксида сливанием в пробирку 5 мл дистиллированной воды и 5 мл золя.
Методика для определения порога коагуляции золя берлинской лазури точно такая же, в соответствии с таблицей 2. Контрольный раствор готовят сливанием 5 мл дистиллированной воды и 5 мл исходного раствора берлинской лазури. Коагуляцию отличают, сопоставляя контрольную и исследуемую пробирки, для чего их ставят на лист чистой белой бумаги и наблюдают помутнение золя сверху через всю толщу раствора или наблюдают образование укрупненных агрегатов в проходящем свете при сопоставлении контрольной и исследуемой пробирок.
В таблицах 1 и 2 отмечают коагуляцию знаком «+», отсутствие коагуляции знаком «–».
1. Написать уравнения реакций получения золей Fe(OH)3 и Fe4[Fe(CN)6]3.
2. Изобразить формулу строения мицеллы золя Fe(OH)3, стабилизированного железа (III) хлоридом.
3. Изобразить формулу строения мицеллы золя берлинской лазури, стабилизированного желтой кровяной солью.
4. Каков знак заряда коллоидных частиц железа (III) гидроксида и берлинской лазури?
5. Какие ионы электролита-коагулятора должны оказать коагулирующее действие на золи Fe(OH)3 и Fe4[Fe(CN)6]3?
6. Рассчитать порог коагуляции золей Fe(OH)3 и Fe4[Fe(CN)6]3 для каждого электролита-коагулятора.
Суммарный объем растворов в каждой пробирке 10 мл, следовательно, концентрация золя во всех пробирках одинакова. Если С – молярная концентрация раствора электролита, У – минимальное число мл этого электролита, достаточное для коагуляции 10 мл золя, то СУ – это число миллимолей электролита, добавленного к 10 мл золя.
Для пересчета на 1 л золя СУ надо умножить на 100, тогда порог коагуляции равен:
γ = СУ · 100 ммоль/л
Таблица 1
Коагуляция золя гидроксида железа (III) под влиянием электролитов
📽️ Видео
Видеоурок по химии "Дисперсные системы"Скачать

8 класс. Составление уравнений химических реакций.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 11 класс (Урок№6 - Дисперсные системы.)Скачать

Суспензии, коллоиды и растворыСкачать
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакции ионного обмена. 9 класс.Скачать

3.1. Устойчивость и коагуляция дисперсных системСкачать

ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Составление уравнений реакций горения. 11 класс.Скачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать







