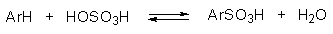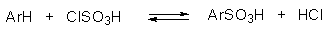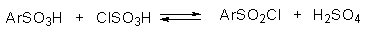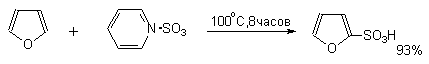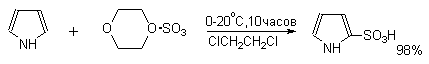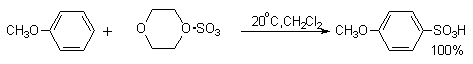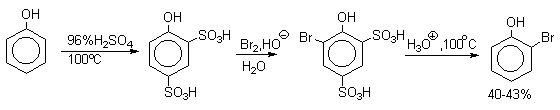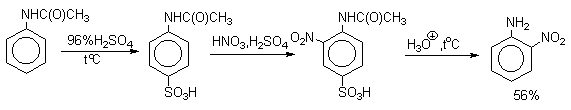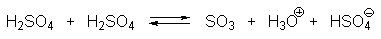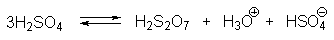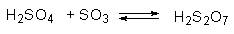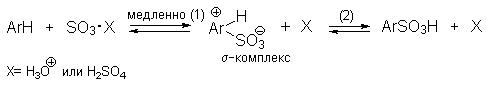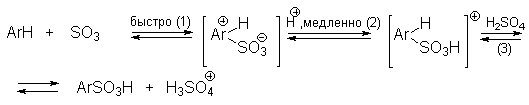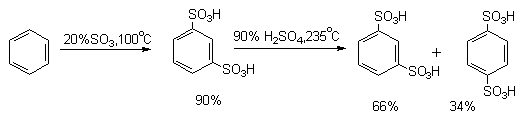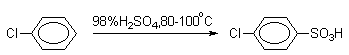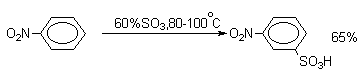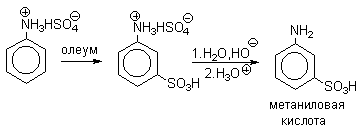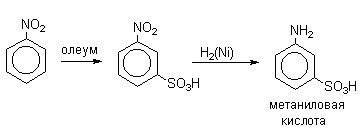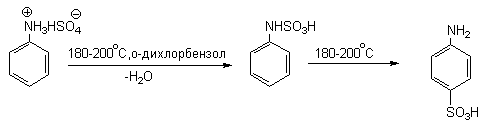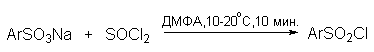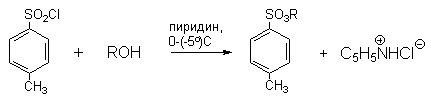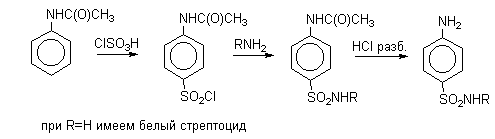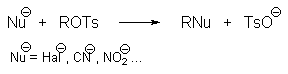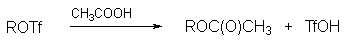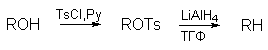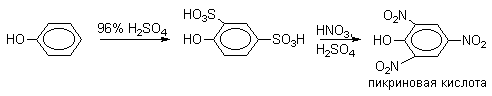Вы будете перенаправлены на Автор24
По реакции сульфирования в ароматические соединения можно ввести сульфогруппы — $SO_2OH$. Реагентом является серная кислота, с которой бензол реагирует довольно медленно.
Видео:Реакция сульфонированияСкачать
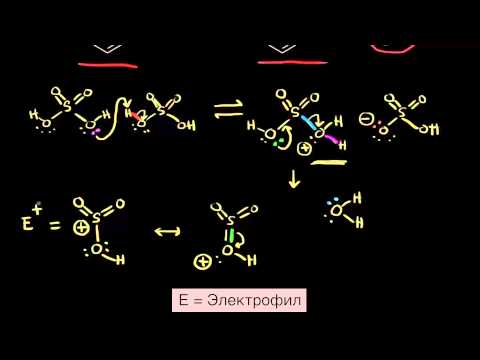
Механизм сульфирования
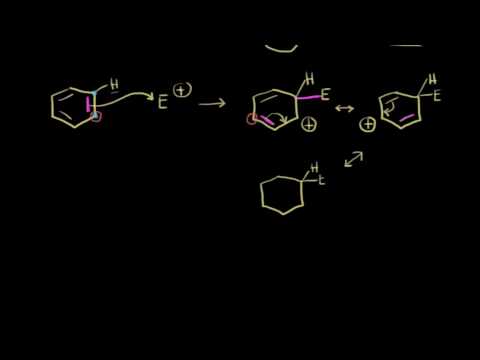
Механизм реакции подобный рассматриваемому в реакции нитрования. Сначала одна молекула $H_2SO4$ протонирует другую, после чего происходит отщепление воды и образования чрезвычайно реакционноспособного катиона. Он присоединяется к атому углерода ароматического цикла с образованием $sigma$-комплекса, который быстро разлагается с потерей протона и восстановлением ароматической системы.
Концентрированная серная кислота
Сульфирование можно провести с участием олеума — раствора $SO_3$ в концентрированной серной кислоте. В этом случае катионная электрофильная частица образуется при протонировании сульфотриоксида серной кислотой. Сам $SO_3$ является одним из самых активных электрофилов среди сульфирующих агентов.
Образующиеся сульфокислоты являются почти такими сильными, как и серная кислота, и сильнее соляной кислоты. Учитывая это выделить сульфокислоты можно в виде их натриевых солей, образующихся как кристаллические осадки при действии избытка $NaCl$.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Тозилатная группа
Пара-толуолсульфонатная (тозилатная) группа $OTs$ является важной группой в реакциях замещения за того, что это хорошая отходящая группа. Ввести ее можно с помощью хлороангидрида — тозилхлорида, $TsCl$, который получают обработкой пара-толуолсульфокислоты кислоты $PCl_5$. Тозилхлорид можно получить сульфированием толуола хлоросульфоновой кислотой. В этой реакции образуется преимущественно орто-изомер хлороангидрида, который можно отделить перегонкой.
Готовые работы на аналогичную тему
Для сульфирования хлоросульфоновой кислотой не нужно использовать катализ кислотой Льюиса, потому что она сама является очень сильной кислотой и протонирует сама себя с образованием электрофильной частицы. Это объясняет, почему при замещении отходит группа $OH$, а не атом хлора, а результатом реакции является хлоросульфирование, а не сульфирование.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Сульфирование нафталина
Сульфирование нафталина серной кислотой происходит легче, чем бензола, а характер продуктов замещения также зависит от условий проведения реакции. При температуре 80 $^circ$С (кинетический контроль) образуется нафталин-1-сульфокислота (выход 96%), тогда как при 165 $^circ$С (термодинамический контроль) с выходом 85% можно получить нафталин-2-сульфокислоту. В этих условиях нафталин-1-сульфокислота, которая образуется быстрее из-за низкой энергии переходного состояния соответствующего $sigma$-комплекса, под действием $H_2SO_4$ перегруппировывается в термодинамически устойчивую нафталин-2-сульфокислоту. Это происходит из-за меньшей устойчивости нафталин-1-сульфокислоты, и частично обусловлено взаимодействием с водородом в восьмом положении нафталинового ядра:
Видео:Несколько заместителейСкачать

Сульфирование ароматических аминов
Ароматические амины также можно сульфировать серной кислотой. Учитывая то, что в этих условиях амин должен находиться в про-тонированной форме, а аммониевая группа обладает свойствами мета-ориентирующего заместителя, можно ожидать образования мета-сульфокислоты. Однако результатом такого взаимодействия оказывается образования пара-аминообензолсульфокислоты (сульфаниловой кислоты).
Объяснением этого факта может быть наличие в реакционной смеси незначительного количества свободного амина, который как активный нуклеофил и взаимодействует с электрофильной частью с образованием япара замещенного продукта. Однако некоторые ученые считают, что реакция проходит через образование $N$-сульфопроизводной, которая при нагревании перегруппировывается в $C$-замещенную кислоту.
Сульфирование в $п$-положение бензольного кольца анилина является, по-видимому, конечным результатом ряда обратимых процессов сульфирования — десулъфирования, поскольку пара-изомер аминобензолсульфокислоты термодинамически наиболее стабилен. Подобная закономерность наблюдается и при сульфировании других ароматических аминов. Этим же методом получают ряд промышленно важных аминосульфокислот нафталина.
Сульфохлорирование ацетанилида хлорсульфоновой кислотой приводит к получению хлорангидрида $п$-ацетаминобензолсульфокислоты, из которого затем получают сульфаниламидные препараты, описанные в предыдущем разделе этой главы.
Видео:Лекция 15 (вторая часть)Скачать

Уравнения реакций сульфирования толуола и нафталина при разных температурах
Введение в ароматическое соединение группы SO3H называется сульфированием, а образующиеся продукты называются аренсульфокислотами.
Сульфирование широко используется в промышленном синтезе органических красителей, поверхностно-активных веществ, сульфамидных препаратов и других физиологически активных соединений. В качестве сульфирующего агента чаще всего употребляют 98-100%-ную серную кислоту (моногидрат), 92-94%-ную кислоту (купоросное масло), а также олеум, содержащий от 20-60% серного ангидрида, растворенного в безводной серной кислоте; иногда для сульфирования используют растворы SO3 в SO2 (жидк.) и SO3 в хлористом метилене. Эффективным сульфирующим агентом является хлорсульфоновая кислота (монохлорангидрид серной кислоты), которую получают при взаимодействии серного ангидрида и хлористого водорода. Сульфирование ароматических соединений хлорсульфоновой кислотой представляет собой двухстадийный процесс. На первой стадии образуется сульфокислота.
Далее она взаимодействует с хлорсульфоновой кислотой с образованием сульфохлорида.
Для того, чтобы сместить равновесие вправо, необходимо использовать 4-5-кратный избыток ClSO3H. Для сульфирования ароматических соединений, содержащих электронодонорные заместители, а также пятичленных ароматических гетероциклических соединений — фурана, пиррола, тиофена и др., нестабильных в сильнокислой среде, используют комплексы серного ангидрида с пиридином, диоксаном или диметилформамидом.
Важной особенностью реакции сульфирования является ее обратимость. Ароматические сульфокислоты расщепляются перегретым водяным паром в кислой среде при 110-180 о С (протодесульфирование представляет собой реакцию электрофильного ароматического ипсо-замещения). На этом свойстве сульфогруппы основано ее использование в качестве защитной группы в синтезе различных полизамещенных бензолов. Например, сульфогруппой можно защитить пара-место бензольного кольца в толуоле, анизоле, анилине и феноле.
До сих пор нет единого мнения относительно истинной природы электрофильного агента сульфирования. Данные кинетических измерений не дают однозначного ответа на этот вопрос, поскольку в водной и безводной серной кислоте содержится большое число потенциальных электрофильных агентов, относительная концентрация которых зависит от отношения H2O/SO3.
При концентрации серной кислоты ниже 80% устанавливаются главным образом следующие равновесия:
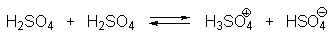
При более высокой концентрации серной кислоты в интервале 85-98% состояние серной кислоты в основном описывается уравнениями
В 100%-ной серной кислоте и в олеуме помимо H2S2O7 существуют и другие полисерные кислоты — H2S3O10; H2S4O13 и т.д. Все это крайне затрудняет интерпретацию данных по кинетике сульфирования.
В водной серной кислоте при концентрации ниже 80% скорость сульфирования линейно коррелирует с активностью иона H3SO4+ . При концентрации серной кислоты выше 85% наблюдается линейная корреляция с активностью H2S2O7. Эти две частицы, по-видимому, и есть два главных реальных электрофильных агента сульфирования ароматических соединений в водной серной кислоте. Их можно рассматривать как молекулу SO3, координированную соответственно с ионом H3O+ или серной кислотой. При переходе от 85%-ной к 100%-ной серной кислоте концентрация иона H3O+ резко уменьшается, а концентрация H2SO4 увеличивается. В 91%-ной кислоте [H3SO4+ ] = [H2S2O7], но так как H2S2O7 (SO3 . H2SO4) более сильный электрофильный агент, чем H3SO4+ (H3O+ . SO3), он доминирует как электрофил не только в 91%-ной, но даже и в 85%-ной серной кислоте.
Таким образом, механизм сульфирования может быть представлен, по-видимому, следующим образом:
Кинетический изотопный эффект kH/kD при концентрации серной кислоты ниже 95% пренебрежимо мал. Но при сульфировании 98-100%-ной H2SO4 или олеумом наблюдается кинетический изотопный эффект kH/kD в диапазоне 1.15-1.7, т.е. определяющей скорость стадией становится уже стадия (2). При концентрации серной кислоты ниже 95% протон от -комплекса отщепляется гидросульфат-ионом HSO4- , а при более высокой концентрации серной кислоты роль очень слабого основания играет сама H2SO4. Поэтому скорость стадии (2) резко уменьшается, и наблюдается кинетический изотопный эффект.
В олеуме скорость сульфирования резко возрастает. Электрофильным агентом в этом случае, по-видимому, является не связанный в комплекс SO3. Медленной является стадия (2).
Предположение о наличии нескольких активных частиц сульфирования позволяет объяснить изменение не только скорости, но и ориентации при сульфировании серной или олеумом. Катион H3SO4+ и H2S2O7 должны обладать более высокой селективностью по сравнению с SO3.
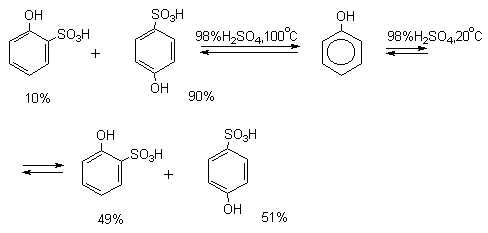
При рассмотрении экспериментальных данных по распределению изомерных продуктов сульфирования необходимо иметь в виду, что эта реакция подчиняется не кинетическому, а термодинамическому контролю. Поэтому соотношение орто-, мета- и пара-изомеров при изменении температуры меняется не только потому, что константы скорости сульфирования в орто-, мета- и пара-положения бензольного кольца по-разному меняются с ростом температуры, но и потому, что положение равновесия всех этих процессов также очень сильно зависит от температуры. Так, например, при сульфировании фенола до моносульфокислоты образуется смесь орто- и пара-гидроксибензолсульфокислот. При 20 о С образуется приблизительно равное количество орто- и пара-изомеров. Однако при сульфировании фенола при 100 о С в реакционной смеси преобладает пара-изомер. При нагревании смеси орто- и пара-изомеров в 80-90%-ной серной кислоте также накапливается пара-изомер. Это объясняется тем, что скорость протодесульфирования орто-изомера больше, чем пара-изомера. орто-Гидроксибензолсульфокислота не только образуется быстрее, но и расщепляется обратно до фенола с большей скоростью; пара-гидроксибензолсульфокислота медленнее образуется, но и медленнее расщепляется. Образование орто-изомера при сульфировании фенола 92-98%-ной серной кислотой при 0 о С (условия кинетического контроля сульфирования) указывает на то, что скорость обратной реакции протодесульфирования в этих условиях очень мала. Таким образом пара-изомер при термодинамическом контроле сульфирования фенола становится доминирующим продуктом этой реакции.
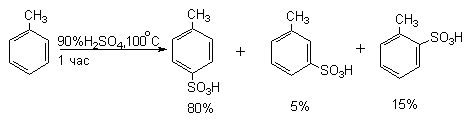
Аналогично толуол при сульфировании 100%-ной серной кислотой при 0 о С дает 43% орто-, 4% мета- и 53% пара-толуолсульфокислоты, тогда как при 100 о С в равновесных условиях наблюдается совершенно иное распределение изомеров: 13% орто-, 8% мета- и 79% пара-толуолсульфокислоты.
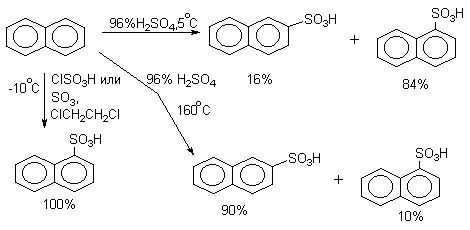
Другим классическим примером проявления термодинамического контроля является сульфирование нафталина
В очень мягких условиях образуется только 1-нафталинсульфокис-лота. Этому условию отвечает сульфирование нафталина хлорсульфоновой кислотой или раствором SO3 в дихлорэтане при 0 о -(-10 о С). Соотношение изомеров при сульфировании 96%-ной серной кислотой зависит от температуры: в более жестких условиях преобладает термодинамически более стабильная 2-нафталинсульфо-кислота.
Бензол при действии 92-94%-ной серной кислоты при 40-50 о С образует бензолсульфокислоту с выходом 90-96%. Введение одной сульфогруппы уменьшает скорость реакции введения второй сульфогруппы в 10 4 раз, поэтому мета-бензолсульфо-кислота получается при сульфировании бензола в жестких условиях избытком 20%-ного олеума при 100 о С или 60%-ного олеума при 60-80 о С. Длительное нагревание мета-бензолсульфокислоты с 90%-ной серной кислотой при 235 о С приводит к равновесной смеси, состоящей из 66% мета- и 34% пара-бензолсульфокислоты.
Дальнейшее сульфирование мета-бензолдисульфокислоты до 1,3,5-бензолтрисульфокислоты удается провести только с 60%-ным олеумом при 250 о С в присутствии сульфата ртути. Толуол сульфируется в несколько раз быстрее бензола. При этом, как правило, образуется смесь всех трех изомерных толуолсульфокислот.
пара-Толуолсульфокислота плохо растворима в конц.HCl и может быть выделена в чистом виде путем насыщения конц. водного раствора смеси полученных сульфокислот хлористым водородом.
Сульфирование хлорбензола и других галогенбензолов протекает в десять раз медленнее, чем сульфирование бензола, в результате образуется пара-хлорбензолсульфокислота, почти не содержащая орто-изомера.
Нитробензол сульфируется 60%-ным олеумом при 80-100 о С исключительно до мета-нитробензолсульфокислоты.
Пара-нитротолуол, как и следовало ожидать, образует при сульфировании 20%-ным олеумом 4-нитро-2-толуолсульфокислоту.
Сульфированием ароматических аминов получают аминосульфокислоты. Аминогруппа является одним из сильнейших электронодонорных ориентантов I-го рода, однако в 90-100%-ной серной кислоте или олеуме она протонируется, причем равновесие практически нацело смещено в сторону протонированной формы. Аммониевая группа NH3+ относится к сильным электроакцепторным заместителям, вызывающим резкое замедление реакции сульфирования и ориентирующим входящий электрофил в мета-положение.
В промышленности метаниловую кислоту получают восстановлением мета-нитробензолсульфокислоты.
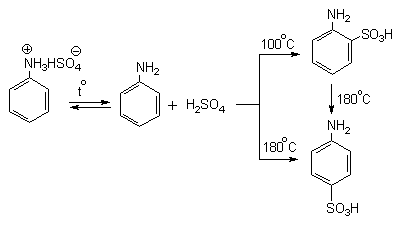
Для получения орто- и пара-аминобензолсульфокислот используют обходный метод, который носит название «реакции запекания». Эту реакцию осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200 о С в сухом виде или в высококипящих органических растворителях, обычно в орто-дихлорбензоле. При температуре около 100 о С образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200 о С — пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
Кроме того, имеются данные, что при высоких температурах может протекать конкурентный процесс образования сульфаминовой кислоты, которая затем изомеризуется с переходом сульфогруппы в пара-положение кольца.
Сульфокислоты, подобно карбоновым кислотам, образуют галогенангидриды, ангидриды, амиды и сложные эфиры. Методы получения этих функциональных производных по существу аналогичны методам, применяемым для получения производных карбоновых кислот. Один из методов получения хлорангидридов сульфокислот (сульфохлоридов) заключается в обработке сухой натриевой соли сульфокислоты тионилхлоридом или пятихлористым фосфором в ДМФА.
В промышленности сульфохлориды получают также прямым сульфированием аренов 4-5 эквивалентами хлорсульфоновой кислоты. Амиды и сложные эфиры сульфокислот легко получаются из сульфохлоридов с помощью стандартных методов.
Производные амида сульфаниловой кислоты (сульфамидные препараты; лекарственные вещества антимикробного действия) получают по следующей схеме:
Алкилтозилаты ROTs, алкилтрифлаты CF3SO3R (ROTf) и другие алкилсульфонаты нашли широкое применение в качестве алкилирующих агентов в реакциях бимолекулярного и мономолекулярного нуклеофильного замещения.
Алкилтозилаты восстанавливаются до углеводородов с помощью литийалюминийгидрида
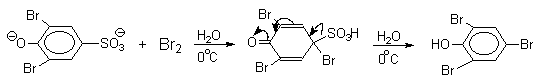
Сульфогруппа может быть замещена на нитрогруппу или галоген. Эти электрофильные реакции ипсо-замещения широко используются в органическом синтезе, например, при получении пикриновой кислоты или 2,4,6-трибромфенола
Важное значение в органическом синтезе имеют также реакции нуклеофильного замещения сульфогруппы. Сплавлением щелочных солей сульфокислот с твердыми щелочами и цианидами натрия и калия получают, соответственно, фенолы и нитрилы ароматических килот (арилцианиды).
Видео:Механизм электрофильного ароматического замещенияСкачать
Лабораторная работа 6 «Ароматические углеводороды»
Арены (или ароматические углеводороды) — это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения 80,10С, застывающую при охлаждении в бесцветные кристаллы с температурой плавления 5,530С, обладает своеобразным запахом. Легко воспламеняется и горит коптящим пламенем. Судя по суммарной формуле, можно предположить, что бензол является сильно ненасыщенным соединением, аналогичным, например, ацетилену.
Однако, химические свойства бензола не подтверждают такого предположения. Так, при обычных условиях бензол не даёт реакций, характерных для непредельных углеводородов: не вступает в реакции присоединения, не обесцвечивает раствор перманганата калия KMnO4.
В молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм. Все валентные углы равны 120.
Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 — гибридизации.
 Изучить некоторые физические и химические свойства бензола и его гомологов. Сравнить реакционную способность бензола и толуола. Познакомиться со свойствами полиядерных ароматических соединений на примере нафталина Оборудование и реактивы: Газоотводная трубка, набор пробирок, фарфоровая чашечка, три стакана объемом 100 мл, спиртовка, колба Вюрца, бензол С6Н6, нафталин, концентрированная серная кислота H2SO4, концентрированная азотная кислота HNO3, насыщенный раствор бромной воды Br2, 1%-ный раствор перманганата калия KMnO4, гидроксид натрия NaOH, хлорид кальция CaCl2. Опыт 1. Реакция бензола с бромом и перманганатом калия. В две пробирки наливают по 0,5 мл бензола. В одну из них добавляют 1 мл бромной воды, в другую — несколько капель перманганата калия. Смеси энергично встряхивают и дают отстояться. Запишите наблюдения и объясните. Синтез. «Нитрование бензола» Описание работы. Опыт проводят в вытяжном шкафу, так как пары нитробензола ядовиты. В колбу объёмом 100 мл, оснащённой охлаждением (40ч50 см) приливают 25 мл концентрированной серной кислоты H2SO4 и осторожно наливают капельным методом 20 мл концентрированной азотной кислоты НNO3. Охлаждают смесь до комнатной температуры и перемешивая приливают 18 мл бензола (образуется эмульсия). При нитровании бензола следят, чтобы температура реакционной смеси не превышала 500С и не была ниже 250С. Реакцию проводят на водяной бане с терморегулятором. Реакцию нитрования продолжают 45 мин. при температуре 600С. После чего реакционная смесь охлаждается холодной водой и при помощи делительной воронки разделяется. Нитробензол находится в нижней части делительной воронки. Затем нитробензол промывают разбавленным раствором гидроксида натрия и холодной водой. Промытый нитробензол приливают в конусообразную колбу и добавляют прокалённый хлорид кальция. Колбу закрывают пробкой с воздушным охладителем и нагревают на водяной бане до образования прозрачной жидкости. Осушенный нитробензол приливают в колбу Вюрца, оснащённой воздушным охлаждением и перегоняют при температуре 207ч2110С. Выход бензола 22 г. Нитробензол представляет собой маслянистую жидкость жёлтого цвета с запахом горького миндаля. Нитробензол в воде не растворяется, а растворяется в спирте, бензоле, эфире. Молекулярная масса 123,11, температура кипения 210.90С. Пары нитробензола ядовиты, поэтому после опыта его необходимо слить в специальную склянку. Опыт 3. Сульфирование ароматических углеводородов. Описание опыта. В две пробирки помещают по 3 капли толуола, во вторую — несколько кристалликов нафталина. В каждую пробирку приливают по 4-5 капель концентрированной серной кислоты и нагревают на кипящей водяной бане при постоянном встряхивании в течение 10 минут. Нафталин частично возгоняется и кристаллизуется на стенках пробирки выше уровня жидкости, его необходимо повторно расплавить, прогревая всю пробирку. Отмечают время, необходимое для получения однородного раствора. После этого пробирку охлаждают в холодной воде и добавляют в неё 0,5 мл воды. Если сульфирование прошло полностью, образуется прозрачный раствор, так как сульфокислоты хорошо растворимы в воде. Напишите уравнения реакций сульфирования толуола и нафталина при разных температурах. Кислородсодержащие органические соединения Существует огромное число органических соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к определенному классу. 💥 ВидеоЛекция 15 (первая часть)Скачать  Ароматические соединения Часть 1. АреныСкачать  Выделение ТОЛУОЛА из растворителя фирмы АРИКОНСкачать  Лукашев Н. В. - Органическая химия - Лекция 13Скачать  Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать  Лукашев Н. В. - Органическая химия. Часть 2 - Химия гетероциклических соединенийСкачать  Механизм электрофильного замещения в ароматическом рядуСкачать  Коллигативные свойства растворов. Законы РауляСкачать  Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать  Реакция алкилирования Фриделя-КрафтсаСкачать  Лукашев Н. В. - Органическая химия. Часть 1 - Электрофильное замещение в ароматическом рядуСкачать  Качественная реакция на сульфит- и сульфат-ионыСкачать  Антипин Р.Л. Механизмы реакций - основные трудности при изучении курса органической химииСкачать  29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать  |