СУЛЬФИРОВАНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
Замещение водорода в ядре ароматических соединений на сульфогруппу идет значительно легче, чем в соединениях жирного ряда; поэтому реакция сульфирования наряду с реакцией нитрования является одной из характерных для ароматических соединений. Сульфирование ароматических соединений идет несколько труднее, чем нитрование, и требует более жестких условий. Гомологи бензола (толуол, ксилолы) сульфируются легче, чем сам бензол; еще легче сульфируются фенолы и анилин.
Сульфопроизводные ароматических соединений находят широкое применение при синтезе ряда красителей и лекарственных веществ.
Реакция сульфирования осуществляется концентрированной серной кислотой или олеумом (олеум – это раствор серного ангидрида в безводной серной кислоте). В процессе реакции водородный атом замещается сульфогруппой, приводя к моносульфокислоте.


Сульфирование
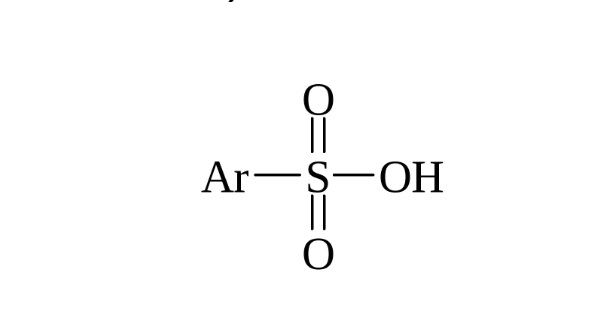
Введение в ароматическое соединение группы SO3H называется сульфированием, а образующиеся продукты называются аренсульфокислотами.
Сульфирование широко используется в промышленном синтезе органических красителей, поверхностно-активных веществ, сульфамидных препаратов и других физиологически активных соединений. В качестве сульфирующего агента чаще всего употребляют 98-100%-ную серную кислоту (моногидрат), 92-94%-ную кислоту (купоросное масло), а также олеум, содержащий от 20-60% серного ангидрида, растворенного в безводной серной кислоте; иногда для сульфирования используют растворы SO3 в SO2 (жидк.) и SO3 в хлористом метилене. Эффективным сульфирующим агентом является хлорсульфоновая кислота (монохлорангидрид серной кислоты), которую получают при взаимодействии серного ангидрида и хлористого водорода. Сульфирование ароматических соединений хлорсульфоновой кислотой представляет собой двухстадийный процесс. На первой стадии образуется сульфокислота.
Далее она взаимодействует с хлорсульфоновой кислотой с образованием сульфохлорида.
Для того, чтобы сместить равновесие вправо, необходимо использовать 4-5-кратный избыток ClSO3H. Для сульфирования ароматических соединений, содержащих электронодонорные заместители, а также пятичленных ароматических гетероциклических соединений — фурана, пиррола, тиофена и др., нестабильных в сильнокислой среде, используют комплексы серного ангидрида с пиридином, диоксаном или диметилформамидом.
Важной особенностью реакции сульфирования является ее обратимость. Ароматические сульфокислоты расщепляются перегретым водяным паром в кислой среде при 110-180 о С (протодесульфирование представляет собой реакцию электрофильного ароматического ипсо-замещения). На этом свойстве сульфогруппы основано ее использование в качестве защитной группы в синтезе различных полизамещенных бензолов. Например, сульфогруппой можно защитить пара-место бензольного кольца в толуоле, анизоле, анилине и феноле.
Механизм сульфирования
До сих пор нет единого мнения относительно истинной природы электрофильного агента сульфирования. Данные кинетических измерений не дают однозначного ответа на этот вопрос, поскольку в водной и безводной серной кислоте содержится большое число потенциальных электрофильных агентов, относительная концентрация которых зависит от отношения H2O/SO3.
При концентрации серной кислоты ниже 80% устанавливаются главным образом следующие равновесия:

При более высокой концентрации серной кислоты в интервале 85-98% состояние серной кислоты в основном описывается уравнениями
В 100%-ной серной кислоте и в олеуме помимо H2S2O7 существуют и другие полисерные кислоты — H2S3O10; H2S4O13 и т.д. Все это крайне затрудняет интерпретацию данных по кинетике сульфирования.
В водной серной кислоте при концентрации ниже 80% скорость сульфирования линейно коррелирует с активностью иона H3SO4+ . При концентрации серной кислоты выше 85% наблюдается линейная корреляция с активностью H2S2O7. Эти две частицы, по-видимому, и есть два главных реальных электрофильных агента сульфирования ароматических соединений в водной серной кислоте. Их можно рассматривать как молекулу SO3, координированную соответственно с ионом H3O+ или серной кислотой. При переходе от 85%-ной к 100%-ной серной кислоте концентрация иона H3O+ резко уменьшается, а концентрация H2SO4 увеличивается. В 91%-ной кислоте [H3SO4+ ] = [H2S2O7], но так как H2S2O7 (SO3 . H2SO4) более сильный электрофильный агент, чем H3SO4+ (H3O+ . SO3), он доминирует как электрофил не только в 91%-ной, но даже и в 85%-ной серной кислоте.
Таким образом, механизм сульфирования может быть представлен, по-видимому, следующим образом:
Кинетический изотопный эффект kH/kD при концентрации серной кислоты ниже 95% пренебрежимо мал. Но при сульфировании 98-100%-ной H2SO4 или олеумом наблюдается кинетический изотопный эффект kH/kD в диапазоне 1.15-1.7, т.е. определяющей скорость стадией становится уже стадия (2). При концентрации серной кислоты ниже 95% протон от 
В олеуме скорость сульфирования резко возрастает. Электрофильным агентом в этом случае, по-видимому, является не связанный в комплекс SO3. Медленной является стадия (2).
Предположение о наличии нескольких активных частиц сульфирования позволяет объяснить изменение не только скорости, но и ориентации при сульфировании серной или олеумом. Катион H3SO4+ и H2S2O7 должны обладать более высокой селективностью по сравнению с SO3.
При рассмотрении экспериментальных данных по распределению изомерных продуктов сульфирования необходимо иметь в виду, что эта реакция подчиняется не кинетическому, а термодинамическому контролю. Поэтому соотношение орто-, мета- и пара-изомеров при изменении температуры меняется не только потому, что константы скорости сульфирования в орто-, мета- и пара-положения бензольного кольца по-разному меняются с ростом температуры, но и потому, что положение равновесия всех этих процессов также очень сильно зависит от температуры. Так, например, при сульфировании фенола до моносульфокислоты образуется смесь орто- и пара-гидроксибензолсульфокислот. При 20 о С образуется приблизительно равное количество орто- и пара-изомеров. Однако при сульфировании фенола при 100 о С в реакционной смеси преобладает пара-изомер. При нагревании смеси орто- и пара-изомеров в 80-90%-ной серной кислоте также накапливается пара-изомер. Это объясняется тем, что скорость протодесульфирования орто-изомера больше, чем пара-изомера. орто-Гидроксибензолсульфокислота не только образуется быстрее, но и расщепляется обратно до фенола с большей скоростью; пара-гидроксибензолсульфокислота медленнее образуется, но и медленнее расщепляется. Образование орто-изомера при сульфировании фенола 92-98%-ной серной кислотой при 0 о С (условия кинетического контроля сульфирования) указывает на то, что скорость обратной реакции протодесульфирования в этих условиях очень мала. Таким образом пара-изомер при термодинамическом контроле сульфирования фенола становится доминирующим продуктом этой реакции.
Аналогично толуол при сульфировании 100%-ной серной кислотой при 0 о С дает 43% орто-, 4% мета- и 53% пара-толуолсульфокислоты, тогда как при 100 о С в равновесных условиях наблюдается совершенно иное распределение изомеров: 13% орто-, 8% мета- и 79% пара-толуолсульфокислоты.
Другим классическим примером проявления термодинамического контроля является сульфирование нафталина
В очень мягких условиях образуется только 1-нафталинсульфокис-лота. Этому условию отвечает сульфирование нафталина хлорсульфоновой кислотой или раствором SO3 в дихлорэтане при 0 о -(-10 о С). Соотношение изомеров при сульфировании 96%-ной серной кислотой зависит от температуры: в более жестких условиях преобладает термодинамически более стабильная 2-нафталинсульфо-кислота.
Сульфирование бензола и его производных
Бензол при действии 92-94%-ной серной кислоты при 40-50 о С образует бензолсульфокислоту с выходом 90-96%. Введение одной сульфогруппы уменьшает скорость реакции введения второй сульфогруппы в 10 4 раз, поэтому мета-бензолсульфо-кислота получается при сульфировании бензола в жестких условиях избытком 20%-ного олеума при 100 о С или 60%-ного олеума при 60-80 о С. Длительное нагревание мета-бензолсульфокислоты с 90%-ной серной кислотой при 235 о С приводит к равновесной смеси, состоящей из 66% мета- и 34% пара-бензолсульфокислоты.
Дальнейшее сульфирование мета-бензолдисульфокислоты до 1,3,5-бензолтрисульфокислоты удается провести только с 60%-ным олеумом при 250 о С в присутствии сульфата ртути. Толуол сульфируется в несколько раз быстрее бензола. При этом, как правило, образуется смесь всех трех изомерных толуолсульфокислот.
пара-Толуолсульфокислота плохо растворима в конц.HCl и может быть выделена в чистом виде путем насыщения конц. водного раствора смеси полученных сульфокислот хлористым водородом.
Сульфирование хлорбензола и других галогенбензолов протекает в десять раз медленнее, чем сульфирование бензола, в результате образуется пара-хлорбензолсульфокислота, почти не содержащая орто-изомера.
Нитробензол сульфируется 60%-ным олеумом при 80-100 о С исключительно до мета-нитробензолсульфокислоты.
Пара-нитротолуол, как и следовало ожидать, образует при сульфировании 20%-ным олеумом 4-нитро-2-толуолсульфокислоту.
Сульфированием ароматических аминов получают аминосульфокислоты. Аминогруппа является одним из сильнейших электронодонорных ориентантов I-го рода, однако в 90-100%-ной серной кислоте или олеуме она протонируется, причем равновесие практически нацело смещено в сторону протонированной формы. Аммониевая группа NH3+ относится к сильным электроакцепторным заместителям, вызывающим резкое замедление реакции сульфирования и ориентирующим входящий электрофил в мета-положение.
В промышленности метаниловую кислоту получают восстановлением мета-нитробензолсульфокислоты.
Для получения орто- и пара-аминобензолсульфокислот используют обходный метод, который носит название «реакции запекания». Эту реакцию осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200 о С в сухом виде или в высококипящих органических растворителях, обычно в орто-дихлорбензоле. При температуре около 100 о С образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200 о С — пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
Кроме того, имеются данные, что при высоких температурах может протекать конкурентный процесс образования сульфаминовой кислоты, которая затем изомеризуется с переходом сульфогруппы в пара-положение кольца.
- Сульфирование, сульфохлорирование
- Реакции сульфирования
- (уравнение 1)
- Изомерный состав, %
- СУЛЬФИРОВАНИЕ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ
- Сульфирование ариламинов
- Аналогично получают 4-аминонафталин-1-сульфокислоту, 2-аминонафталин-6-сульфокислоту и 1-аминоантрахинон-2-сульфокислоту.
- РЕАКЦИИ С ХЛОРСУЛЬФОНОВОЙ КИСЛОТОЙ, СУЛЬФОХЛОРИРОВАНИЕ
- Сульфирование бензола: строение, свойства и структурная формула
- Принцип сульфирования
- Сульфирующие агенты
- Процесс сульфирования: описание
- Свойства продукта
- Введение нескольких сульфогрупп
- Влияние температуры
- Сульфирование «в парах»
- Другие способы
- Выделение сульфокислот
- 📸 Видео
Сульфирование, сульфохлорирование
Сульфирование и сульфохлорирование, их значение для химфармпромышленности (ХФП), препараты, реагенты, кинетика, механизм, особенности и закономерности проведения реакций, технология получения основных продуктов, техника безопасности при их синтезе, экология.
Лекция по сульфирования и сульфохлорированию с сайта
http://www.htf.ustu.ru/tos/L2
В мире производится огромное количество алкилбензолсульфонатов, кроме того арил- и гетарилсульфокислоты и сульфохлориды служат в качестве интермедиатов в синтезе многих лекарственных препаратов. В молекуле ряда природных продуктов также имеется сульфогруппа. Таким образом, реакции сульфирования и сульфохлорирования в ряду ароматических и гетероциклических соединений широко используются в основном органическом синтезе и химфармпромышленности.
Значение реакций сульфирования и сульфохлорирования, препараты
В состав хрящевой ткани входит полисахарид — хондроитинсерная кислота (ХНСК), мономерами которой являются эфиры серной кислоты глюкороновой кислоты и N –ацетилгалактозамина. Препараты хонсурид и румалон, экстракты хрящевой ткани, содержат ХНСК. Хонсурид используется для лечения долго не заживающих ран, а румалон применяют при дегенеративных изменениях хрящей (артрозы, спондилезы). Мукополисахарид гепарин с молекулярной массой около 16000, является полимером глюкороновой кислоты и глюкозамина, этерифицированного серной кислотой. Гепарин вырабатывается базофильными клетками человека и животных. Препарат обладает антикоагулирующим действием, понижает содержание холестерина в сыворотке крови. Его применяют при терапии инфаркта миокарда, тромбозов магистральных вен и артерий, сосудов головного мозга.


гепарин натрия * кальция добензилат* поликрезулен*
В отличие от нитро- и нитрозогрупп, сульфогруппа не часто встречается в синтетических лекарственных средствах. Один из сульфосодержащих препаратов – кальция добензилат* (доксилек, доксиум — 2,5-дигидроксисульфонат кальция), который применяют для профилактики и остановки капиллярных кровотечений. Второй — поликрезулен* (ваготил), использующийся в качестве вяжущего, антимикробного и прижигающего средства. Однако производные сульфокислот – сульфаниламиды, составляют большой класс антибактериальных средств. Группа SO 2 NH 2 обладает фармакофорными свойствами, она моделирует карбоксигруппу, так как ее радиус и величина рК а очень близки к остатку СООН. Как известно п -аминобензойная кислота (ПАБК) является витамином для ряда микроорганизмов, она служит предшественником фолиевой кислоты. Для эукариот витамином является сама фолиевая кислота. Молекула стрептоцида – п- аминобензолсульфонамида ( R = H ) является структурным аналогом п -аминобензойной кислоты. В результате конкурентного ингибирования сульфаниламидные препараты предотвращают нормальное включение ПАБК в фолиевую кислоту у чувствительных микроорганизмов. Тем самым задерживают рост и приводят к их гибели. Сульфаниламидные препараты являются антиметаболитами, п- аминобензойная кислота – метаболит. Формулы основных лекарственных препаратов приведены в разделе «реакции хлорсульфирования», так как основным способом их получения является взаимодействие фенилуретилансульфохлорида с аминами.
Кроме того, реакции сульфирования ароматических и гетероциклических соединений имеют определенное значение в синтезе ряда лекарственных средств. Проведение реакций сульфокислот с нуклеофилами позволяет синтезировать циано-, амино- и гидроксисоединения. Так сульфокислоты с помощью реакции щелочного плавления превращаются в фенолы. Восстановление сульфокислот позволяет синтезировать тиофенолы. Ипсо-замещение сульфогрупп на нитрогруппы рассматривалось в разделе «Реакции нитрования». И, наконец, в синтезе лекарственных препаратов применяют такую особенность реакции сульфирования, как ее обратимость. Эти направления использования сульфокислот отражены на схеме:
Подробности каждого из представленных видов превращений рассмотрены в соответствующих разделах. В данном разделе приведены примеры использования сульфокислот при получении некоторых лекарственных веществ.
Препарат неостигмин бромид* (прозерин, N — м — диметилкарбамоилоксифенилтриметиламмоний метилсульфат) применяют при двигательных нарушениях после травм мозга, параличей различной этиологии, в глазной практике при глаукоме. Ретросинтез препарата представлен на следующей схеме:
Второй пример получения гидроксипроизводного из сульфокислоты – синтез хинозола, контрацептивного препарата, а также исходного соединения при получении нитроксолина (см. раздел 2.3.2.). Метод получения хинозола разработан в ВУХИНе:
Третий пример – препарат клофелин — 2-(2,6-дихлорфениламино)-имидазолин гидрохлорид — гипотензивное средство, применяющееся при лечении гипертонического криза. Фрагмент ретросинтеза клофелина представлен на следующей схеме:
Получить индивидуальный 2,6-дихлоранилин непосредственно из анилина невозможно, так как при хлорировании анилина образуется смесь 2,4-, 2,6-дихлоранилинов и 2,4,6-трихлоранилина. Поэтому необходимо блокировать п -положение с помощью легко удаляемой электроноакцепторной группировки. Тогда при проведении хлорирования может образоваться только 2,6-дихлорпроизводное. В данном случае в качестве защиты используют сульфогруппу.
Таким образом, реакции сульфирования и хлорсульфирования имеют значение при разработке альтернативных методов синтеза лекарственных средств. К сожалению, технологические особенности процессов таковы, что при их проведении возникают проблемы. Необходимо рассмотреть общие закономерности и механизм реакций, а также особенности их проведения с различными классами субстратов.
Реакции сульфирования
Сульфирование относится к реакциям электрофильного замещения. Частицами, атакующими субстрат реакции, являются HSO 3 + , H 2 S 2 O 7 , SO 3 и H 3 SO 4 + которые возникают в растворе олеума или концентрированной серной кислоты в результате автопротолиза:
 (уравнение 1)
(уравнение 1)
При этом наблюдается ионизация моногидрата лишь на 0,2 – 0,5%. При разбавлении 100% серной кислоты водой происходит ее ионизация по следующему уравнению:

Концентрация реакционноспособных частиц во многом зависит от используемого реагента.
Реагенты, использующиеся при проведении реакции сульфирования
1. Концентрированная серная кислота — 92-94% H 2 SO 4 (купоросное масло);
2. Моногидрат — 98-100% H 2 SO 4 ;
3. Жидкий олеум – 6-25% свободного SO 3 ( H 2 S 2 O 7 ), 60-65% свободного SO 3 ( H 2 S 2 O 7 );
4. Хлорсульфоновая кислота – HOSO 2 Cl ;
5. Молекулярные комплексы сульфотриоксида с пиридином или диоксаном:
Механизм реакции сульфирования
Обширные кинетические исследования последних лет позволили выяснить закономерности реакции сульфирования. Механизм реакции рассмотрен на примере, в котором в качестве реагента участвует сульфотриоксид, а субстрат реакции — бензол. Так же, как и для других реакций электрофильного замещения, исходные продукты образуют p -комплекс. После преодоления энергетического барьера — s -аддукт.
p -комплекс s -аддукт
Кинетические исследования реакции сульфирования хлорбензола и пентадейтерохлорбензола в моногидрате или олеуме показали, что величина константы скорости реакции для хлорбензола больше в 1,2 раза. Таким образом, наблюдается кинетический изотопный эффект. Следовательно, лимитирующей стадией процесса является отрыв протона и К 2 1 и К — 1 . В отличие от реакций нитрования и нитрозирования, отрыв протона происходит через более высокий барьер, чем при образовании s -аддукта. Кинетическое уравнение реакции в общем виде может быть представлено в следующем общем виде:

где: Х + одна из атакующих электрофильных частиц. Однако при проведении сульфирования в 96% серной кислоте кинетический изотопный эффект уже отсутствует. Таким образом стадией, лимитирующей процесс, становится образование s -аддукта. В этом случае кинетическое уравнение процесса сульфирования не отличается от уравнения реакции нитрования:
V = d[ArX]/dt = K 1 [Ar-H][X + ] (уравнение 4)
Было найдено, что при переходе от 100% серной кислоты к 99,5% скорость реакции уменьшается на несколько порядков. Это объясняется тем, что концентрация реакционноспособных частиц существенно снижается из-за ионизации серной кислоты согласно уравнению 2, так как увеличение концентрации гидросульфат ионов HSO 4 — сдвигает равновесие, изображенное в уравнении 1, в сторону серной кислоты. Кинетическое уравнение реакции может быть представлено в следующем виде:

Основной реакционноспособной частицей становится ион H 3 SO 4 + , активность которого существенно ниже, чем пиросерной кислоты. Снижение реакционной способности атакующей частицы приводит к увеличению региоселективности процесса. Был предложен одностадийный механизм реакции через циклическое переходное состояние:
Показано, что этот механизм не противоречит кинетическим исследованиям во всей изученной области составов сульфирующих агентов.
Особенности реакции сульфирования, побочные реакции
Первой и основной особенностью сульфирования является то, что эта реакция в условиях проведения процесса обратима:
Электронная плотность на атоме углерода, связанном с сульфогруппой, в бензолсульфокислоте выше, чем на аналогичном атоме углерода в нитробензоле. Поэтому вероятность ипсо-атаки протона при сульфировании значительно больше. При нитровании обратимость реакции наблюдается только в растворах концентрированной хлорной кислоты, а в случае сульфирования это происходит даже в разбавленных растворах серной кислоты. Поэтому приходится подбирать такую концентрацию серной кислоты, чтобы равновесие было сдвинуто вправо. Количество серной кислоты должно быть существенно больше стехиометрического как для связывания выделяющейся воды, так и для смещения равновесия в сторону целевого продукта. Был разработан эмпирический показатель p -сульфирования – это концентрация отработанной серной кислоты после завершения процесса сульфирования, выраженная в процентах SO 3 , при которой наблюдается максимальный выход сульфокислоты. Для многих ароматических соединений была найдена величина p -сульфирования, которая для каждого из субстратов реакции имеет свое значение. Так для бензола величина p -сульфирования составляет 66,4% SO 3 , для толуола – 58 и нитробензола – 82. Коэффициент p -сульфирования используется для расчета количества серной кислоты, необходимой для моносульфирования 1 кг-моля ароматического соединения по следующей формуле:

где: а – концентрация SO 3 в исходном сульфирующем агенте.
Использование этой формулы позволяет найти количество серной кислоты различной концентрации или олеума. В качестве примера рассчитаем количество 92, 94 и 100% серной кислоты и 20% олеума, необходимой для моносульфирования 1 кг-моля бензола. Для этого необходимо найти величину а (концентрацию SO 3 ) в каждом из реагентов.
Для 92% H 2 SO 4 : в 100 кг раствора содержится 92 кг H 2 SO 4
92 х х = 75,1% SO 3 ,
В 100 кг кислоты содержится 75,1 кг сульфотриоксида и 24, 9 кг Н 2 О. Аналогично ведется расчет количества SO 3 и воды для серной кислоты другой концентрации.
Для 20% олеума: в 100 кг содержится 20 кг SO 3 и 80 кг H 2 SO 4 . В этом количестве серной кислоты содержится 65,3 кг SO 3 . Всего в 100 кг олеума содержится 85.3 кг SO 3 (величина « а» ) и 14, 7 кг Н 2 О.
Рассчитаем количество серной кислоты, необходимой для моносульфирования 1 кг-моля бензола по уравнению 6:
Х = 308; 261; 176,8 и 142,2 кг соответственно для 92, 94, 100% H 2 SO 4 и 20% олеума.
После проведения реакции концентрация отработанной серной кислоты во всех рассматриваемых случаях составляет величину равную p — 66,4 % SO 3 , что соответствует 81,34 % серной кислоте. Согласно уравнению реакции при моносульфировании 1 кг-моля бензола расходуется 1кг-моль сульфотриоксида:
С 6 Н 6 + SO 3 = С 6 Н 5 SO 3 H
Исходя из полученных расчетов можно найти количество отработанной серной кислоты. Так при использовании 92% серной кислоты останется 228 кг отработанной кислоты (308 – 80 = 228). Это является типичным примером составления материального баланса химического процесса. Результаты расчета представлены в таблице:
Количество отработанной кислоты с концентрацией p , кг
Как видно из приведенных в таблице результатов при использовании реагентов с большим содержанием SO 3 количество отработанной серной кислоты уменьшается. При использовании моногидрата количество отходов уменьшается по сравнению с 92% кислотой более чем вдвое.
Однако, уже при использовании 20% олеума, наблюдается побочный процесс образования сульфонов, которые не находят квалифицированного применения. Для снижения количества сульфонов, как следует из уравнения 5, добавляют сульфат натрия.
ArSO 3 H + SO 3 ® ArSO 2 + + HSO 4 —
ArSO 2 + + С 6 Н 6 ® Ar-SO 2 -Ar
При разработке регламента производства необходимо экспериментально подбирать концентрацию сульфирующего агента. Однако всегда имеется определенное количество отработанной кислоты, что осложняет экологическую обстановку. Укрепление отработанной кислоты олеумом экономически нецелесообразно и чаще всего приходится нейтрализовать кислоту мелом с получением гипса, или отправлять ее на станцию нейтрализации и далее на биоочистку.
Изомерный состав продуктов зависит как от концентрации SO 3 в сульфирующем агенте, так и от температуры. Наиболее отчетливо это проявляется при сульфировании нафталина. Взаимодействие нафталина с олеумом при температуре 80 0 С в основном приводит к получению 1-нафталинсульфокислоты, проведение реакции при 120 0 С в 96% серной кислоте дает 2-нафталинсульфокислоту.
Электронная плотность в a -положении нафталина выше, чем в b -положении, поэтому первоначально атака сульфирующего агента осуществляется по a -положению цикла. Это можно представить на молекулярной диаграмме реакции. Из-за малых величин энергии активации при образовании p -комплексов, они на диаграмме опущены.




 |
Энергетическая диаграмма реакции сульфирования
1 – сульфирование в положение 1 нафталина
2 — сульфирование в положение 2 нафталина
 |
Из приведенной диаграммы видно, что свободная энергия активации в первом случае меньше, чем во втором. Следовательно, константа скорости реакции k 1 > k 2 . Однако реакция обратима, а свободная энергия 2-нафталинсульфокислоты меньше, чем a -изомера (см. энергетическую диаграмму реакции). Поэтому при повышении температуры происходит накопление в реакционной массе b -изомера. Исследование кинетики реакции с помощью 35 S серной кислоты показало, что превращение a -изомера в b -изомер происходит как межмолекулярно с десульфированием, так и внутримолекулярно за счет 1,2-сдвига. Сульфирование олеумом при низкой температуре идет при кинетическом контроле реакции, а серной кислотой при более высокой температуре при термодинамическом контроле.
Сульфирование толуола при различных температурах дает преимущественно о-, м- или п- толуолсульфокислоты, или их смесь. Результаты представлены в таблице 2.
Сульфирование толуола. Табл. 2.
Температура, 0 С
Изомерный состав, %
65 — 72% H 2 SO 4
98% H 2 SO 4 , NaHSO 4
* азеотропная отгонка воды с толуолом, избыток толуола.
Проведение реакции при кинетическом контроле (96% H 2 SO 4 , 40 0 С) приводит в основном к получению о- изомера, который может быть использован для синтеза сахарина. При избытке толуола, или в присутствии гидросульфата натрия в основном образуется п- толуолсульфокислота, из которой получают п- крезол. При термодинамическом контроле образуется в основном м- толуолсульфокислота.
СУЛЬФИРОВАНИЕ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ
В настоящее время наиболее многотоннажным производством является получение алкилбензолсульфонатов (АБС), общей формул: С n H 2 n +1 C 6 H 4 — SO 3 Na ( n ³ 10), которые используются в качестве анионных поверхностно-активных веществ (ПАВ). Ожидается, что в мире в 2000 г. будет произведено до 2,7 млн. т. АБС. Огромный масштаб производства диктует то, что сульфирование должно быть практически безотходным и процесс непрерывным. Сульфирование даже высокопроцентным олеумом неприемлемо, так как на 1 т. АБС образуется 1,5 т. 70% серной кислоты и в полученной реакционной массе содержится до 15% кислоты, нейтрализация которой при получении сульфоната приводит к повышенному расходу гидроксида натрия.
Имеется два варианта производства АБС – сульфирование газообразным SO 3 и жидкой смесью SO 2 и SO 3 . При сульфировании протекают следующие процессы:
Первая стадия — образование пиросульфокислоты идет с большой скоростью, скорость второй на порядок ниже (0,03 л моль -1 с -1 ). Основной примесью являются сульфоны. При длине углеродной цепочки 10 – 14 атомов их выход составляет менее 1%.
Также практическое значение имеет синтез и 1,3-бензолдисульфокислоты для получения резорцина, использующегося при лечении некоторых кожных заболеваний. Сульфирование бензола осуществляют в две стадии. На первой стадии сульфируют бензол 98-100% серной кислотой при 50-60 0 С, а затем добавляют 60% олеум и нагревают до 80 0 С. Лучшие результаты получены при сульфировании 65% олеумом в присутствии сульфата натрия для предотвращения образования сульфонов. Расход сульфирующего агента снижается, дисульфокислоту не выделяют и используют в виде 60% водного раствора для последующего проведения щелочного плавления.
Хлорбензол сульфируют моногидратом при 80-100 0 С, сульфокислоту не выделяют и в том же растворе проводят нитрование с получением 3-нитро-4- хлорбензолсульфокислоты.
Как отмечалось в разделе 2.3.1., 3-нитробезолсульфокислоту получают сульфированием нитробензола. Реакцию проводят при 100-110 0 С в 65% олеуме, образуется только один изомер. Полученный продукт используют в синтезе метаниловой кислоты ( м -аминобензолсульфокислоты). Сульфирование п -нитротолуола олеумом 90-100 0 С дает 4-нитро-2-толуолсульфокислоту, из которой получают красители.
Сульфирование ариламинов
С ульфирование ариламинов во многом отличается от других ароматических соединений. П ервой стадией получения препарата прозерин является сульфирование диметиланилина. Уже в 92% серной кислоте диметиланилин ионизирован на 100%. При этом неподеленная электронная пара в нем блокирована протоном, нет ее сопряжения с ароматическим циклом. Диметиламмониевая группа становится электроноакцепторным заместителем, ориентирующем электрофильный агент в м -положение бензольного ядра. Реакцию проводят в 18% олеуме при 60 – 66 0 С.
Столь жесткие условия реакции диктуются тем, что электронная плотность в м- положении ниже, чем в нитробензоле. Для получения о — или п- изомеров необходимо сульфировать ациланилиды с последующим снятием ацильной защиты. В этом случае протонирования аминогруппы не наблюдается. Ациламиногруппа ориентирует электрофильные агенты в о — и п- положение ароматического цикла. Однако так же, как и при нитровании солей аминов, можно избежать введения ацильной защиты.
Так при запекании сухого сульфата анилина, полученного из анилина и серной кислоты в бензоле, при 140 – 160 0 С образуется ортаниловая кислота ( о — аминобензолсульфокислота). При 180 – 190 0 С образуется сульфаминовая кислота ( п — аминобензолсульфокислота). Следует отметить, что реакция региоселективна, отходов практически нет. По одному из рассматриваемых механизмов реакции сульфат анилина вначале превращается в производное сульфаминовой кислоты Ph — NH — SO 3 H , внутримолекулярная перегруппировка которого дает сульфаниловую либо ортаниловую кислоты. Нельзя исключить и второй вариант — диссоциацию сульфата анилина на анилин и серную кислоту без выхода ее из клетки кристалла и затем сульфирование в о- или п- положение ароматического цикла. В настоящее время нет решительных доказательств, свидетельствующих о преобладании одного из них.
Видео:6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать

Аналогично получают 4-аминонафталин-1-сульфокислоту, 2-аминонафталин-6-сульфокислоту и 1-аминоантрахинон-2-сульфокислоту.
ТЕХНОЛОГИЧЕСКИЕ АСПЕКТЫ СУЛЬФИРОВАНИЯ
Тепловой эффект реакции составляет 121 – 168 кДж/моль. При сульфировании серной кислотой также как и при нитровании, выделяется вода, то есть наблюдается выделение тепла за счет разбавления серной кислоты. Однако скорость реакции сульфирования намного ниже, чем нитрования. Поэтому процесс сульфирования проводят при нагревании реакционной массы паром через рубашку. Из-за низкой скорости реакции «теплового взрыва» не происходит. При периодическом способе производства реакцию ведут в сульфураторах – чугунных или стальных аппаратах, снабженных якорной или рамной мешалкой, рубашкой для нагревания и охлаждения, загрузочными отверстиями, трубой для передавливания реакционной массы, гильзой термометра и пробоотборника.
Окончание реакции определяют по отсутствию исходного субстрата в отобранной пробе. Самым простым способом является растворение пробы в воде. Отсутствие эмульсии или суспензии означает, что реакция закончена, так как сульфокислоты растворимы в воде.
Оригинальным технологическим решением является сульфирование бензола или толуола в парах. Субстрат реакции испаряют в теплообменнике и пропускают через нагретую серную кислоту. При этом часть его сульфируется и сульфокислота остается в реакционной массе. Большая доля субстрата в виде азеотропной смеси улетает, пары конденсируют в теплообменнике и в делительной воронке непрерывного действия отделяют воду. Азеотропная смесь содержит 25% воды и 75% бензола. Таким образом, из реакционной массы непрерывно удаляется вода и концентрация серной кислоты поддерживается около 90%. Реакцию проводят до тех пор, пока в реакционной массе не останется 3 — 4% серной кислоты. Полное использование кислоты нецелесообразно из-за образования дифенилсульфона. Сырой бензол промывают водой и щелочью и возвращают в реакцию. Этот способ ценен тем, что существенно уменьшается количество отработанной серной кислоты. Недостатком способа является большое количество обращающейся в производстве легко воспламеняющейся жидкости (ЛВЖ).
Получение сульфаниловой кислоты ранее проводили с помощью «сухого запекания» на противнях или в трубчатых печах. В настоящее время реакцию проводят в обычном емкостном аппарате. Смешивают эквимольное количество серной кислоты и анилина в полихлорбензолах. Процесс ведут с непрерывной азеотропной отгонкой воды.
Сложной технологической операцией является выделение сульфокислот. После окончания реакции сульфомассу выливают или передавливают на воду, частично нейтрализуют и высаливают с помощью добавлений сульфата или сульфита натрия. Осадок натриевой соли сульфокислоты отфильтровывают.
В тех случаях, когда высаливание не помогает, сульфокислоту приходится выделять в виде труднорастворимых солей металлов. Если и этот способ не дает результата, то используют более сложную операцию. Реакционную массу нейтрализуют известью или мелом. Кальциевые соли сульфокислот растворимы в воде, а сульфат кальция (гипс) выпадает в осадок, его отфильтровывают. Водный фильтрат обрабатывают содой, мел выпадает в осадок, его отделяют. Водный фильтрат натриевой соли сульфокислоты упаривают досуха. Этот способ используют при получении прозерина, приведенный на схеме. Полученную натриевую соль 3- N , N — диметиламинобензолсульфокислоты направляют на щелочное плавление.
Оригинальное технологическое решение используется в России для получения АБС. Сульфирование осуществляют смесью диоксида (85%) и триоксида серы (15%). Жидкая сульфирующая смесь поступает вместе с алкилбензолом в низ колонны, температура процесса 2… -2 0 С. Алкибензолсульфокислота, содержащая до 2% диоксида серы, непрерывно вытекает из колонны и далее нагревается до 40 0 С. Удаляющийся газообразный диоксид смешивается с уходящим из колонны и направляется на окисление в конвертор. Газообразный 100% SO 2 смешивается с кислородом, окисляется и конденсируется. Конденсат вновь направляется на сульфирование. Таким образом удается получить продукт высокого качества и в процессе практически полностью отсутствуют отходы. Алкилбензолзульфокислота передается на стадию нейтрализации.
РЕАКЦИИ С ХЛОРСУЛЬФОНОВОЙ КИСЛОТОЙ, СУЛЬФОХЛОРИРОВАНИЕ
Хлорсульфоновая кислота (ХСК) является одним из сульфирующих агентов. Использование ХСК в апротонных растворителях приводит к результатам, отличающимся от сульфирования серной кислотой или олеумом. Так, при взаимодействии анилина, N -алкиланилинов с эквимолекулярным количеством ХСК в о- дихлорбензоле при 130-140 0 С образуются в основном п- сульфокислоты, с N , N -диалкиланилинами при 50 — 80 0 С п- изомер получен с 90% выходом. Недостатком сульфирования с помощью ХСК является то, что в процессе реакции выделяется хлористый водород. Кроме того, ХСК дороже серной кислоты и олеума.
Однако в промышленном синтезе ХСК используется в основном для получения сульфохлоридов. Реакция хлорсульфирования идет в две стадии, первая из которых – сульфирование. При этом частично образуется и сульфохлорид. Вторая стадия включает в себя обмен гидроксигруппы сульфокислоты на атом хлора с ХСК:
Таким образом формально можно записать следующее уравнение:
Но вторая реакция обратима, для сдвига реакции вправо необходим 5-5.5 кратный избыток хлорсульфоновой кислоты.
Реакция сульфохлорирования является основной при получении ряда препаратов:
сахарин пантоцид хлорамин Б
Препарат пантоцид получают из п- толуолсульфохлорида и используют для обеззараживания воды и ран в полевых условиях. Из о- изомера синтезируют сахарин, являющийся классическим подсластителем. При хлорсульфировании толуола при температуре 0 – 5 0 С в основном образуется о- изомер, при 60 — 70 0 С с добавкой NaCl получают до 80% п- изомера. Разделение изомеров осуществляют ректификацией. Хлорамин Б применяют в качестве дезинфицирующего средства, производят из бензолсульфамида. В химико-фармацевтической промышленности наиболее важным производством, в котором используют реакцию хлорсульфирования, является получение сульфаниламидных препаратов, их структура и применение представлены в таблице.
Видео:6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать

Сульфирование бензола: строение, свойства и структурная формула
Сульфирование бензола, а также других ароматических углеводородов – одна из важнейших реакций в органической химии, так как ее продукты находят широкое промышленное применение. Для получения сульфокислот бензол обрабатывают серной кислотой или олеумом. Сульфирование может также проводиться ступенчато для создания нескольких функциональных групп.
Видео:Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать

Принцип сульфирования
Сульфирование бензола представляет собой введение сульфогруппы SO3H – замещение ею атома водорода в органическом соединении. В результате полученные вещества приобретают кислотные свойства и становятся растворимыми в воде. В дальнейшем, путем отщепления сульфогруппы, можно синтезировать другие соединения – аминобензол (анилин), галогенобензол, нитробензол, гидроксибензол (фенол).
Этому процессу подвергают не только сами углеводороды, но и их производные. Гомологичные соединения бензола (толуол и ксилол) сульфируются легче, а наиболее активно данная реакция проходит с анилином и фенолом.
Реакция сульфирования бензола, наряду с нитрированием, является одной из наиболее характерных для ароматических углеводородов. Замещение водорода у таких веществ протекает гораздо легче, чем у алифатических органических соединений.
Видео:Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать

Сульфирующие агенты
В качестве сульфирующих агентов могут применяться следующие вещества:
- серная кислота H2SO4 в различной концентрации;
- олеум (дымящая серная кислота);
- хлорсульфоновая кислота – HSO₃Cl;
- серный ангидрид;
- купоросное масло (H2SO4 в концентрации 93% и более);
- моногидрат серной кислоты;
- сульфурилхлорид SO₂Cl₂;
- щелочные соли сернистой кислоты;
- полисульфаты;
- кислые соли серной кислоты.
Наиболее часто в механизме сульфирования бензола применяется олеум – раствор SO3 в стопроцентной серной кислоте. Сорта олеума подбираются такие, у которых концентрация триоксида серы составляет около 65%, так как данные составы остаются жидкими при обычных условиях. При использовании этого вещества механизм реакции сульфирования бензола происходит с высокой скоростью.
Видео:12.4. Анилин: Строение, химические свойства, способы получения. ЕГЭ по химииСкачать

Процесс сульфирования: описание
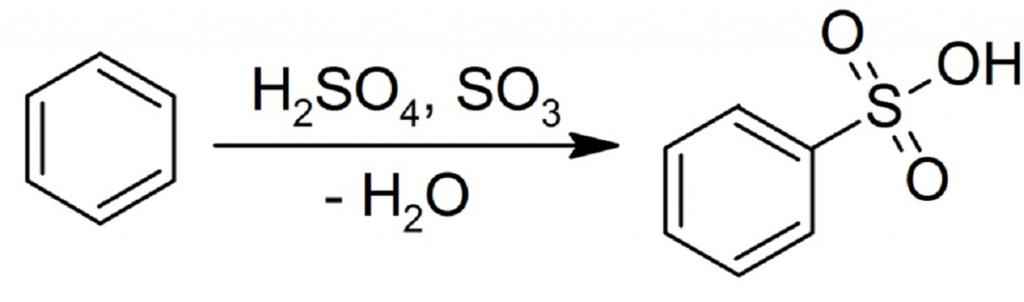
Реакция бензола с олеумом происходит так:
Структурно порядок реакции сульфирования бензола выглядит следующим образом:
Целевым продуктом являются сульфокислоты. При обработке 92-94% серной кислотой их выход составляет 90-96%.
Сульфирование при 3-кратном избытке концентрированной серной кислоты протекает по следующей схеме:
Так как процесс идет медленно (хотя при этом выделяется тепло), то требуется нагревание.
К недостаткам сульфирования бензола серной кислотой относят:
- небольшая концентрация электрофилов;
- быстрое падение скорости реакции при разбавлении кислоты водой;
- агрессивность реакционной среды;
- необходимость применения нейтрализующих реагентов, большое количество отходов (экологический аспект).
Видео:Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Свойства продукта
Химические свойства бензола при сульфировании характеризуются следующими особенностями:
- бесцветное или светло-желтое легкоплавкое кристаллическое вещество с резким запахом;
- хорошая растворимость в воде, практически полная диссоциация;
- высокая поглощающая способность в отношении паров воды, на воздухе кристаллы расплываются;
- ярко выраженный кислотный характер;
- соединение разлагается водой с выделением токсичных газов;
- пары тяжелее воздуха;
- константа кислотности – в пределах 5,0-8,0.
Одно из наиболее важных свойств сульфокислот – их способность обменивать сульфогруппу на другие функциональные группы, непосредственное введение которых в структуру ароматических углеводородов является затруднительным.
Видео:Получение бензола и его гомологов. 2 часть. 11 класс.Скачать

Введение нескольких сульфогрупп
Замещение двух или трех атомов водорода проводится ступенчато, путем поэтапного изменения следующих параметров:
- сульфирующий агент;
- концентрация или количество этого вещества;
- температура.
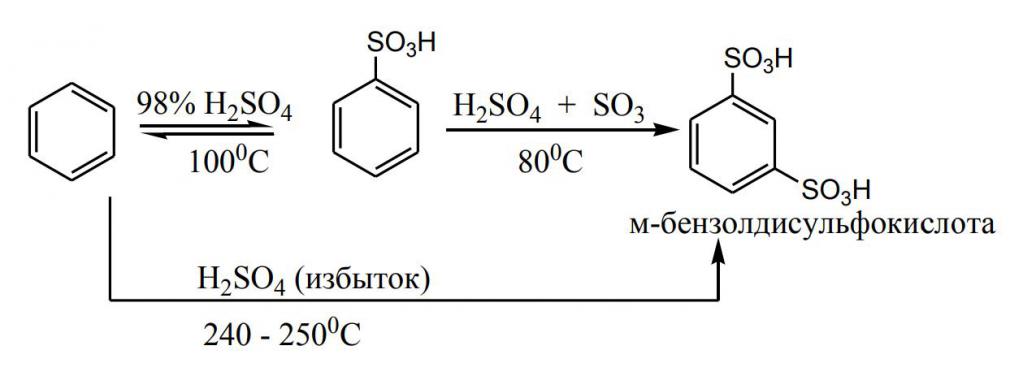
Получение мета-бензолдисульфокислоты производится в 2 стадии:
- Сульфирование C6H6 концентрированной кислотой H2SO4, в результате чего образуется моносульфокислота.
- Обработка продукта предыдущей реакции избытком 20% олеума при температуре 100 о С (или 60% при 60-80 о С). Так как первичное введение сульфогруппы значительно замедляет последующее сульфирование (примерно в 10 000 раз), то вторая реакция проводится в более жестких условиях.
Дальнейшее сульфирование до 3- и 5-бензолсульфокислоты возможно только при воздействии олеумом в 60% концентрации при температуре 250 о С в присутствии катализатора – сульфата ртути.
В обычных условиях реакция сульфирования является обратимой, но если используется олеум с высоким содержанием ангидрида, то процесс становится необратимым. То же наблюдается при обработке бензола хлорсульфоновой кислотой.
Видео:Реакция сульфонированияСкачать
Влияние температуры
Повышение температуры при сульфировании бензола не только увеличивает скорость течения реакции, но и приводит к образованию побочных продуктов: полисульфокислот, сульфонов, окислов. При нагреве выше 160 °С отмечается появление дисульфокислот.
Поэтому каждая реакция должна проводиться при определенной температуре. От нее также зависит место присоединения группы SO3H (региоселективность) в ароматических углеводородах.
Видео:Получение бензола и его гомологов. 1 часть. 11 класс.Скачать

Сульфирование «в парах»
В производственных условиях одним из самых экономичных методов получения бензолсульфокислоты является проведение реакции в «парах». Эта технология позволяет сократить потребность H2SO4 почти в 2 раза, по сравнению с процессом, при котором используется жидкая фаза этого вещества. К недостаткам реакции относится снижение скорости сульфирования.
Устранение недостатков, связанных с применением H2SO4 в жидком состоянии, возможно путем удаления воды из реакционной массы или применением олеума (повышением концентрации SO3).
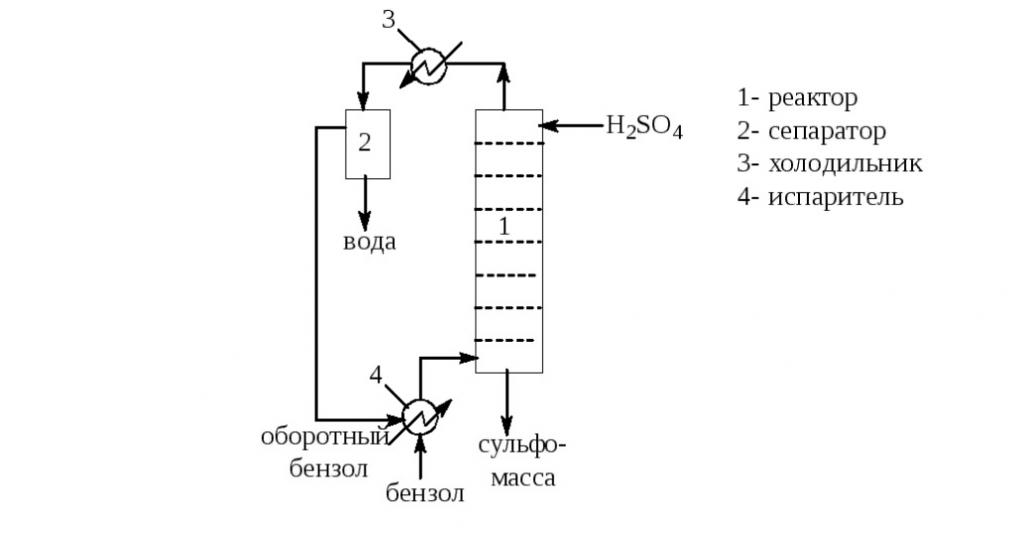
Технология сульфирования бензола в этом случае протекает следующим образом:
- Бензол из емкости подают в трубную обвязку испарителя при помощи насоса. В этом устройстве вещество нагревается паром, проходящим по внешним трубам. Затем пары доводят до t=150 °С.
- Бензол в парообразном состоянии в избытке подают в реактор, где он проходит через слой концентрированной серной кислоты при температуре 150 °С.
- В холодильнике C6H6 и H2O конденсируются и охлаждаются до температуры 30 °С.
- В сепараторе происходит расслоение смеси, а оборотный бензол возвращают на сульфирование.
Остатки бензола в сульфомассе удаляют при помощи отдувки воздухом. Затем смесь поступает на нейтрализацию в аппарат, облицованный внутри кислотоупорной плиткой. Эта реакция проводится при участии водного раствора Na₂SO₃. После обработки массу направляют в колонну для устранения диоксида серы. Полученный продукт используют для получения фенола с помощью щелочного плавления (в настоящее время этот процесс утратил промышленное значение, фенол синтезируют из изопропилбензола) или упаривают до сухого остатка бензолсульфоната натрия.
Видео:Механизм электрофильного ароматического замещенияСкачать
Другие способы
Применяют и другие методики сульфирования бензола:
- Жидкий углеводород пропускают противотоком сквозь слой H2SO4. Полученный продукт растворяют сначала в бензоле, а потом вымывают водой.
- Сульфирование олеумом слабой концентрации при повышенной температуре 190-250 °С и давлении 1-3 МПа. Появление побочных продуктов подавляется путем введения бензолсульфоната натрия.
Видео:Бензол - представитель ароматических углеводородов | Химия 10 класс #19 | ИнфоурокСкачать

Выделение сульфокислот
Так как продукты реакции хорошо растворимы, их выделение производят в виде солей. Для этого в сульфомассу, при постоянном помешивании, вводят нейтрализующие агенты, в качестве которых применяют следующие вещества:
Выделение свободных сульфокислот производят при реакции с ионнообменными смолами или подкислением хлороводородом.
📸 Видео
Механизм электрофильного замещения в ароматическом рядуСкачать

НитрированиеСкачать

Ароматические углеводороды. Бензол | Органическая химия ЕГЭ, ЦТСкачать

Несколько заместителейСкачать

6.2. Ароматические углеводороды (бензол и его гомологи): Способы получения. ЕГЭ по химииСкачать

5.1. Циклоалканы: Строение, изомерия. ЕГЭ по химииСкачать

ГАЛОГЕНИРОВАНИЕ БЕНЗОЛА, ФЕНОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать
НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать

Химические свойства бензола: алкилирование по Фриделю-КрафтсуСкачать






















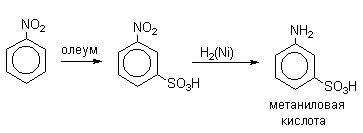







 (уравнение 1)
(уравнение 1)