156-157

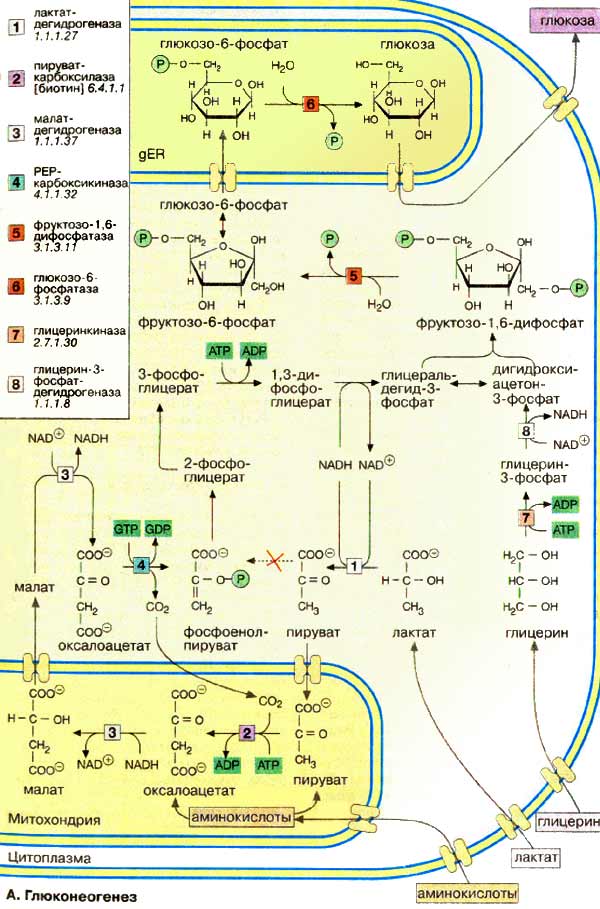
Многие реакции глюконеогенеза катализируются теми же ферментами, что и процессы гликолиза (см. с. 152). Некоторые ферменты специфичны для глюконеогенеза и синтезируются только по мере необходимости под воздействием кортизола и гпюкагона (см. с. 160). На схеме представлена только эта группа ферментов. В то время как гликолиз протекает в цитоплазме, глюконеогенез происходит также в митохондриях и эндоплазматическом ретикулуме.
Первые стадии реакционной цепи протекают в митохондриях. Причиной такого «обходного» пути является неблагоприятная константа равновесия пируваткиназной реакции (см. с. 152). Для перевода пирувата непосредственно в фосфоенолпируват(PEP) недостаточно энергии расщепления АТФ. Пируват , образующийся из лактата или аминокислот, переносится в матрикс митохондрий и там карбоксилируется в оксалоацетат в биотинзависимой реакции, катализируемой пируваткарбоксилазой [ 2 ]. Оксалоацетат является промежуточным метаболитом цитратного цикла. Поэтому аминокислоты, которые включаются в цитратный цикл или конвертируются в пируват, могут непосредственно превращаться в глюкозу ( глюкогенные аминокислоты, см. с. 182).
Оксалоацетат, образующийся в митохондриальном матриксе, восстанавливается в малат [ 3 ]. который может переноситься в цитоплазму с помощью специальных переносчиков (см. с. 214). Оксалоацетат может также переноситься из митохондрии в цитоплазму после переаминирования в аспартат ( малатный челночный механизм , см. с. 206).
В цитоплазме малат вновь превращается цитоплазматической малатдегидрогеназой в оксалоацетат, который в реакции, катализируемой ГТФ-зависимой РЕР-карбоксикиназой [ 4 ], переводится в фосфоенолпируват . Последующие стадии до фруктозо-1,6-дифосфата представляют собой модификации соответствующих реакций гликолиза. При этом для образования 1,3-дифосфоглицерата дополнительно расходуется АТФ.
Две глюконеогенез-специфичные фосфатазы отщепляют по очереди фосфатные остатки от фруктозо-1,6-дифосфата . Промежуточной стадией является изомеризация фруктозо-6-фосфата в глюкозо-6-фосфат , одна из реакций гликолиза. Глюкозо-6-фосфатаза печени [ 5 ] является мембранным ферментом, локализованным внутри гладкого эндоплазматического ретикулума. Перенос глюкозо-6-фосфата в эндоплазматический ретикулум и возврат образующейся глюкозы в цитоплазму осуществляется специфическими переносчиками. Из цитоплазмы глюкоза поступает в кровь.
Глицерин прежде всего фосфорилируется [ 7 ] в положении 3. Образующийся 3-глицерофосфат окисляется НАД + -зависимой дегидрогеназой [ 8 ] в дигидроксиацетон-3-фосфат , который далее включается в глюконеогенез.
Видео:Цикл Кори(Глюкозо-Лактатный цикл)Скачать

БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ — Е. С. Северина — 2004
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

РАЗДЕЛ 7. ОБМЕН УГЛЕВОДОВ
IX. Ситез глюкозы в печени (глюконеогенез)
Некоторые ткани, например, мозг, нуждаются в постоянном поступлении глюкозы. Когда поступление углеводов в составе пищи недостаточно, содержание глюкозы в крови некоторое время поддерживается в пределах нормы за счёт расщепления гликогена в печени. Однако запасы гликогена в печени невелики. Они значительно уменьшаются к 6 —10 ч голодания и практически полностью исчерпываются после суточного голодания. В этом случае в печени начинается синтез глюкозы de novo — глюконеогенез.Глюконеогенез — процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80 — 100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот (см. раздел 8).
Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например, эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др.
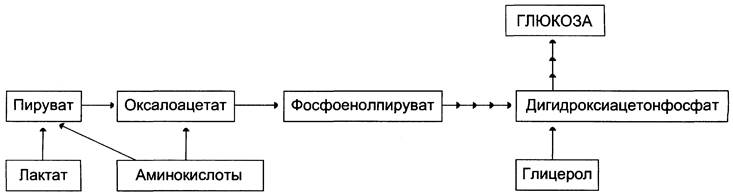
Первичные субстраты глюконеогенеза — лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
✵ Лактат — продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
✵ Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
✵ Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
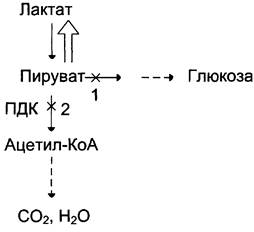
На рисунке 7-44 показаны пункты включения первичных субстратов в глюконеогенез.
Рис. 7-44. Включение субстратов в глюконеогенез.
А. Реакции глюконеогенеза
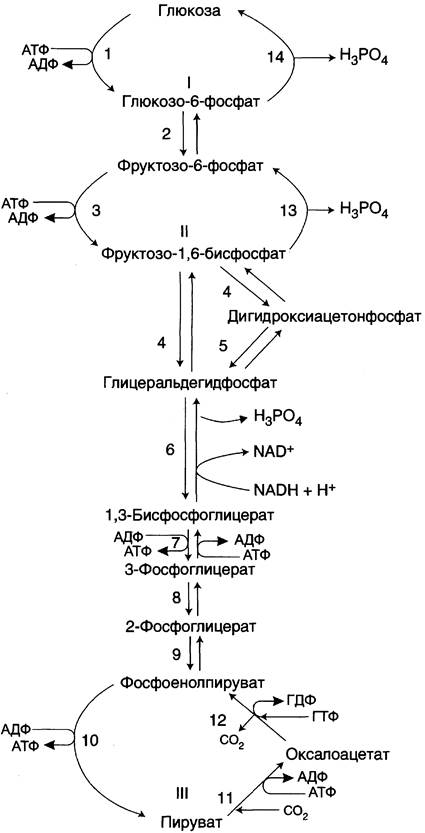
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза (рис. 7-45, реакции 9, 8, 7, 6, 5, 4, 2) и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями.
Рис. 7-45. Гликолиз и глюконеогенез. Ферменты обратимых реакций гликолиза и глюконеогенеза: 2 — фосфоглюкоизомераза; 4 — альдолаза; 5 — триозофосфатизомераза; 6 — глицеральдегидфосфатдегидрогеназа; 7 — фосфоглицераткиназа; 8 — фосфоглицератмутаза; 9 — енолаза. Ферменты необратимых реакций глюконеогенеза: 11 — пируваткарбоксилаза; 12 — фосфоенолпируваткарбоксикиназа; 13 — фруктозо- 1,6-бисфосфатаза; 14 — глюкозо-6-фосфатаза. I-III —субстратные циклы.
Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
Рассмотрим более подробно те реакции глюконеогенеза, которые отличаются от реакций гликолиза и происходят в глюконеогенезе с использованием других ферментов. Рассмотрим процесс синтеза глюкозы из пирувата.
1. Образование фосфоенолпирувата из пирувата — первая из необратимых стадий глюконеогенеза
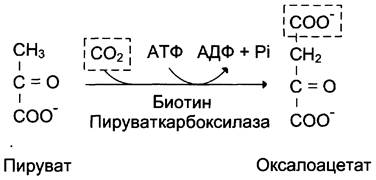
Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций (рис. 7-45, реакции 11, 12), первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата (рис. 7-46). Пируват- карбоксилаза,катализирующая данную реакцию, — митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Рис. 7-46. Образование оксалоацетата из пирувата.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата (рис. 7-47) при участии НАDН (обратная реакция цитратного цикла). Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма, рассмотренного ранее (рис. 7-39).
Рис. 7-47. Превращение оксалоацетата в малат.
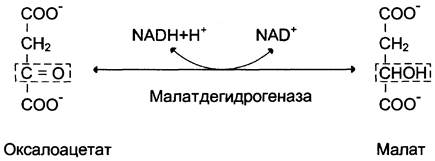
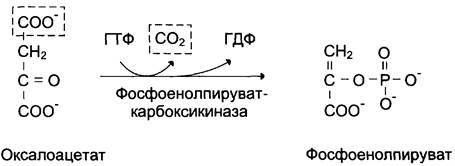
В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD + . Обе реакции: восстановление оксалоацетата и окисление малата катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором — цитозольный. Образованный в цитозоле из малата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой — ГТФ-зависимым ферментом (рис. 7-48). Название фермента дано по обратной реакции.
Рис. 7-48. Превращение оксалоацетата в фосфоенолпируват.
Схема всех реакций, протекающих на первой необратимой стадии глюконеогенеза, представлена на рис. 7-49.
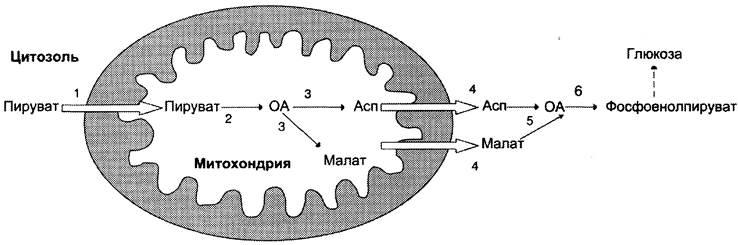
Рис. 7-49. Образование оксалоацетата, транспорт в цитозоль и превращение в фосфоенолпируват. 1 — транспорт пирувата из цитозоля в митохондрию; 2 — превращение пирувата в оксалоацетат (ОА); 3 — превращение ОА в малат или аспартат; 4 — транспорт аспартата и маната из митохондрии в цитозоль; 5 — превращение аспартата и маната в ОА; 6 — превращение ОА в фосфоенолпируват.
Следует отметить, что этот обходной участок глюконеогенеза требует расхода двух молекул с макроэргическими связями (АТФ и ГТФ) в расчёте на одну молекулу исходного вещества — пирувата. В пересчёте на синтез одной молекулы глюкозы из двух молекул пирувата расход составляет 2 моль АТФ и 2 моль ГТФ или 4 моль АТФ (для удобства рассуждений предлагается считать, что энергозатраты на синтез АТФ и ГТФ равны). После образования фосфоенолпирувата все остальные реакции также
протекают в цитозоле вплоть до образования фруктозо-1,6-бисфосфата и катализируются гликолитическими ферментами.
2. Гидролиз фруктозо-1,6-бисфосфата и глюкозо-6-фосфата
Отщепление фосфатной группы из фруктозо-1,6-бисфосфата и глюкозо-6-фосфата — также необратимые реакции глюконеогенеза. В ходе гликолиза эти реакции катализируют специфические киназы с использованием энергии АТФ. В глюконеогенезе они протекают без участия АТФ и АДФ и ускоряются не киназами, а фосфатазами — ферментами, принадлежащими к классу гидролаз. Ферменты фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза катализируют отщепление фосфатной группы от фруктозо-1,6-бисфосфата и глюкозо-6-фосфата. После чего свободная глюкоза выходит из клетки в кровь. Схема всех реакций глюконеогенеза представлена на рис. 7-45.
Итак, в печени существуют 4 фермента, которые принимают участие только в глюконеогенезе и катализируют обходные реакции необратимых стадий гликолиза. Это — пируват- карбоксилаза, фосфоенолпируваткарбоксикиназа, фруктозо-1,6-бисфосфатаза и глюкозо-6- фосфатаза.
3. Энергетический баланс глюконеогенеза из пирувата
В ходе этого процесса расходуются 6 моль АТФ на синтез 1 моль глюкозы из 2 моль пирувата. Четыре моль АТФ расходуются на стадии синтеза фосфоенолпирувата из оксалоацетата и ещё 2 моль АТФ на стадиях образования 1,3-бисфосфоглицерата из 3-фосфоглицерата.
Суммарный результат глюконеогенеза из пирувата выражается следующим уравнением:
2 Пируват + 4 АТФ + 2 ГТФ + 2 (NАDН + Н + ) + 4 Н2O —> Глюкоза + 4 АДФ + 2 ГДФ + 6 Н3РO4 + 2 NАD + .
Б. Синтез глюкозы из лактата
Лактат, образованный в анаэробном гликолизе, не является конечным продуктом метаболизма. Использование лактата связано с его превращением в печени в пируват. Лактат как источник пирувата важен не столько при голодании, сколько при нормальной жизнедеятельности организма. Его превращение в пируват и дальнейшее использование последнего являются способом утилизации лактата.
Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NАDН/NАD + ниже, чем в сокращающейся мышце, поэтому лакгатдегидрогеназная реакция протекает в обратном направлении, т. е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту
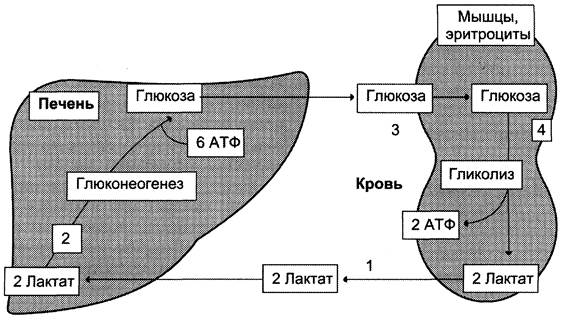
последовательность событий называют «глюкозо-лактатным циклом», или «циклом Кори» (рис. 7-50). Цикл Кори выполняет 2 важнейшие функции: 1 — обеспечивает утилизацию лактата; 2 — предотвращает накопление лактата и, как следствие этого, опасное снижение pH (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СO2 и Н2O. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Рис. 7-50. Цикл Кори (глюкозо-лактатный цикл). 1 — поступление лактата из сокращающейся мышцы с током крови в печень; 2 — синтез глюкозы из лактата в печени; 3 — поступление глюкозы из печени с током крови в работающую мышцу; 4 — использование глюкозы как энергетического субстрата сокращающейся мышцей и образование лактата.
Лактоацидоз. Термин «ацидоз» обозначает увеличение кислотности среды организма (снижение pH) до значений, выходящих за пределы нормы. При ацидозе либо увеличивается продукция протонов, либо происходит снижение их экскреции (в некоторых случаях и то и другое). Метаболический ацидоз возникает при увеличении концентрации промежуточных продуктов обмена (кислотного характера) вследствие увеличения их синтеза или уменьшения скорости распада или выведения. При нарушении кислотно-основного состояния организма быстро включаются буферные системы компенсации (через 10 — 15 мин). Лёгочная компенсация обеспечивает стабилизацию соотношения НСO3 — /Н2СO3, которая в норме соответствует 1:20, а при ацидозе уменьшается. Лёгочная компенсация достигается увеличением объёма вен
тиляции и, следовательно, ускорением выведения СO2 из организма. Однако основную роль в компенсации ацидоза играют почечные механизмы с участием аммиачного буфера (см. раздел 9). Одной из причин метаболического ацидоза может быть накопление молочной кислоты. В норме лактат в печени превращается обратно в глюкозу путём глюконеогенеза либо окисляется. Кроме печени, другим потребителем лактата служат почки и сердечная мышца, где лактат может окисляться до СO2 и Н2O и использоваться как источник энергии, особенно при физической работе.
Уровень лактата в крови — результат равновесия между процессами его образования и утилизации. Кратковременный компенсированный лактоацидоз встречается довольно часто даже у здоровых людей при интенсивной мышечной работе. У нетренированных людей лактоацидоз при физической работе возникает как следствие относительного недостатка кислорода в мышцах и развивается достаточно быстро. Компенсация осуществляется путём гипервентиляции.
При некомпенсированном лактоацидозе содержание лактата в крови увеличивается до 5 ммоль/л (в норме до 2 ммоль/л). При этом pH крови может составлять 7,25 и менее (в норме 7,36-7,44).
Повышение содержания лактата в крови может быть следствием нарушения метаболизма пирувата (рис. 7-51).
Рис. 7-51. Нарушения метаболизма пирувата при лактоацидозе. 1 — нарушение использования пирувата в глюконеогенезе; 2 — нарушение окисления пирувата.
Так, при гипоксии, возникающей вследствие нарушения снабжения тканей кислородом или кровью, уменьшается активность пируватдегидрогеназного комплекса и снижается окислительное декарбоксилирование пирувата. В этих условиях равновесие реакции пируват лактат сдвинуто в сторону образования лактата. Кроме того, при гипоксии уменьшается синтез АТФ, что, следовательно, ведёт к снижению скорости глюконеогенеза — другого пути утилизации лактата. Повышение концентрации лактата и снижение внутриклеточного pH отрицательно влияют на активность всех ферментов, в том числе и пируваткарбоксилазы, катализирующей начальную реакцию глюконеогенеза.
Возникновению лактоацидоза также способствуют нарушения глюконеогенеза при печёночной недостаточности различного происхождения. Кроме того, лактоацидозом может сопровождаться гиповитаминоз В1, так как производное этого витамина (тиаминдифосфат) выполняет коферментную функцию в составе ПДК при окислительном декарбоксилировании пирувата (см. раздел 6). Дефицит тиамина может возникать, например, у алкоголиков с нарушенным режимом питания.
Итак, причинами накопления молочной кислоты и развития лактоацидоза могут быть:
✵ активация анаэробного гликолиза вследствие тканевой гипоксии различного происхождения;
✵ поражения печени (токсические дистрофии, цирроз и др.);
✵ нарушение использования лактата вследствие наследственных дефектов ферментов глюконеогенеза, недостаточности глюкозо-6-фосфатазы;
✵ нарушение работы ПДК вследствие дефектов ферментов или гиповитаминозов;
✵ применение ряда лекарственных препаратов, например, бигуанидов (блокаторы глюконеогенеза, используемые при лечении сахарного диабета).
В. Синтез глюкозы из аминокислот
В условиях голодания часть белков мышечной ткани распадается до аминокислот, которые далее включаются в процесс катаболизма. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты нитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как нитратного цикла, так и глюконеогенеза.
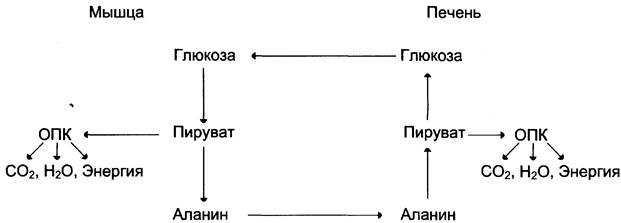
Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюконеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах —> пируват в мышцах —> аланин в мышцах —> аланин в печени —> глюкоза в печени —> глюкоза в мышцах (рис. 7-52). Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
Рис. 7-52. Глюкозо-аланиновый цикл.
Г. Синтез глюкозы из глицерола
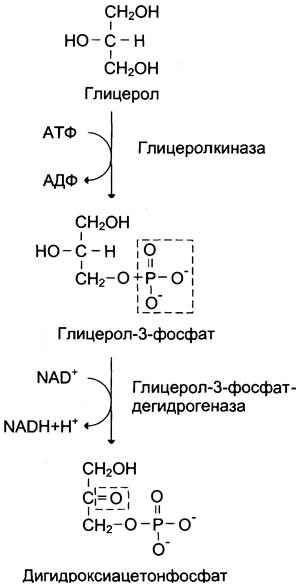
Глицерол образуется при гидролизе триацил- глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например, печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зaвисимой дегидрогеназой с образованием дигидроксиацетонфосфата (рис. 7-53), который далее превращается в глюкозу.
Рис. 7-53. Превращение глицерола в дигидроксиацетон- фосфат.
Биологическая библиотека — материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2018-2022 Все права на дизайн сайта принадлежат С.Є.А.
Видео:БИОХИМИЯ. ГЛЮКОНЕОГЕНЕЗ и всё, что нужно о нем знатьСкачать

Уравнения реакций синтеза глюкозы из лактата в печени
| Главная | Видео уроки | Книги |

|
|



![[биохимия] — ГЛИКОЛИЗ](https://i.ytimg.com/vi/EX5ZvvGQA5c/0.jpg)












