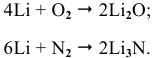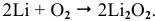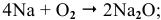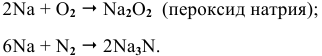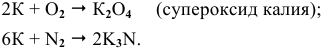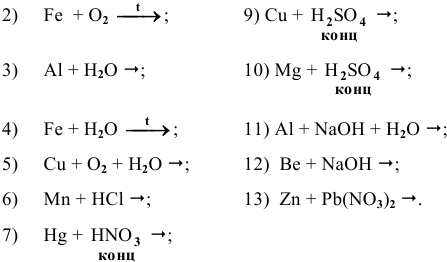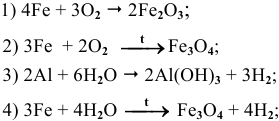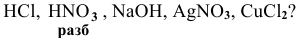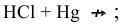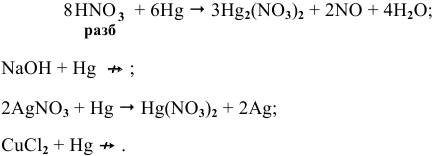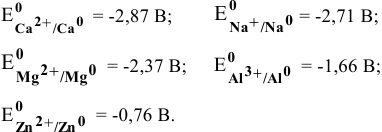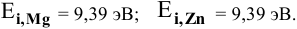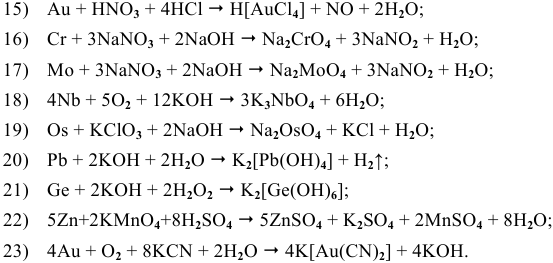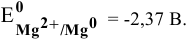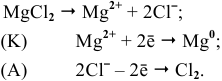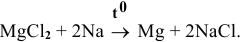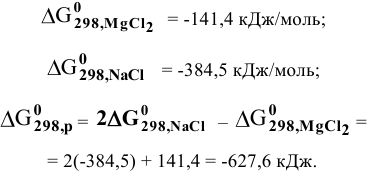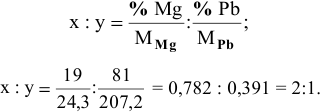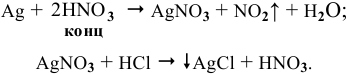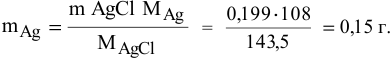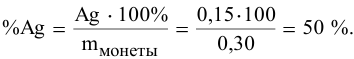О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
- Ряд активности металлов
- Общие химические свойства металлов
- Взаимодействие с неметаллами
- Взаимодействие с водой
- Взаимодействие с кислотами
- Взаимодействие с солями
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Взаимодействие металлов с оксидами
- Вопросы для самоконтроля
- Подведем итоги
- Задачи с решениями на химические свойства металлов
- Химические свойства металлов
- Задача 81
- Задача 82
- Задача 84
- Задача 85
- Задача 86
- Задача 87
- Задача 88
- 3. Общие химические свойства металлов
- Теория:
- 🔥 Видео
Ряд активности металлов
Металлы средней активности
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Видео:Все реакции с металлами за 1 урок | ЕГЭ по химии 2024 | Екатерина СтрогановаСкачать

Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Видео:Химические свойства металлов. 9 класс.Скачать

Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Видео:Серная кислота. Химические свойства. Реакции с металлами.Скачать

Задачи с решениями на химические свойства металлов
Химические свойства металлов
Задача 81
Написать уравнения реакций окисления следующих щелочных металлов: 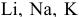
Решение:
Щелочные металлы стоят в начале ряда напряжений металлов. Являясь наиболее активными, они легко окисляются кислородом воздуха уже при обычных температурах. Однако для каждого из указанных металлов есть свои особенности. Литий уже при обычных температурах реагирует как с кислородом воздуха, так и со вторым компонентом воздуха — азотом, образуя, соответственно, оксид и нитрид лития:
При высоких температурах вместо оксида лития образуется пероксид лития:
Натрий: а) при обычной температуре —
б) при высоких температурах —
Калий: а) при обычной температуре — 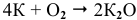
б) при высоких температурах —
Задача 82
Основываясь на знании общих химических свойств металлов, написать уравнения следующих химических реакций:

Решение:
5) Электрохимическая коррозия меди с кислородной деполяризацией:
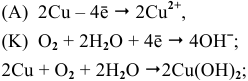
Задача 83
С какими из следующих веществ может реагировать ртуть:
Решение:
Задача 84
Среди металлов: 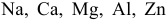
а) в водных средах;
б) в неводных средах.
Решение:
В водных средах количественной характеристикой восстановительных свойств металла является величина его электродного потенциала. Для изучаемых металлов величины стандартных электродных потенциалов следующие:
Наиболее низкий электродный потенциал у кальция, значит, он наиболее сильный восстановитель в водных средах, а наиболее высокий электродный потенциал у цинка, значит, он наиболее слабый восстановитель среди перечисленных металлов.
В неводных средах количественной характеристикой восстановительных свойств металла является величина его энергии ионизации.
Величины энергий ионизации изучаемых металлов находим в справочнике:
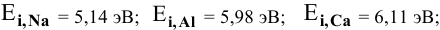
Наиболее низкая энергия ионизации (ионизационный потенциал) у натрия — самого сильного восстановителя из перечисленных металлов, наиболее высокая энергия ионизации у цинка — самого слабого восстановителя.
Задача 85
Составить и уравнять с помощью электронного баланса ОВ реакции.
Решение:
Ниже приводятся уравнения уже составленных и уравненных реакций:

Задача 86
Каким методом может быть получен металлический магний?
Решение:
Магний — это очень активный металл, его электродный потенциал
Значит, магний может быть получен не электролизом водных растворов солей магния, а электролизом расплавов его солей, например электролизом расплава 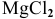
Магний также может быть получен металлотермией при использовании какого-либо металла, химическое сродство которого к атому, с которым он связан, выше, чем у магния, например:
Докажем возможность использования Na:
Так как 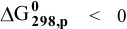
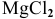
Задача 87
При смешивании расплавленных масс магния и свинца образуется интерметаллическое соединение, содержащее 81% РЬ. Какова его формула?
Решение:
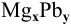
Таким образом, формула интерметаллического соединения — 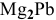
Задача 88
Для определения процентного содержания серебра в старой монете растворили 0,3 г этой монеты в концентрированной 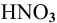
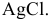
Решение:
Уравнения химических реакций, происходящих в ходе анализа, следующие:
Согласно уравнениям этих двух реакций, 1 моль 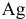
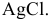
Рассчитаем массу серебра, соответствующую 0,199 г 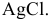
Вычислим процентное содержание серебра в монете:
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

3. Общие химические свойства металлов
Теория:
- благородные металлы (серебро, золото, платина);
- щелочные металлы (металлы, образованные элементами (I)А группы периодической системы);
- щелочноземельныеметаллы (кальций, стронций, барий, радий).
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H 2 | (Cu, Hg, Ag, Pt, Au) |