- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- №34 Селен
- История открытия:
- Нахождение в природе, получение:
- Физические свойства:
- Химические свойства:
- Важнейшие соединения:
- Применение:
- Биологическая роль и токсичность:
- Селен (Se) — общая характеристика и свойства химического элемента
- История элемента
- Нахождение в природе и получение
- Строение атома и структура
- Физические особенности
- Химические свойства
- Меры безопасности
- Сферы применения
- Значение для человека
- Полезные продукты
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

We are checking your browser. gomolog.ru
Видео:Взаимодействие гидроксида натрия с серной и кремниевой кислотойСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df971f70e6a0c81 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
№34 Селен
Видео:Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

История открытия:
Cелен открыт в 1817 году Йенсом Якобом Берцелиусом. Сохранился рассказ самого Берцелиуса о том, как произошло это открытие: » Я исследовал в содружестве с Готлибом Ганом метод, который применяют для производства серной кислоты в Грипсхольме. Мы обнаружили в серной кислоте осадок, частью красный, частью светло-коричневый. . Любопытство, вызванное надеждой обнаружить в этом коричневом осадке новый редкий металл, заставило меня исследовать осадок. . Я нашел, что масса (то есть осадок) содержит до сих пор неизвестный металл, очень похожий по своим свойствам на теллур. В соответствии с этой аналогией я назвал новое тело селеном (Selenium) от греческого selhnh (луна), так как теллур назван по имени Tellus — нашей планеты «.
qwertyuiop//asdfghjkl//zxcvbnm//
QWERTYUIOP//ASDFGHJKL//ZXCVBNM//
Видео:Реакция сульфата меди II ( медный купорос) с гидроксидом натрия ( щелочами)Скачать

Нахождение в природе, получение:
Содержание селена в земной коре около 500 мг/т. Селен образует 37 минералов, среди которых в первую очередь должны быть отмечены ашавалит FeSe, клаусталит PbSe, тиманнит HgSe, гуанахуатит Bi2(Se,S)3, хастит CoSe2, платинит PbBi2(S,Se)3. Изредка встречается самородный селен. Главное промышленное значение на селен имеют сульфидные месторождения. Содержание селена в сульфидах колеблется от 7 до 110 г/т. Концентрация селена в морской воде 4*10 -4 мг/л.
Селен получают из отходов сернокислотного, целлюлозно-бумажного производства , а также значительные количества получают из шлама медно-электролитных производств, в котором селен присутствует в виде селенида серебра. Применяют несколько способов получения селена из шлама: окислительный обжиг с возгонкой SeO2; окислительное спекание с содой, конверсия полученной смеси соединений селена до соединений Se(IV) и их восстановление до элементарного селена действием SO2.
Видео:Разбираем ВСЕ ОПЫТЫ с гидроксидами | ЕГЭ по химии | Катя СтрогановаСкачать

Физические свойства:
Разнообразие молекулярного строения обусловливает существование селена в разных аллотропных модификациях: аморфной (порошкообразный, коллоидный, стекловидный) и кристаллической (моноклинный, a— и b-формы и гексагональный g-форма). Аморфный (красный) порошкообразный и коллоидный селен получают при восстановлении из раствора селенистой кислоты, быстрым охлаждением паров селена. Стекловидный (черный) селен получают при нагревании любой модификации селена выше 220°С с последующим быстрым охлаждением. Он обладает стеклянным блеском, хрупок. Термодинамически наиболее устойчив гексагональный (серый) селен. Он получается из других форм селена нагреванием до плавления с медленным охлаждением до 180-210°С и выдержкой при этой температуре. Решетка его построена из расположенных параллельно спиральных цепочек атомов.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Химические свойства:
При обычной температуре селен устойчив к действию кислорода, воды и разбавленных кислот. При нагревании селен взаимодействует со всеми металлами, образуя селениды. В кислороде при дополнительном нагревании он медленно горит синим пламенем, превращаясь в диоксид SeO2.
С галогенами, за исключением йода, он реагирует при комнатной температуре с образованием соединений SeF6, SeF4, SeCl4, Se2Cl2 , SeBr4, и др. C хлорной или бромной водой селен реагирует по уравнению:
Se + 3Br2 + 4H2O = H2SeO4 + 6 HBr
Водород взаимодействует с селеном при t >200°С, давая H2Se.
В конц. H2SO4 на холоду селен растворяется , давая зеленый р-р, содержащий полимерные катионы Se8 2+ .
С водой при нагревании и в конц. растворах щелочей селен диспропорционирует:
3Se + 3H2O = 2H2Se + H2SeO3 и 3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O
образуя соединения селена(-2) и селена(+4).
Аналогично сере селен растворяется при нагревании в растворах Na2SO3 или KCN, образуя соответственно Na2SSeO3 (аналог тиосульфата) или KCNSe (аналог роданида).
Видео:Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Важнейшие соединения:
Для селена наиболее характерны степени окисления -2, +4, +6.
Оксид селена(IV) SeO2 — белые блестящие кристаллы с полимерной молекулой (SeOsub>2)sub>n , tпл. 350°С. Пары имеют желтовато-зеленый цвет и обладают запахом гнилой редьки Легко растворяется в воде с образованием H2SeO3.
Селенистая кислота, H2SeO3 — белые ромбические кристаллы.Обладает большой гигроскопичностью. Хорошо растворима в воде. Неустойчива, при нагревании выше 70°С распадается на воду и оксид селена(IV). Соли — селениты.
Селенит натрия, Na2SeO3 – бесцветные кристаллы, tпл. 711°С. Гигроскопичен, хорошо растворим в воде. При нагревании в инертной атмосфере разлагается на оксиды. При нагревании на воздухе окисляется до селената: 2Na2SeO3 + O2 = 2Na2SeO4
Оксид селена(VI) SeO3 — — бесцветные кристаллы, tпл. 121°С. Гигроскопичен, с водой реагирует с большим тепловыделением и образованием H2SeO4. Сильный окислитель, бурно реагирует с органическими веществами
Селеновая кислота, H2SeO4 — бесцветное кристаллическое вещество, хорошо растворимое в воде. Ядовита, гигроскопична, является сильным окислителем. Селеновая кислота — одно из немногих соединений, при нагревании растворяющих золото, образуя красно-желтый раствор селената золота(III).
2Au + 6H2SeO4 = Au2(SeO4)3 + 3H2SeO3 + 3H2O
Селенаты — соли селеновой кислоты. Селенат натрия Na2SeO4 — кристаллы ромбической сингонии; tпл. 730 °С. Получают нейтрализацией кислоты оксидом, гидроксидом или карбонатом натрия или окислением селенита натрия. Мало растворим в воде, ниже 32 °С кристаллизуется из водных растворов в виде декагидрата Na2SeO4·10H2O
Селеноводород, H2Se — бесцветный горючий газ с неприятным запахом. Самое токсичное соединение селена. На воздухе легко окисляется при обычной температуре до свободного селена. Также до свободного селена окисляется хлором, бромом и иодом. При горении в воздухе или кислороде образуется оксид селена(IV) и вода. Более сильная кислота, чем H2S.
Селениды — соединения селена с металлами. Кристаллические вещества, часто с металлическим блеском. Существуют моноселениды состава М2Se, MSe; полиселениды М2Sеn (кроме Li), где n = 2-6; гидроселениды MHSe. Кислородом воздуха окисляются до селена:
Видео:Качественная реакция ионов хрома(III) со щелочью. Получение и свойства гидроксида хромаСкачать

Применение:
Селен используется в выпрямительных полупроводниковых диодах, а также для фотоэлектрических приборов, электрофотографических копировальных устройств, в качестве люминофоров в телевидении, оптических и сигнальных приборах, терморезисторах и т. п. Селен широко применяется для обесцвечивания зеленого стекла и получения рубиновых стекол; в металлургии — для придания стали мелкозернистой структуры, улучшения их механических свойств; в химической промышленности — в качестве катализатора.
Стабильный изотоп селен-74 позволил на своей основе создать плазменный лазер с колоссальным усилением в ультрафиолетовой области (около миллиарда раз).
Радиоактивный изотоп селен-75 используется в качестве мощного источника гамма-излучения для дефектоскопии.
Видео:Реакция фенолфталеина на гидроксид натрияСкачать

Биологическая роль и токсичность:
Селен ходит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. Он обладает антиоксидантными свойствами, повышает восприятие света сетчаткой глаза, влияет на многие ферментативные реакции. Потребность человека и животных в селене не превышает 50-100 мкг/кг рациона.
Полковников А.А.
ХФ ТюмГУ, 581 группа. 2011 г.
Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Селен (Se) — общая характеристика и свойства химического элемента
Видео:ГИДРОКСИД НАТРИЯ | NaOH | Химические свойства ГИДРОКСИДА НАТРИЯ | Качественные реакции | ХимияСкачать

История элемента
Элемент был открыт Й. Я. Берцелиусом в 1817 году. Шведский химик и минералог проводил опыты с серной кислотой вместе с Я. Г. Ганом. Учёные обнаружили в веществе красновато-коричневый осадок с редечным запахом, который тогда служил определением присутствия теллура. Берцелиус решил исследовать осадок, надеясь обнаружить новый металл. После изучения этого явления он смог выявить неизвестное вещество, которое по свойствам напоминало теллур. Поскольку второй элемент был назван в честь Земли, химик назвал новый элемент Selenium (селен), что переводится с латинского «Луна».
В 1873 году Уиллоуби Смит доказал, что электрическое сопротивление элемента зависит от освещённости. Через несколько лет были разработаны первые продукты в виде ячеек на основе селена, которые использовали в фотофоне, созданном А. Г. Беллом. С помощью химического элемента можно было изменять электропроводимость световых лучей, которые отражались от зеркала под влиянием звука. Полезное свойство селена позволило использовать его в разных измерителях освещённости.
В первой половине XX века начали производить выпрямители на основе этого элемента, которые заменили медно-закисные изделия. Полупроводниковые диоды широко использовали до 1970-х годов.
Когда начали происходить массовые отравления работников на селеновых заводах и животных, поедавших траву около этих предприятий, люди поняли, что химический элемент токсичен. В середине прошлого века учёные раскрыли биологическое значение вещества для живых организмов.
Видео:Сера, селен, теллур. Тест №11.Скачать

Нахождение в природе и получение
Неметалл в объёме 500 мг/т содержится в земной коре. Основные черты вещества можно определить по близкому отношению ионных радиусов селена и серы. С «лунным» элементом образуются 37 минералов, включая ашавалит, гуанахуатит, клаусталит, платинит, тиманнит и хастит. Селен в виде самородков встречается довольно редко. Его минералы можно найти чаще, но добывают материал в основном из сульфидов. В этих соединениях объём неметалла варьируется в пределах чисел 7−100 г/т. В морской воде концентрация вещества составляет 0,4 мкг/л.
Основным источником неметалла выступают шламы свинцовых камер и пыль, которая образуется при обжиге сульфидов с соответствующим веществом. Сырьё обрабатывают концентрированной серной кислотой с нитратом натрия. В результате реакции образуется селенистая кислота с формулой H2SeO3 и в небольшом объёме селеновая кислота (H2SeO4). Затем селенистую кислоту обрабатывают сернистым газом и получают элементарный селен и серную кислоту.
Чтобы очистить полученный осадок, его сжигают в кислороде, который насыщают парами азотной кислоты. В результате получается чистый диоксид селена. В раствор SeO2 добавляют соляную кислоту, а затем пропускают через него сернистый газ, осаждая нужный элемент. Полученное вещество переплавляют, фильтруют через стеклоткань или активированный уголь. Последняя стадия очистки элемента подразумевает дистилляцию в вакууме.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

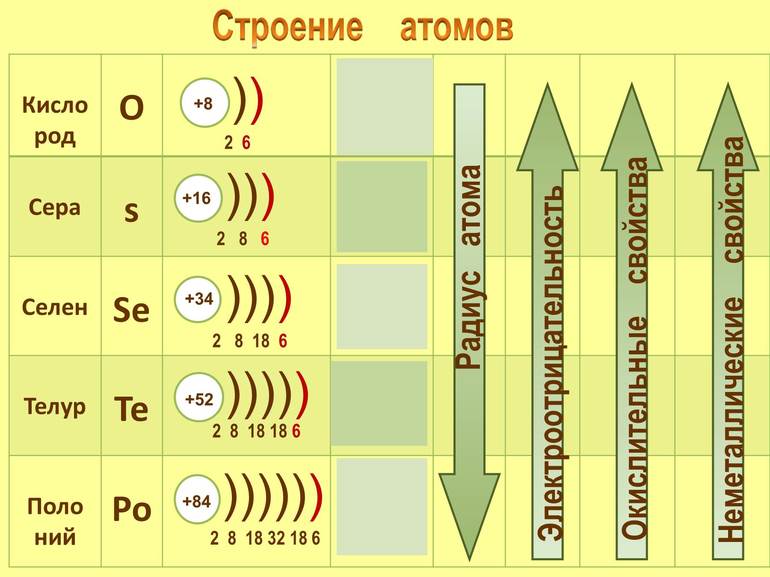
Строение атома и структура
Селен состоит в 4-м периоде VI группы химических элементов. Неметалл имеет порядковый номер 34, его обозначение в таблице — Se. Атомная масса составляет 78,96 а. е. м., электронная формула селена — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 4 . Атом химического элемента имеет ядро с положительным зарядом +34. В него входят 34 протона, 45 нейронов и 34 электрона, которые движутся по 3-м орбитам.
Элемент отличается интересной конфигурацией. На внешнем энергетическом уровне располагаются 6 валентных отрицательно заряженных частиц. Поскольку в атоме селена есть два неспаренных электрона, это говорит о его ковалентности.
Вещество может быть представлено в двух модификациях:
- кристаллическая (моноклинный и гексагональный селен);
- аморфная.
Во втором случае неметалл имеет порошкообразную, коллоидную или стекловидную форму. Аморфная модификация неустойчива. Красный порошкообразный или коллоидный селен образуется при восстановлении из раствора селенистой кислоты. Чтобы получить стекловидную форму чёрного цвета, вещество любой модификации нагревают до температуры 220 °C, а потом сразу же охлаждают.
Гексагональный селен тёмно-серого оттенка устойчив в термодинамических условиях. Любую форму вещества нагревают до температуры плавления и затем охлаждают до 180−200°C, выдерживая этот показатель определённый период.
Видео:Опыт 3 Взаимодействие гидроксида натрия с соляной кислотойСкачать

Физические особенности
Селен относится к группе халькогенов. Неметалл представляет собой хрупкое и непрозрачное вещество чёрного цвета. В неустойчивой форме он имеет оттенок киноварь. Обладает металлическим блеском.
Основные характеристики селена в гексагональной модификации:
- твёрдость по шкале Мооса — 2;
- плотность — 4,8 г/см 3 ;
- температура плавления — 217 °C;
- температура кипения — 685−688°C;
- цвет черты — красный.
Гибкий материал относится к диамагнетикам. Он характеризуется высоким оптическим рельефом и анизотропией. Цвет минерала в воздухе — белый. В иммерсии (микроскопическое наблюдение) оттенок становится темнее и может быть серовато-коричневым. Только на просвет химический элемент приобретает красную окраску.
Видео:ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

Химические свойства
Так как неметалл характеризуется двумя неспаренными электронами, степень окисления селена равна +2. Но у вещества есть вакантные орбитали на четвёртом уровне 4d-подуровня. Это говорит о том, что элемент может находиться в возбуждённом состоянии, при котором степень окисления меняется на +4.
По химическим свойствам неметалл близок к теллуру и сере, занимая промежуточное место между ними. Однако в соединениях со степенью окисления -2 он служит сильным восстановителем, а с показателем +6 — окислителем. Простое вещество селен отличается меньшей активностью, чем сера. Элемент способен гореть в воздухе самостоятельно. Окисление неметалла происходит только при нагревании. Вещество горит синим пламенем. Бурные реакции с селеном наблюдаются при взаимодействии с щелочными металлами.
Химический элемент может образовывать с кислородом несколько оксидов. SeO2 и SeO3 выступают ангидридами селеновой и селенистой кислот, с которыми получают селенат и селенит. Также неметалл может образовывать SeO и SeO5. Диоксид селена (SeO2) представляет собой кристаллическое вещество. Он хорошо растворяется в воде и считается довольно устойчивым соединением.
Видео:Растворение гидроксида натрия. Химический опытСкачать

Меры безопасности
«Лунный» элемент относится к третьему классу опасности, поэтому с токсичным веществом и его соединениями следует работать осторожно. По характеру воздействия на человеческий организм селен напоминает мышьяк. Он может поражать печень, почки и ЦНС. В металлической форме вещество менее токсично. Наиболее опасными соединениями считаются диоксид селена, селеноводород и селениты натрия или лития.
Если вещество в форме металлического порошка попало в организм через рот, тогда у человека возникнут сильные боли в животе и диарея. Пострадавшему не потребуется помощь, если объём токсичного материала не превышал 1 г. Через какое-то время симптомы пройдут самостоятельно.
На кожном покрове могут возникнуть ожоги или аллергическая реакция в виде дерматита при контакте с солями неметалла. Диоксид селена вызывает резкую боль и онемение. Соединения химического элемента могут сильно раздражить слизистые оболочки. Также они вызывают покраснения, а при попадании в органы зрения — режущую боль, слезотечение и конъюнктивит.
Видео:Реакция ФТОРИДА НАТРИЯ и ГИДРОКСИДА КАЛЬЦИЯ. Химические опыты.Preparation CALCIUM FLUORIDE.ChemistryСкачать

Сферы применения
Селен, а также его соединения и сплавы широко используются в качестве полупроводника для выпрямителей переменного тока. В современной технологии применяют селениды висмута, олова, свинца, сурьмы.
Неметалл используется и в других областях:
- Это вещество необходимо при создании фототехники.
- В виде источника излучения для дефектоскопии применяют радиоактивный изотоп селен-75.
- Селен может использоваться как наполнитель в резиновой промышленности.
- В металлургии элемент необходим для придания полученным сплавам мелкозернистой структуры.
- В стекольной промышленности вещество используется для обесцвечивания или окрашивания прозрачного материала в красные или розовые оттенки. Обычно для этого выбирают металлическую форму элемента или селенистокислый натрий. Селеном окрашены рубиновые звёзды Московского Кремля.
- Материал применяется и в производстве керамических изделий, которым он придаёт красноватые оттенки. Также этим веществом окрашивают эмали.
Хотя селен относится к токсичным веществам, он может использоваться и в сфере медицины благодаря своим антиоксидантным свойствам. Неметалл выступает мощным противораковым средством. Препараты с селеном применяют в профилактике развития различных болезней. В малых концентрациях вещество подавляет гистамин. Селен обладает противоаллергическим и антидистрофическим эффектом. Соли неметалла избавляют от гипотонии при шоке и коллапсе.
Видео:Качественная реакция ионов свинца с соляной кислотойСкачать

Значение для человека
Селен — жизненно необходимый для живых организмов микроэлемент. Он содержится в активных центрах некоторых белков в виде аминокислот селеноцистеина. Объём вещества в человеческом организме составляет 10−14 мг. Основная часть находится в печени, почках, селезёнке, яичках и семенных канатиках у мужчин. В небольших количествах микроэлемент присутствует в костном мозге, сердце, лёгких, коже, волосах и ногтях.
Вещество взаимодействует с различными витаминами и ферментами. Он обнаружен в составе более 30 биологических соединений. Благодаря учёным удалось узнать о пользе и вреде селена для организма человека:
- Микроэлемент восстанавливает работу нервной и эндокринной системы.
- Препараты с этим веществом усиливают иммунитет.
- Селен улучшает функцию сосудов и препятствует развитию сердечно-сосудистых патологий.
- Сильный антиоксидант тормозит старение организма и выводит из него чужеродные вещества.
- Неметалл снижает возможность развития злокачественных опухолей.
- Он улучшает работу половых желёз и стимулирует репродуктивную функцию.
- Селен нормализует процессы обменов в человеческом организме и защищает его от возможного токсического действия кадмия, ртути, свинца, серебра и таллия.
- Вещество уменьшает боли при воспалениях.
Микроэлемент также участвует в обмене белков, жиров и углеводов. Без него не обходятся окислительно-восстановительные процессы. Из занимательных фактов о селене нужно отметить, что он контролирует весь цикл жизни клетки.
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Полезные продукты
Для людей суточная норма селена составляет 70−110 мкг. Объём зависит от возраста и половой принадлежности человека. Для взрослых мужчин максимальное количество вещества в день составляет 140 мкг.
Селеном богаты продукты как животного, так и растительного происхождения:
- злаковые культуры;
- масло оливы;
- орехи;
- томаты;
- маслины;
- чеснок;
- грибы;
- рыба и другие морепродукты;
- говяжьи почки и печень;
- морская соль;
- ржаной хлеб;
- яйца курицы.
Повышенное содержание микроэлемента в человеческом организме может вызвать тошноту, рвоту или понос. В некоторых случаях развивается депрессия. На избыток вещества указывают такие симптомы, как желтушность и шелушение кожи, разрушение ногтей, выпадающие волосы, отсутствие аппетита, постоянная усталость и расстройства ЦНС. Если в организме повышается объём ртути, меди или сульфатов, тогда наблюдается недостаток селена. К дефициту элемента может привести применение медикаментозных средств от малярии.
Селен выполняет важную роль не только в различных сферах жизни человека, но и в его организме. С правильным рационом получится поддерживать объём вещества на нужном уровне.