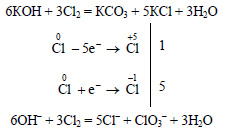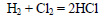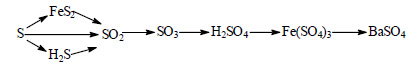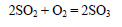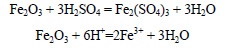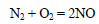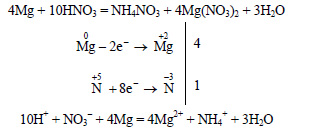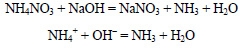- Хлороводород, соляная кислота (HCl)
- Хлорноватистая кислота (HClO) и ее соли
- Хлористая кислота (HClO2) и ее соли
- Хлорноватая кислота (HClO3) и ее соли
- Хлорная кислота (HClO4) и ее соли
- Оксид хлора (I), оксид дихлора ( Cl2O)
- Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
- Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
- Оксид хлора (VII) (Cl2О7)
- Физические свойства
- Способы получения
- Промышленный
- Лабораторные
- Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
- Диспропорционирование хлора в воде и водных растворах щелочей
- Взаимодействие хлора с органическими веществами
- Хлороводород и соляная кислота
- Газообразный хлороводород
- Физические и химические свойства
- Способы получения
- Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
- Химические свойства соляной кислоты
- Реакции с органическими соединениями
- Оксиды и оксокислоты хлора
- Составьте уравнения реакций, при помощи которых молено осуществить следующие превращения:
Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать

Хлороводород, соляная кислота (HCl)
Способы получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
- при очень сильном нагревании
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется
450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
Общие свойства кислот
Он проявляет все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
- взаимодействует с основными и амфотерными оксидами:
- реагирует с основаниями и амфотерными гидроксидами:
- Вступает в реакцию с аммиаком:
- взаимодействует с солями более слабых кислот:
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl — окисляется до свободного хлора:
2Cl — — 2e — = Cl2 0
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
с аминокислотами:
Кислородсодержащие кислоты галогенов
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
- Реакция гипохлоритов с диоксидом углерода и водой :
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO –слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + KI → KIO3 + HCl
2HBr + HClO → HCl + Br2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая кислота разлагается:
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
- Разложениегипохлоритов при нагревании:
- Кислоты, более сильные, чем хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
- Взаимодействуют с другимисолями, если продуктом является слабый электролит:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
- Вступает в реакциис щелочами с образованием хлоритов:
- При длительном хранении разлагается:
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
- реагируют с сильными кислотами:
- являются слабыми восстановителями и сильными окислителями в кислой среде:
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
- Окисляет некоторые вещества:
- Разлагается при слабом нагревании:
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора через подогретый раствор щелочи:
- Хлораты сильные окислители.
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
Видео:Взаимодействие хлора со скипидаромСкачать

Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с щелочами с образованием перхлоратов:
- Как сильный окислитель окисляет многие вещества:
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильнымиокислителями
- Взаимодействуют с сильными кислотами:
- При нагревании более 550ºС разлагаются:
Оксиды хлора
Видео:Взаимодействие хлора с железомСкачать

Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
- Является сильным окислителем:
- При температуре выше 20ºС или на свету разлагается:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
6ClO2 + 3H2O = HCl + 5HClO3 (горячая вода)
- Разлагается в концентрированной хлороводородной кислоте:
- Проявляет окислительно-восстановительные свойства:
Видео:Хлор. 9 класс.Скачать

Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6) – вязкая жидкость красного цвета. Соприкосновение с органическими веществами приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
Видео:Взаимодействие хлора с медьюСкачать

Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
- При нагревании разлагается:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физические свойства
Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Видео:Оксиды хлораСкачать

Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Видео:Вся неорганика для ЕГЭ и ОГЭ| Занятие №1Скачать

Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Видео:Правая часть уравнения реакции вещества X с гидроксидом калия имеет вид: ... = NH3 + Н2О + KI.Скачать

Лабораторные
Окисление конц. HCI различными окислителями:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Видео:Взаимодействие хлора с водородомСкачать

Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Видео:Опыты по химии. Взаимодействие хлора с растворами бромида и йодида натрияСкачать

Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Видео:Электролиз. 10 класс.Скачать

Газообразный хлороводород
Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Составьте уравнения реакций, при помощи которых молено осуществить следующие превращения:
Уравнения реакций, если это возможно, составьте в полном и сокращенном ионном виде
Ответ:
а) При реакции хлора с гидроксидом кальция образуется смесь хлорида кальция и гипохлорита кальция:
При реакции хлора с горячим раствором гидроксида калия образуется хлорат калия:
Хлорат калия является сильным окислителем, при его реакции с соляной кислотой выделяется хлор:
Хлор реагирует с водородом с образованием хлороводорода:
При реакции хлороводорода с гидроксидом кальция образуется хлорид кальция:
При реакции раствора хлорида кальция с раствором нитрата серебра в осадок выпадает хлорид серебра:
При реакции хлора с железом при нагревании образуется хлорид железа (III):
При реакции раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (желтая кровяная соль) образуется осадок гексацианоферрата (II) железа (III), так называемая берлинская лазурь:
При реакции серы с железом при нагревании можно получить дисульфид железа FeS2:
Сера реагирует при нагревании с водородом с образованием сероводорода:
При окислении дисульфида железа образуется оксид серы (IV):
Оксид серы (IV) образуется также при сжигании серы или сероводорода:
При окислении оксида серы (IV) кислородом в присутствии катализатора и при повышенной температуре образуется оксид серы (VI) (триоксид серы, серный ангидрид):
Триоксид серы бурно реагирует с водой с образованием серной кислоты:
При реакции серной кислоты с оксидом железа (111) образуется сульфат железа (III):
При реакции сульфата железа (III) с хлоридом бария выпадает осадок сульфата бария:
Азот реагирует с кислородом в условиях электрического разряда с образованием оксида азота (II):
В присутствии катализатора азот реагирует с водородом с образованием аммиака:
При окислении аммиака кислородом в присутствии катализатора образуется оксид азота (II):
Оксид азота (II) окисляется кислородом в оксид азота (IV):
Оксид азота (IV) реагирует в присутствии кислорода с водой с образованием азотной кислоты:
При реакции 30%-ной азотной кислоты с медью выделяется оксид азота (II):
При реакции разбавленной (15%-ной) азотной кислоты с цинком выделяется оксид азота (I):
При реакции сильно разбавленной (5%-ной) азотной кислоты с магнием образуется нитрат аммония:
При действии щелочи на нитрат аммония выделяется аммиак:

задача №11
к главе «Глава VI. Неметаллы».