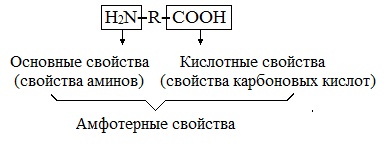
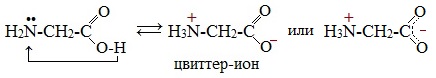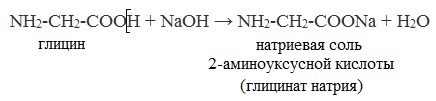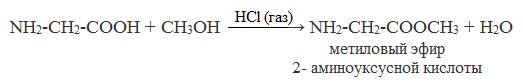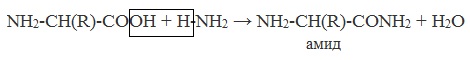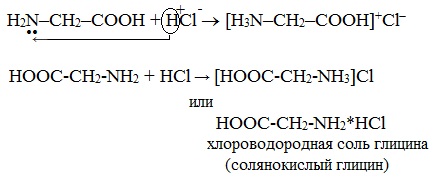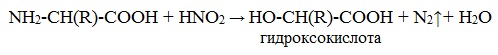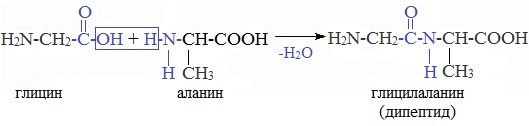Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
- Кислотно-основное равновесие в водных растворах
- 1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
- 2. Взаимодействие с основаниями и кислотами
- 3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
- 4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
- 5. Качественные реакции!
- Аминоуксусная кислота взаимодействует с
- Калькулятор молярной массы, молекулярной массы и строения элементов
- Вычисление молярной массы
- Аминоуксусная кислота взаимодействует с
- Вычисление молекулярной массы (молекулярная масса)
- Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Аминоуксусная кислота взаимодействует ли с этанолом
- Аминокислоты, белки
- Аминоуксусная кислота: получение и применение
- Химические свойства аминокислот.
- Аминокислоты. Свойства аминокислот.
- Свойства аминокислот
- Химические свойства аминокислот
- Физические свойства аминокислот
- Acetyl
- 🔥 Видео
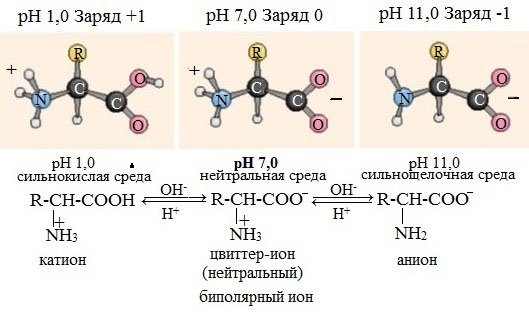
Кислотно-основное равновесие в водных растворах
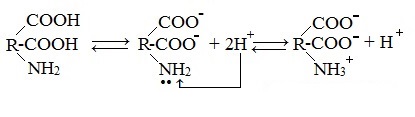
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
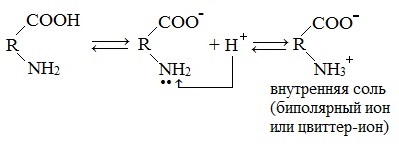
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
Водные растворы моноаминодикарбоновых кислот имеют рН + .
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
2. Взаимодействие с основаниями и кислотами
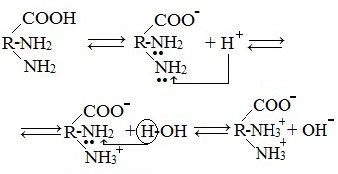
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
в) взаимодействие с аммиаком
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
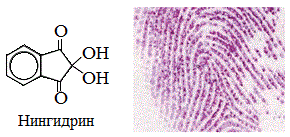
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
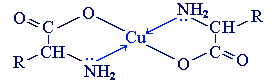
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Аминоуксусная кислота взаимодействует с
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Калькулятор молярной массы, молекулярной массы и строения элементов
| Молярная масса of CH2NH2COOH is 75,0666 g/mol Формула в системе Хилл C2H5NO2Элементный состав CH2NH2COOH: |
СимволЭлементАтомная массаАтомыМассовая доля
| C | Углерод | 12,0107 | 2 | 32,0001 % |
| H | Водород | 1,00794 | 5 | 6,7136 % |
| N | Азот | 14,0067 | 1 | 18,6590 % |
| O | Кислород | 15,9994 | 2 | 42,6272 % |
Прямая ссылка на эту страницу
Расскажите, пожалуйста, об этом бесплатном химическом портале вашим друзьям.
Вычисление молярной массы
Для расчета молярной массы химического соединения введите его формулу и нажмите кнопку ‘Рассчитать!’.
В химической формуле, вы можете использовать:
- Любой химический элемент
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы: NaCl, Ca(OH)2, K4[Fe(CN)6], CuSO4*5H2O, water, nitric acid, potassium permanganate, ethanol, fructose.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Аминоуксусная кислота взаимодействует с
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса: C[14]O[16]2, S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и).
(1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
Оставьте нам свой отзыв о своем опыте с калькулятором молекулярной массы.
также: молекулярные массы аминокислот
© 2018 webqc.org Все права защищены
Аминокислоты – это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
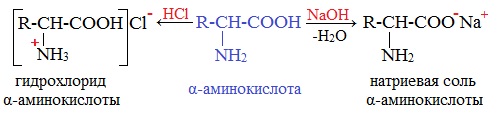
Как амфолиты a-аминокислоты образуют соли при взаимодействии с кислотами и основаниями.
 |

аланин гидрохлорид аланина
2.Реакция декарбоксилирования a-аминокислоты – это ферментативный процесс образования биогенных аминов из соответствующих a-аминокислот.
Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента (KoF) – пиридоксальфосфата.
 |

При декарбоксилировании глутаминовой α-аминокислоты образуется ГАМК (γ-аминомасляная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования – эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
В организме преобладает путь окислительного дезаминирования с участием ферментов – дегидрогеназ и кофермента – NAD+.
На первой стадии процесса осуществляется дегидрирование a-звена с образованием a-иминокислоты. На второй стадии происходит неферментативный гидролиз a-аминокислоты, приводящий к образованию a-кетокислоты и сопровождающийся выделением аммиака, включающегося в цикл образования мочевины.
Общая схема процесса окислительного дезаминирования:
 |
Например, реакция окислительного дезаминирования аланина:
С помощью подобных процессов снижается уровень избыточных АК в клетке.
Трансаминированиеили переаминирование a-аминокислоты – это путь синтеза необходимых АК из a-кетокислот. При этом донором аминогруппы является a-аминокислота, находящаяся в избытке, а акцептором аминогруппы – a-кетокислота (ПВК, ЩУК, a-кетомасляная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – пиридоксальфосфата.
Например, процесс трансаминирования L-аланина и ЩУК:
Процесс переаминирования связывает обмен белков и углеводов в организме, он регулирует содержание a-аминокислот и синтез заменимых a-аминокислот.
Кроме этих реакций a-аминокислоты способны образовывать сложные эфиры, ацильные производные и вступать в реакции, которые не имеют аналогий в химии in vitro.
К таким процессам относятся гидроксилирование фенилаланина в тирозин.
При отсутствии необходимого фермента в организме накапливается фенилаланин, при его дезаминировании образуется токсичная кислота, накопление которой приводит к тяжелому заболеванию – фенилкетонурии.
Контрольные вопросы
1. Строение α-аминокислот, номенклатура, изомерия.
Классификация α-аминокислот по характеру бокового радикала, физико-химические характеристики боковой радикала. Классификация α-аминокислот по способности синтезироваться в организме.
3. Кислотно-основные свойства α-аминокислот.
Общие пути обмена α-аминокислот в организме. Реакции декарбоксилирования, трансаминирования, окислительного дезаминирования.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Аминоуксусная кислота взаимодействует ли с этанолом
Напишите все возможные стереоизомеры треонина в проекционных формулах Фишера. Укажите конфигурацию каждого хирального центра. Какие структуры являются энантиомерами, а какие диастереомерами? Есть ли среди приведенных структур мезоформа?
Решение. Молекула треонина содержит два хиральных центра:
следовательно, число оптических изомеров равно 2n = 22 = 4.
I и II, III и IV — энантиомеры;
I и III, I и IV, II и III, II и IV — σ-диастереомеры.
Среди приведенных структур мезоформы нет, так как каждый стереоизомер имеет свой энантиомер.
Задание 2.
Приведите примеры α-аминокислот, входящих в состав белков, с гидрофобными и гидрофильными боковыми радикалами.
Решение.α-Аминокислоты с гидрофобными радикалами: глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин (иминокислота). Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам.
α-Аминокислоты с гидрофильными радикалами:серин, треонин, тирозин, аспарагиновая кислота, глутаминовая кислота, цистеин и оксипролин (иминокислота). В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой.
В свою очередь, эти аминокислоты делят на две группы:
— неионогенные α-аминокислоты, не способные к ионизации.

— ионогенные α-аминокислоты, способные к ионизации в условиях организма.
К α-аминокислотам с отрицательно заряженными радикалами относятся тирозин, цистеин, аспарагиновая и глутаминовая кислоты.
Эти аминокислоты называют кислыми.
Например, при рН 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина — на 8%.
Полностью ионизированные формы аспарагиновой и глутаминовой кислот называют аспартатом и глутаматом:
К α-аминокислотам с положительно заряженными радикалами относятся лизин, аргинин и гистидин.
Эти аминокислоты называют оснóвными.
У лизина есть вторая аминогруппа, способная присоединять протон:
У аргинина положительный заряд приобретает гуанидиновая группа:

Задание 3.
Для аланина напишите уравнения реакций, иллюстрирующих его амфотерный характер.
Решение. Напишем формулу аланина – 2-аминопропановой кислоты
Как все аминокислоты, аланин за счет наличия карбоксильной группы обладает кислотными свойствами, а за счет аминогруппы проявляет основные свойства.
Реакция, иллюстрирующая кислотные свойства аланина, – это реакция взаимодействия со щелочью, с образованием натриевой соли аланина.
Реакция, доказывающая основные свойства аланина, – это реакция взаимодействия с соляной кислотой, с образованием соответствующей соли.
Задание 4.
Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН 6.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Аминокислоты, белки
Вариант 1
1. Напишите уравнения реакций взаимодействия аминоуксусной кислоты с этанолом, гидроксидом кальция, соляной кислотой.
2.
Изобразите структурные формулы изомерных аминокислот C₃H₇O₂N и назовите эти вещества.
3. Что подразумевают под первичной, вторичной и третичной структурами белков? Какие связи соответствуют каждой структуре?
Вариант 2
Напишите уравнения реакций, с помощью которых можно из этанола и неорганических веществ получить глицин (аминоэтановую кислоту).
2. Сильнее или слабее проявляются кислотные свойства у аминокислот по сравнению с карбоновыми кислотами (муравьиной, уксусной)? Почему?
Аминокислоты слабее карбоновых кислот проявляют кислотность. Радикал с аминогруппой увеличивает электронную плотность на атоме кислорода сильнее, чем радикал без аминогруппы.
При увеличении электронной плотности связь между кислородом и протоном карбоксильной группы становится прочнее, а следовательно снижается кислотность.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Аминоуксусная кислота: получение и применение
Что такое денатурация белков? В чем ее сущность и какие факторы ее вызывают?
Денатурация – это разрушение третичной и вторичной структуры белка с сохранением первичной структуры.
Она происходит под воздействием физических (температура, радиация) или химических (действие кислот, щелочей) факторов.
Вариант 3
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → А → уксусный альдегид → Б → В → аминоуксусная кислота.
Назовите вещества А, Б, и В.
2. Почему не все аминокислоты имеют нейтральную реакцию на индикатор в отличие от аминоуксусной кислоты? Ответ подтвердите конкретными примерами.
3.
К какому классу веществ принадлежат белки? Из атомов каких элементов состоят молекулы белков?
Белки (протеины, полипептиды) – высокомолекулярные органические вещества, состоящие из соединенных в цепочку пептидной связью аминокислот.
В состав любого белка входят углерод, водород, азот и кислород. Кроме того, часто в состав белков входит сера.
Вариант 4
1. Напишите уравнения реакций между: а) α-аминомасляной кислотой и гидроксидом натрия; б) аминоуксусной и соляной кислотой; в) β-аминопропионовой кислотой и метанолом.
2. Сильнее или слабее проявляются основные свойства у аминокислот по сравнению с метиламином?
Почему?
Метиламин является более сильным основанием, чем аминокислоты. Карбоксильная группа аминокислот обладает акцепторным эффектом и оттягивает на себя электронную плотность с атома азота аминогруппы, тем самым уменьшая ее способность отрывать протон. А метильная группа метиламина обладает донорным эффектом и увеличивает электронную плотность на атоме азота аминогруппы.
3.
Почему необходима белковая пища? Что происходит с белками пищи в организме человека?
Видео:8 класс. Составление уравнений химических реакций.Скачать

Химические свойства аминокислот.
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2
2. Взаимодействие с водой:
NH2CH2COOH + H2O 
NH2CH2COOH + H2O 
(NH2CH2COOH 
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Аминокислоты. Свойства аминокислот.
кислотно-основные превращение можно представить в виде:
Аминокислоты — амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Группа −СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Реакции с растворами щелочей:
NH2CH2COOH + NaOH → NH2CH2COO−Na + H2O
4. Реагируют как кислоты со спиртами в присутствие газообразного HCl (реакция этерификация):
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O
Аминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота. Реакции с растворами кислот
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4
NH2−(CH2)5−COOH + H−NH−(CH2)5−COOH →H2N−(CH2)5−CO−NH−(CH2)5−COOH+H2O
аминокапроновая (6-аминогексановая) кислота димер (дипептид)
аминокапроновая кислота капрон
Группа −CO−NH− называется амидной группой (пептидная группа, связь (−C−N−) − пептидной связью, а образующиеся полимеры – полиамидами (полимеры α−аминокислот − полипептидами).
В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды.
К полипептидам относятся белки. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь α−аминокислот.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Свойства аминокислот
Cвойства аминокислот можно разделить на две группы: химические и физические.
Видео:Образование медной соли аминоуксусной кислотыСкачать

Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновыекислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:
Образуются соли:
NH2-CH2-COOH + NaOH 
Натриевая соль + 2-аминоуксусной кислоты 
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
NH2-CH2-COOH + CH3OH 
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
NH2-CH(R)-COOH + H-NH2 = NH2-CH(R)-CONH2 + H2O
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl (или HOOC-CH2-NH2*HCl↑)
Таковы основные химические свойства аминокислот.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
Видео:Реакции ионного обмена. 9 класс.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔥 ВидеоТипы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать  Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать  Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать  494 Органическая химия Азотсодержащие орнанические соединение Аминокислоты Задача №4Скачать  Составление уравнений реакций горения. 11 класс.Скачать  |