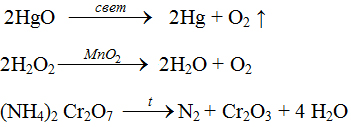При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Реакция разложения. 8-й класс
- Презентация к уроку
- Реакции разложения. Химия. 8 класс. Разработка урока
- Ход урока
- 1. Организационная часть урока
- 1. Приветствие учителя
- 2. Постановка проблемного вопроса
- 2. Актуализация знаний учащихся
- 3. Определение темы и постановка целей урока
- Химическая реакция
- 4. Изучение нового материала
- Введение понятия реакции разложения
- Катализаторы. Ферменты
- 5. Физкультминутка. Театральные этюды
- 6. Закрепление изученного материала
- 🎥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Реакции разложения. Как понять?Скачать

Разложение солей
Видео:8 класс. Составление уравнений химических реакций.Скачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Химия 8 класс: Реакции разложенияСкачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Реакции разложенияСкачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Разложение перманганата калия
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакция разложения. 8-й класс
Класс: 8
Презентация к уроку
Загрузить презентацию (319 кБ)
Цель: Изучить механизм реакций разложения. Познакомиться с понятиями “катализатор”, “фермент”. Отработать навыки составлять уравнения химических реакций.
Образовательные:
- Повторить, скорректировать и закрепить знания по теме “Физические и химические явления”;
- Уметь записывать уравнения реакций и расставлять коэффициенты.
- Научиться определять реакции разложения.
- Рассмотреть классификацию химических реакций по определенным признакам.
- Продолжать развивать навыки самостоятельной работы, делать выводы и обобщения. 493-039
Развивающие:
- Закрепить знания учащихся о физических и химических явлениях;
- Закрепить составление уравнений химических реакций;
- Формировать умения определять реакции разложения.
- Развивать речевые навыки, познавательные способности, мышление, внимание, умение использовать изученный материал для познания нового.
Воспитательные:
- Воспитать самостоятельность, сотрудничество, нравственные качества – коллективизм, способность к взаимовыручке, адекватной самооценке.
Тип урока: комбинированный.
Оборудование:
- Презентация в PowerPoint
- Периодическая система химических элементов Д.И.Менделеева.
- Пробирки, пробиркодержатель, спиртовка, спички, растворы сульфата меди (CuSO4) и гидроксида натрия (NaOH).
- Учебник: О.С.Габриелян, Химия, 8 класс [1].
Ход урока
1. Организационный момент.
Учитель: Добрый день! В начале урока давайте вспомним с вами, какие явления существуют в природе? Приведите соответствующие примеры.
2. Актуализация знаний.
Слайд №1. Дайте определение химическим явлениям. Чем существенно отличаются два вида явлений в природе?
Ученики: Химическое явление – это явление, при котором происходит образование нового вещества, например, фотосинтез, дыхание, появление ржавчины и т.д. Меняется состав вещества.
А физическое явление – это явление, при котором новое вещество не образуется, меняется агрегатное состояние, форма вещества, например, замерзание или испарение воды, гроза, ураган и т.д.
Учитель: Как можно записать химическое явление? Что такое уравнение химической реакции?
Ученики: Химическое явление мы можем записать с помощью химических уравнений. Уравнение химической реакции – это условная запись химического явления с помощью химических формул и математических знаков.
Учитель: Химических реакций и, соответственно – уравнений химических реакций огромное количество. Сегодня мы с вами будем рассматривать определенный тип химической реакции, поговорим, какие бывают классификации химических реакций, как их можно распределить по определенным признакам в различные группы.
Учитель: Давайте запишем с вами сегодняшнее число и тему урока: “Реакции разложения”.
Учитель: Итак, цель нашего урока:
1. Рассмотреть сущность реакций разложения.
2. Продолжить формировать умение записывать уравнения химических реакций.
3. Рассмотреть понятия о скорости химической реакции и катализаторах.
3. Изучение нового материала.
Учитель: Выполните следующее задание: запишите уравнение реакции – нитрат калия разлагается на нитрит калия и кислород. Расставьте коэффициенты.
Учитель: Проверьте уравнение реакции и прочитайте ее.
Учитель: А теперь обратите внимание на реакцию с коэффициентами.
Учитель: Давайте проведем с вами реакцию разложения гидроксида меди (II) при нагревании (при проведении опыта учитель делает акцент на соблюдение техники безопасности. ).
Запишем уравнение реакции: гидроксид меди (II) разлагается на оксид меди (II) и воду.
Учитель: Попробуйте прописать реакцию разложения гидроксида меди(II) на оксид меди (II) и воду (а один человек на доске). Проверьте реакцию. Прочитайте ее.
Учитель: Запишите в тетради (а один человек на доске) реакцию разложения гидроксида железа (III), зная, что при этом получатся оксид железа (III) и вода.
Учитель: Проверьте получившееся уравнение реакции, прочтите его.
Учитель: При рассмотрении всех предыдущих реакций мы говорим с вами, что вещество разлагается. Сколько веществ вступает в реакцию?
Ученики: Вступает в реакцию одно сложное вещество.
Учитель: А сколько и каких веществ получается?
Ученики: Получается несколько менее сложных веществ.
Учитель: Сделаем вывод – такие реакции и есть реакции разложения.
Учитель: Запишите определение реакции разложения в тетрадь со страницы 155 (§29).
Учитель: Что такое тепловой эффект химической реакции? Какие бывают реакции по тепловому эффекту?
Ученики: По тепловому эффекту химические реакции бывают экзотермические (идущие с выделением теплоты) и эндотермические (идущие с поглощением теплоты).
Учитель: Сегодня появляется еще одна классификация – по числу и составу исходных веществ и продуктов реакции.
Реакции разложения – это первые реакции в этой классификации.
Учитель: Запомните, все реакции разложения протекают с поглощением тепла, т.е., являются эндотермическими.
Учитель: А может ли человек управлять химической реакцией, увеличивать или уменьшать ее скорость протекания?
Ученики: Да, человек может управлять скоростью химической реакции, увеличивать ее, если будет применять специальные вещества, в биологии, например, они называются ферментами (амилаза в ротовой полости начинает расщеплять углеводы пищи).
Учитель: Еще эти вещества мы называем катализаторами. Запишите определение с доски и рассмотрите уравнение соответствующей реакции. К какому типу мы можем ее отнести?
Ученики: Это реакция разложения и каталитическая, т.е., идущая при наличии катализатора.
Учитель: Посмотрите на слайд и запишите к себе в тетрадь небольшую характеристику катализаторов.
4. Закрепление изученного материала.
Учитель: Теперь давайте с вами закрепим изученный материал и решим расчетную задачу. Условие ее представлено на слайде. Попробуйте самостоятельно прописать уравнение реакции.
Учитель: Проверьте уравнение реакции. Решаем самостоятельно задачу. По окончании урока вам надо будет сдать тетрадь на проверку. За урок вам будет выставлена оценка.
5. Домашнее задание.
Учитель: Домашним заданием вам будет следующее – параграф 29, записи в тетради, №1, страница 155 — письменно
Используемая литература.
- О.С.Габриелян, Химия. 8 класс, — М.: Дрофа, 2011.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Реакции разложения. Химия. 8 класс. Разработка урока
Класс: 8
Тема урока: «Реакции разложения».
Тип урока: изучение нового материала.
Цель урока: сформировать представления о реакциях разложения; дать понятие о катализаторах, ферментах.
Задачи:
- познакомить учащихся с классификацией химических реакций по числу и составу исходных веществ и продуктов реакции;
- дать понятие о сущности реакции разложения и научить их определять; ознакомить с понятиями «катализатор», «фермент».
- продолжить формирование умений расставлять коэффициенты в химических уравнениях;
- сформировать представление о значении реакций разложения в организме человека и его повседневной жизни.
- продолжить развитие умений объяснять смысл изученных понятий, применять эти понятия, устанавливать причинно-следственные связи, делать выводы, наблюдать и объяснять результаты экспериментов;
- способствовать формированию вербального мышления как предпосылки речевой компетентности учащихся;
- развитие критического мышления как аспекта учебно-интеллектуальных умений и навыков ;
- развитие у школьников умения структурировать информацию.
- продолжить формирование научного мировоззрения,
- развивать коммуникативные способности учащихся через организацию работы в малых группах;
- способствовать развитию внимания, наблюдательности; формированию устойчивого познавательного интереса к изучению химии.
Оборудование:
- На столе учителя: бихромат аммония, бутылка с газированной водой, пероксид водорода, оксид марганца (IV), спиртовка, портрет Д. Пристли, колбы, пробирки, держатель для пробирок, лучинка, спички.
- На столах учеников: раствор пероксида водорода, оксид марганца, кусочки картофеля и моркови, пробирки, спички, лучинки.
Использованные источники:
- Габриелян О.С. «Химия».8 класс. Учебник.
- О.С. Габриелян, Н.П. Воскобойникова, А.В.Яшукова «Химия», 8 класс. Настольная книга учителя. М.: Дрофа, 2002.
- О.С.Габриелян, Т.В.Смирнова. Изучаем химию в 8 классе.
- Л.Ю. Аликберова “Занимательная химия: Книга для учащихся, учителей и родителей”, М.: АСТ – ПРЕСС, 1999.
- Энциклопедия для детей. Том 17. Химия. М.: Аванта +, 2000.
Девиз урока: «Природа, по-видимому, любит превращения»
Видео:Реакции разложенияСкачать

Ход урока
1. Организационная часть урока
1. Приветствие учителя
2. Постановка проблемного вопроса
Перед вами несколько предметов: портрет Джозефа Пристли, лупа, колба с кислородом, перманганатом калия, бутылка газированной воды. Что объединяет эти предметы?
Ваши предположения? (Ответы учащихся.) (Выдвижение гипотезы.)
Ну что ж, в конце урока мы ответим на этот вопрос и выясним, кто был прав.
2. Актуализация знаний учащихся
Для успешной работы на уроке мы с вами разделимся на группы таким образом: у вас на столах лежат листочки, на которых написаны слова. В течение 2 минут вы должны прочитать, посмотреть друг у друга слова, словосочетания и разделиться по смыслу предложений на группы.
Встали, задвинули стулья. (Обсуждение и деление на группы «химические явления, признаки химических реакций, условия химических реакций, химические уравнения».)
Почему вы оказались в одной группе? Прочитайте ваше предложение.
- 1-й стол – химические явления;
- 2-й стол – признаки химических реакций;
- 3-й стол – условия течения химических реакций;
- 4-й стол – химические уравнения.
3. Определение темы и постановка целей урока
Подумайте, а какая связь существует между вашими группами по смыслу предложений? (Обсуждение в группах в течение 30 секунд.)
Химическая реакция
Итак, мы продолжаем изучение типов химических реакций. Тема нашего урока: «Реакции разложения».
Откройте тетради, запишите число и тему урока. (Слайд 2.)
А какие цели вы перед собой поставите?
Цель урока: познакомиться с реакциями разложения и научиться их определять.
А что вы ожидаете от нашего урока?
А я надеюсь, что вы на уроке будете активными, успешными и легко усвоите новый материал.
Предлагаю вам план проведения урока (слайд 5.)
- Реакции разложения.
- Скорость химической реакции.
- Катализаторы. Ферменты.
4. Изучение нового материала
Учитель: Реакций, протекающих вокруг человека и внутри его, очень много. Они протекают постоянно. Что же необходимо сделать, чтобы не запутаться во всём многообразии химических реакций? Конечно, разложить всё по полочкам или классифицировать.
Введение понятия реакции разложения
С одной из классификаций – по признаку поглощения и выделения теплоты вы уже познакомились. Вспомните, как называются реакции, идущие с выделением теплоты, с поглощением теплоты?
А сегодня мы рассмотрим ещё одну классификацию, в основу которой положен признак числа и состава исходных веществ и продуктов реакции.
1. Откройте §29 стр 151, найдите и прочитайте, какой опыт провёл английский учёный Джозеф Пристли? (Слайд 6.)
В 1774 году английский учёный Джозеф Пристли как- то раз, оксид ртути нагревая, обнаружил странный газ. (Слайд 7.)
Рассмотрим эту реакцию с точки зрения атомно-молекулярного учения. Посмотрим видеоролик «Механизм реакции разложения оксида ртути» (слайд 8).
Обратите внимание на признаки реакции.
Давайте попробуем записать уравнение реакции.
Оксид ртути = ртуть + кислород (Слайд 9.)
(У доски 1 ученик записывает уравнение реакции и расставляет коэффициенты.)
2HgO = 2Hg + O2
И под формулами напишем, что это за вещества по составу (акцентируем внимание на том, что из одного сложного вещества образуется 2 новых вещества). Эта работа проводится при разборе всех реакций.
2. Кислород также можно получить путём разложения перекиси водорода.
Лабораторный опыт №1
Проведите эксперимент с перекисью водорода Н2O2, строго соблюдая правила по ТБ и придерживаясь инструкции учителя.
Инструкция к лабораторному опыту №1:
- Возьмите 1-ую пробирку с перекисью водорода Н2О2.
- В пробирку с перекисью водорода из другой пробирки насыпьте оксид марганца MnO2.
- Что наблюдаете?
- Внесите тлеющую лучинку в пробирку.
- Сделайте вывод, какой газ образуется в результате разложения пероксида водорода.
Известно, что перекись водорода – это сложное вещество, состоящее из 2 атомов водорода и 2 атомов кислорода.
– Возьмите пробирку с перекисью водорода, наблюдаем признаки реакций?
– Какие условия необходимо создать для разложения перекиси водорода.
– Правильно. А если добавить оксид марганца (IV) MnO2, то в пробирке происходит бурная реакция с выделением газа.
В другой пробирке найдите оксид марганца и высыпьте это в пробирку с перекисью водорода. Что вы наблюдаете? Давайте внесём тлеющую лучину в пробирку. Что наблюдаем?
– Тлеющая лучина загорается.
– Какой газ выделяется из пробирки?
– Правильно, кислород, газ, поддерживающий горение. А на стенках пробирки видны капельки воды. Перекись водорода разложилась на воду и кислород. А оксид марганца (IV) MnO2 ускорил протекание этой реакции. Такие вещества в химии называются катализаторами.
– Расставьте коэффициенты в уравнении этой реакции. (Объяснение ученика.)
Демонстрационный опыт №3
Учитель: Ребята, а следующий опыт я проведу сама.
Если поднести лучинку к горке вещества оранжевого цвета – дихромата аммония, начинается бурная реакция. Образуется серо-зеленое вещество – оксид хрома, выделяется газ, появляется пламя. Происходит превращение вещества – химическое явление.
Расставим коэффициенты (объяснение ученика).
– Ребята, посмотрите внимательно на все уравнения реакций.
Подумайте и ответьте на следующий вопрос:
Что объединяет все эти реакции? (Слайд 10.)
Идет процесс разложения веществ.
Во всех реакциях вступает в реакцию одно вещество, а образуются два или более новых веществ: как простых, так и сложных.
- Как, одним словом мы можем назвать процессы, которые протекают? (Слайд 10.)
Вывод:
1. Идет процесс разложения веществ (реакция разложения.) Во всех реакциях вступает в реакцию одно вещество, а образуются два или более новых веществ: как простых, так и сложных.
Попытайтесь сформулировать определение реакции разложения.
(Ученики дают определение реакций разложения.)
Прочитайте в учебнике на стр. 155 определение реакций разложения. (Слайд 11.)
Реакции, в результате которых из одного сложного вещества образуется два и более новых веществ, называются реакциями разложения.
Отличается наше определение от определения в учебнике? Практически не отличается, молодцы!
- В чем их отличие?
- Какие условия необходимы для осуществления данных реакций? (Слайд 10.)
2. Как правило, почти все реакции разложения относятся к эндотермическими реакциям, т.к. для протекания требуется определенные условия, нагревание, электрический ток, присутствие других веществ, ускоряющих реакцию – катализаторов. (Слайды 12, 13.)
Катализаторы. Ферменты
Какие же вещества называются катализаторами? На стр. 152 учебника прочитайте определение о катализаторах.
Катализаторы – это вещества, изменяющие скорость химических реакций, но по окончании их остающиеся качественно и количественно неизменными.
Вернемся к лабораторному опыту, который вы уже провели. Посмотрите внимательно, на дне пробирки вы видите черный оксид марганца, он цел и невредим?
А теперь мы с вами повторим этот опыт: к перекиси водорода положим (1-я и 2-я группы) – кусочек картофеля, а 3-4 группы – кусочек моркови. О чем говорит этот опыт? Подумайте, почему эти овощи растительного происхождения ускоряют химические реакции?
Потому что они являются тоже катализаторами, но называются по- другому – ферменты.
Прочитайте на стр. 153 определение ферментов.
Лабораторный опыт №2
Инструкция к лабораторному опыту №2:
- Возьмите 2-ую пробирку с перекисью водорода Н2О2.
- В пробирку с перекисью водорода положите кусочек картофеля.
- Что наблюдаете?
- Почему картофель ускоряет химическую реакцию?
Учитель. А теперь я предлагаю вам прочитать небольшой текст о катализаторах (слайд 14) и ответить на вопрос: Что интересного вы для себя узнали о катализаторах. Какая информация вас особенно удивила?
Катализаторы в природе распространены повсеместно. Достаточно сказать, что все превращения веществ в живых организмах происходят с участием природных катализаторов – ферментов и поэтому не требуют высокой температуры. Это очень важно – иначе живые ткани, проводя химические реакции, могли бы свариться. Без особых “биологических” катализаторов – ферментов – не получится ни вкусный хлеб, ни аппетитный сыр, ни квашеная капуста. Разрезанное яблоко темнеет на воздухе, оттого что фермент полифенолоксидаза ускоряет окисление находящихся в клетках плода полифенолов – органических веществ. Когда ранку заливают перекисью водорода, пероксид водорода “вскипает” – бурно разлагается на воду и кислород под влиянием фермента каталазы, находящегося в крови. Каталаза нужна организму для уничтожения пероксида водорода, который образуется в процессе клеточного дыхания.
В пищеварительных соках содержится десятки ферментов: липазы, разлагающие жиры на глицерин и органические кислоты; протеазы, разлагающие белки, и др.
Катализаторы применяются и в химической промышленности при синтезе разнообразных веществ, в том числе таких важных продуктов химии, как аммиак NH3 и серная кислота H2SO4.
Катализаторы – вещества из разряда самых необходимых, хотя порой мы об этом мало задумываемся.
И так, что интересного вы узнали об этих удивительных веществах?
(Обсудите информацию в паре и подготовьтесь кратко сказать о самом важном.)
Вы знаете, что очень многие замораживают тертую морковь в морозильниках. Дома (у кого есть) проверьте, пожалуйста, сохраняются ли ферментативные свойства в замороженной моркови? Итак, вам нужны будут перекись водорода и кусочки тертой замороженной моркови. Будут ли выделяться пузырьки газа?
5. Физкультминутка. Театральные этюды
У каждой группы на столе лежит задание. Подготовить театральный этюд о реакции разложения. Выйти ко мне к столу и без слов показать ваш вариант. Остальные группы угадывают, что они вам проиграли. На обдумывание дается 2 мин. Итак время пошло.
Демонстрация этюдов: разложение сложного вещества и образование 2 простых веществ, 2 сложных, 1 простого и 1 сложного вещества.
6. Закрепление изученного материала
Ну, а теперь закрепим знания, полученные на этом уроке.
Задание 1. (Слайд 15.) Вставьте пропущенное слово: Реакции разложения – это…
Задание 2. (Слайд 16.) На слайде вы видите уравнения реакций. Все ли реакции относятся к реакциям разложения? Вычеркните лишнее. Найдите ошибку и дайте объяснение. За каждый правильный ответ 1б.
2) 2Na + Cl2 = 2NaCl
(Показываю ответ, и прошу встать тех, кто справился с этим заданием на 5.) Молодцы.
Почему вы выбрали эти ответы?
А какую ошибку сделали вы?
Задание 3. (Слайд 17):
Соотнесите левые и правые части уравнений реакций. Расставьте коэффициенты:
🎥 Видео
Решение квадратных уравнений. Метод разложения на множители. 8 класс.Скачать

📒Реакции разложения. Химия 8 класс📒Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать