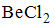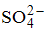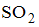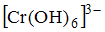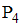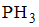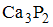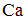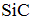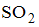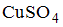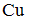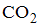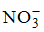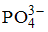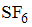Энергией Гиббса реакции называется изменение энергии Гиббса ΔG при протекании химической реакции. Так как энергия Гиббса системыG = Н — TS, её изменение в процессе определяется по формуле: ΔG = ΔH-TΔS(4.1)
где Т — абсолютная температура в Кельвинах.
Энергия Гиббса химической реакции характеризует возможность её самопроизвольного протеканияпри постоянных давлении и температуре.Если ΔG 0 самопроизвольное протекание реакции невозможно, если же ΔG=0, система находится в состоянии равновесия.
Для расчёта энергии Гиббса реакции по формуле (4.1) отдельно определяются ΔН и ΔS. При этом в практических расчётах пользуются приближениями (2.4) и (3.4).
Пример 4.1. Расчёт энергии Гиббса реакции, выраженной уравнением 4NH 3(г) + 5O2 (г) = 4NO(г) + + 6Н2O(г), при давлении 202.6 кПа и температуре 500°С (773К).
Согласно условию, реакция протекает при практически реальных значениях давления и температуры. при которых допустимы приближения (2.4) и (3.4), т.е.
ΔН773 ≈ ΔН 0 298 = — 904.8 кДж = — 904800 Дж. (см. пример 2.2),
а ΔS773 ≈ ΔS 0 298 = 179,77 Дж/К. (см. пример 3.1).
После подстановки значений ΔH 0 298 и ΔS°298 в формулу (4.1) получаем:
ΔG773 = ΔH773 -773 ΔS773 ≈ΔН 0 298 -773ΔS 0 298 = — 904800 – 773*179, ≈1043762 Дж= — 1043,762 кДж.
Полученное отрицательное значение энергии Гиббса реакции ΔG773 указывает на то, что дан ная реакция в рассматриваемых условиях может протекать самопроизвольно.
Если реакция протекает в стандартных условиях при температуре 298К, расчёт её энергии Гиббса ( стандартной энергии Гиббса реакции ) можно производить аналогично расчёту стандартной теплоты реакции по фрмуле, котораядля реакции, выраженной уравнением аА + ЬВ = сС + dD, имеет вид:
ΔG ° 298 = (cΔG ° 298,o6p,C + dΔG ° 298,o6p,D) — (aΔG 298,обрА + bΔG° 298,обр,в) (4.2)
где ΔG ° 298,o6p. — стандартная энергия Гиббса образования соединения в кДж/моль (табличные значения) —энергия Гиббса реакции, в которой при температуре 298К образуется 1 моль данного соединения, находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартных состояниях 4 *, a ΔG°298 — стандартная энергия Гиббса реакции в кДж.
Пример 4.2. Расчёт стандартной энергии Гиббса реакции, протекающей по уравнению: 4NH 3(г) + 5O2 (г) = 4NO(г) + + 6Н2O(г).
В соответствии с формулой (4.2) записываем 5 *:
__________________________________________________________
4* Согласно определению, стандартная энергия Гиббса образования простых веществ равна нулю
5* ΔG 0 298 O2 в выражении не фигурирует ввиду ее равенства нулю
ΔG 0 298 = (4ΔG 0 298.no + 6ΔG 0 298.H2O) — 4 ΔG 0 298.NHз После подстановки табличных значений ΔG 0 298.обР получаем: ΔG 0 298 = (4(86,69) + 6(-228, 76)) — 4(-16,64) = — 959.24 кДж. По полученному результату видно, что так же, как и в примере 4.1, в стандартных условиях рассматриваемая реакция может протекать самопроизвольно
.По формуле (4.1) можно определить температурный диапазон самопроизвольного протекания реакции. Так как условием самопроизвольного протекания реакции является отрицательность ΔG (ΔG 0 298,СаО + ΔН°298,CO2) — ΔН°298,CaCO3 = (-635,1 + (-393,51)) — (-1206) = 177,39кДж = 177390 Дж; ΔS ≈ ΔS 0 298 = (S 0 298,СаО + S 0 298.С02) — S 0 298,СаСОз = (39,7 + 213,6)- 92,9 = 160,4 Дж/К. Подставляем значения ΔН и ΔS в неравенство и решаем его относительно Т: 177390 – Т*160,4 1106. Т.е. при всех температурах, больших 1106К, будет обеспечиваться отрицательность ΔG и, следовательно, в данном температурном диапазоне будет возможным самопроизвольное протекание рассматриваемой реакции.
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Уравнения реакций протекание которых невозможно в стандартных условиях имеют вид
Формула вещества, в молекуле которого содержатся
Согласно правилам электролитной коагуляции, наилучшим коагулирующим действием по отношению к золю, коллоидная частица которого заряжена положительно, обладает ион с наибольшим значением …
Установите соответствие между формулой молекулы или иона и типом гибридизации валентных орбиталей центрального атома.
1.
2.
3.
4.
Согласно основным положениям термодинамики, для состояния равновесия в изобарно-изотермических системах справедливо выражение …
Установите соответствие между формулой вещества и типом реализуемой в нем химической связи.
1.
2.
3.
4.
Установите соответствие между формулой вещества и типом кристаллической решетки его твердого состояния.
1.
2.
3.
4.
Установите соответствие между формулой вещества или иона и его пространственным строением.
1.
2.
3.
4.
Установите соответствие между названием вещества и числом содержащихся в нем
Сильным электролитом является раствор вещества, формула которого имеет вид …
Уравнения реакций, протекание которых невозможно в стандартных условиях, имеют вид …
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Уравнения реакций протекание которых невозможно в стандартных условиях имеют вид
Вопрос 2. На основании расчётов по уравнению Гиббса сделайте вывод о возможности протекания реакции:
ZrCl4 + 2 Mg = Zr + 2 MgCl2
а) в стандартных условиях; б) при 5000 и 10000С (зависимостью ΔH и ΔS от температуры пренебречь).
Вопрос 3. Определите стандартную теплоту образования PCl3, если известно, что:
PCl5 (г) = PCl3 (г) + Cl2 (г); ΔНо298 =+92,59кДж .
🎬 Видео
Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Основы химической термодинамикиСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Свободная энергия Гиббса. 10 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Уравнение Нернста. Условия изменения направления ОВР. Продукты в ОВР. Ч.5-3.Скачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Самое понятное объяснение скорости химической реакции | Задание 18 | Химия ЕГЭ УМСКУЛСкачать

Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

31102013 Решение типовых задач по химической термодинамикеСкачать