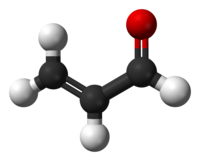
Акролеин или акриловый альдегид (от лат. Acer, acris — «острый» и oleum — «масло», рус. Акролеин, англ. Acrolein, нем. Akrolein, Propenal) — С 3 Н 4 О или СН 2 = СНСН, органическое соединение с едким запахом, самый ненасыщенный альдегид, имеет очень высокую реакционную способность благодаря наличию альдегидной группы и двойной связи. Это бесцветная летучая жидкость с желтоватым оттенком, неприятным резким едким запахом пригорелых жиров, очень ядовитая, сильно раздражает слизистую оболочку глаз. В воздухе присутствует в виде паров, которые в 1,9 раза тяжелее ее и хорошо растворяются в воде. Легковоспламеняющаяся; хорошо растворяется в органических растворителях; растворимость в воде 40 г в 100 мл. Акролеин классифицируют как ядовитое вещество. При хранении он полимеризуется в твердую стекловидную массу — диакрил. Для стабилизации акролеина добавляют гидрохинон. На воздухе акролеин окисляется в пропенову кислоту.
В период между 1980 и началом 1990-х годов промышленное производство акролеина в разных странах мира составило: США — от 27 до 35 000 тонн / год, Япония (действует несколько производств) — около 20 000 тонн / год, Европейский Союз (производится во Франции и Германии) — от 60 000 тонн / год, Россия — 10 500 тонн / год (по состоянию на 1994 год).
В атмосферу акролеин поступает в виде выхлопных газов дизельных двигателей; образуется при термическом разложении жиров. Предельно допустимая концентрация акролеина — 0,2 мг / м³. Десятиминутное пребывание в атмосфере, содержащей 0,014% акролеина, для человека смертельно.
Акролеин применяют преимущественно в изготовлении фармацевтических препаратов и парфюмерии для изготовления ароматизаторов.
- Открытие
- Получение
- Синтез с формальдегид и этаналя
- Получение прямым окислением пропилена
- Окисления пропилена на медных катализаторах
- Окисления пропилена на фосфоромолибдати висмута
- Химические свойства
- Применение
- Физиологическое воздействие
- Общий характер действия
- Влияние на животных
- Воздействие на человека
- Видео по теме
- Acetyl
- Акролеин
- Открытие
- Из Википедии — свободной энциклопедии
- Реакционная способность
- Синтез
- Химические свойства
- Токсичность
- Применение
- Физиологическое воздействие
- Общий характер действия
- Влияние на животных
- Воздействие на человека
- 📽️ Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Открытие
Акролеин был открыт в 19 веке австрийским химиком Йозефом Редтенбахером при сухой перегонке жиров. В ходе своих исследований ученый также открыл и пропенову кислоту.
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Получение
Синтез с формальдегид и этаналя
Метод был разработан фирмой Degussa, которая с 1942 года производила акролеин в промышленном масштабе. За ним формальдегид в виде 30% -ного водного раствора пропускается вместе с еквимолекулярною количеством этаналя при 300-320 ° C через силикагель, пропитанный 10% раствором силиката натрия. Степень превращения составляет 45-52%, а выход процесса достигает 70-80%. Альдегиды, отреагировали, отделяются перегонкой от акролеина и снова возвращаются в процесс.
Катализатором процесса является силикагель, пропитанный 10% раствором силиката натрия. Оптимальные температуры для этого катализатора 303-320 ° С. Поскольку образование акролеина протекает экзотермически, подвод тепла осуществляется в трубчатой печи.
В качестве побочных продуктов образуются метанол, 2-бутеналь и отработанный газ, которые можно без труда удалить. Для исключения полимеризации акролеина при разделении смеси нужно непрерывно подавать в перегонные колонны ингибитор. Добавление 0,1% ингибитора (гидрохинон или пирокатехин) делает акролеин устойчивым в течение года и исключает образование твердых осадков.
Получение прямым окислением пропилена
В 1936-1939 годах было установлено, что при окислении пропилена в присутствии сульфата ртути в сернокислом растворе образуется очень незначительное количество акролеина. Окисления пропилена в акролеин в промышленном масштабе проходит на катализаторах оксида меди (I) и молибдата висмута.
Окисления пропилена на медных катализаторах
В 1942 году американские ученые обнаружили, что при пропускании пропилена через оксид меди (I) и селенид серебра на асбесте при 295 ° C образовывалась значительное количество акролеина.
Это привело к разработке в 1946-1947 годах нового процесса фирмой Shell Development Co .. Пропилен вместе с воздухом и водяным паром пропускали при 370-400 ° C и небольшом давлении в присутствии 0,03 молярных% изопропилхлориду через оксид меди (I) на карбиде кремния. Максимальный выход акролеина равнялся 51%. Повышение давления кислорода увеличивает выход акролеина до 68-81%. В промышленном масштабе конверсия пропилена составляет 14% при 368 ° C и объемном соотношении пропилен: водяной пар: кислород = 4,4: 4,7: 1 в присутствии 0,4% оксида меди (I) на карбиде кремния. Выход акролеина колеблется в пределах 65-85%.
Образование акролеина происходит одновременно с полным окислением до диоксида углерода и воды, при этом катализаторы с высоким содержанием меди способствуют окислительной деструкции. Побочными продуктами реакции будут формальдегид, этаналь, диоксид углерода, органические кислоты, карбонильные соединения и полимеры.
Окисления пропилена на фосфоромолибдати висмута
В 1960 году американская фирма Sohio запустила первую промышленную установку для производства акрилонитрила по этому методу. При этом в промышленном масштабе получают и акролеин. Катализатором окисления пропилена, которое происходит при температуре 425-480 ° C, выступает фосфоромолибдат висмута на силикатной кислоте. Выход акролеина составляет около 70%.
Видео:Фосфор. 9 класс.Скачать

Химические свойства
Акролеин, благодаря явлению таутомерии, находится в постоянном равновесии со своим изомер — пропадиенолом. Это равновесие может быть смещена действием кислотного или основного катализатора:
Поскольку акролеин является ненасыщенным альдегидом, то в химических реакциях он проявляет свойства как алкенов, так и альдегидов. В частности акролеин вступает в реакцию гидрогенування, с помощью которой можно получить аллиловый спирт
Кроме этого, с помощью действия катализаторов на основе никеля, палладия и платины, реакцию гидрогенування можно повести другим путем и через промежуточное образование пропаналя получить 1-пропанол:
В результате хлорирования акролеина получают α, β-дихлоропропаналь. В промышленности α, β-дихлорпропаналь действием соляной кислоты превращают в α-хлоракролеин, который является сырьем для получения α-хлоракрилатних смол:
Воздействие на акролеин хлорноватистая кислота приводит к образованию глицеральдегид:
Для акролеина характерна реакция окисления с образованием пропеновои кислоты:
Гидролиз акролеина может проходить двумя путями. В результате образуются 1,3-пропандиол или сложная димерних состав:
Интересна взаимодействие акролеина с аммиаком, в результате которой происходит циклизация с образованием β-пиколина:
Как и любая ненасыщенная соединение, акролеин способен соединять собственные молекулы. Так в результате димеризации образуются димеры следующей строения:
а полимеризация приводит к образованию полиакролеину.
Также с акролеина можно получить незаменимую аминокислоту — метионин. Упрощенно этот процесс записывается следующим образом:
Путем реакции Скраупа ароматических аминов с акролеин, который образуется in situ из глицерина в присутствии дегидратирующего агента и окислителя, получают замещены хинолины:

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Применение
Наибольшее количество акролеина расходуется на синтез глицерина без использования хлора, где акролеин гидрогенизують к аллилового спирта, затем с помощью перекиси водорода превращают в глицерин.
Наряду с производством аллилового спирта для синтеза глицерина одной из основных областей применения акролеина является синтез метионина. При взаимодействии акролеина с метилмеркаптаном в присутствии катализаторов (пиридин, ацетат меди, пиперидин, этилат натрия) в результате ряда превращений образуется метионин.
Реакция акролеина с многофункциональными соединениями приводит к интересным конденсационных полимеров, среди которых особенно известны Полиацетали с многоосновными спиртами. При полимеризации продукта конденсации с пентаэритрита (торговая марка «ультра-лон») получают вещества с хорошей прочностью на разрыв, высокой ударной прочностью, стойкостью к истиранию. Но эти продукты обладают невысокой теплостойкостью (65-104 ° C).
В результате гидролиза продукта димеризации акролеина и его дальнейшего гидрирования образуется 1,2,6-гексантриол, который применяется как пластификатор и составная часть при производстве алкидных и полиэфирных смол.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Физиологическое воздействие
Общий характер действия
Общий характер действия акролеина выражается в сильном раздражении слизистых оболочек. Кроме этого ненасыщенный альдегид обладает некоторой общей токсичным и слабой наркотической действиями.
Влияние на животных
Острое отравление животных акролеин обычно имеет летальный исход. Так, большинство белых мышей погибает после нескольких минут пребывания в среде с концентрацией акролеина 0,02-0,3 мг / л, а 0,0075 мг / л переносится в течение нескольких часов без серьезных симптомов отравления. Ингаляция паров акролеина вызывает у белых крыс и морских свинок симптомы бронхиальной астмы. Кроме астмы также вызывает эмфизему, полнокровие и расширение капилляров легких, бронхоспазм, поражает нервную систему (прогрессирующие параличи). В результате раздражения слизистых оболочек дыхательных путей возникает значительный отек гортани, отек и деструкция слизистой и подслизистой трахеи и крупных бронхов вплоть до закрытия их просвета. Концентрации 1 и 0,75 мг / л вызывают гибель крыс. При 0,65 мг / л гибель происходит чаще осложнений — возникновение вторичной инфекции и пневмонии. У кошек при 0,25 мг / л возникает слюнотечение, слезотечение, легкий наркоз; при 0,2 мг / л — сильное раздражение легких; при 1,5 мг / л и воздействии 2,5 ч, а также при 2 мг / л и влиянии 2 часа — гибель. Вскрытие показывает, что гибель происходит вследствие ожогов слизистой оболочки верхних дыхательных путей и кровоизлияний и отеков в легких.
Хроническое отравление, возникающее при длительном воздействии акролеина на организм животного приводит к тяжелым последствиям для здоровья. При вдыхании акролеина с концентрацией 0,6 мг / л в течение 6 месяцев наблюдались точечные кровоизлияния на слизистой оболочке дыхательных путей, деструкция бронхов с частичным закрытием их просвета. Введение акролеина через рот в течение такого же срока 0,5 мг / кг вызвало нарушение функции почек, а на вскрытии обнаруживали воспалительные изменения в легких и дистрофические изменения в печени и миокарде.
Воздействие на человека
При кратковременном вдыхании небольших концентраций акролеина человеком возникает жжение в глазах, слезотечение, конъюнктивит, отек век, ощущение жжения в горле, кашель и т. Д .. При больших концентрациях возникают резкие явления раздражения, кроме того, легкое головокружение, приливы крови к головы, боли в животе, тошнота, рвота, посинение губ, акроцианоз. В тяжелых случаях — замедление пульса, гипогликемия, слюнотечение, снижение температуры конечностей, онемение кончиков пальцев, расширение зрачков, приглушенные тоны сердца и даже потеря сознания. Отмечались также состояние возбуждения, дезориентация в пространстве и времени. В легких случаях выздоровление длилось 1-2 дня, в более тяжелых случаях — 4-5 дней. Известно смертельное отравление одного из двух рабочих, которые осуществляли в течение двух часов автогенная сварки внутри котла, служивший для транспортировки рапсового масла.
Пребывание человека в среде с концентрацией акролеина 0,35 мг / л в течение 10 мин является смертельным; вдыхание воздуха с содержанием 0,002 мг / л акролеина в течение 2-3 мин вызывает раздражение глаз и носа; через 5 мин раздражение становится невыносимым; концентрация 0,0006 мг / л вызывает умеренное раздражение при вдыхании в течение 5 минут. Порог восприятия запаха 0,00007 мг / л. Пороговая концентрация по рефлекторным действием 0,00005 мг / л.
При хронических отравлениях человеческого организма акролеин может развиваться повышенная чувствительность к соединения.
Видео:Химия 9 класс: ФосфорСкачать

Видео по теме
Видео:9 класс § 32 "Фосфор и его соединения".Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Взаимодействие хлора с фосфоромСкачать  АкролеинЧто мы делаем. Каждая страница проходит через несколько сотен совершенствующих техник. Совершенно та же Википедия. Только лучше. Видео:Химия фосфора | Химия ЕГЭ | УмскулСкачать  ОткрытиеАкролеин был открыт в 19 веке австрийским химиком Йозефом Редтенбахером при сухой перегонке жиров. В ходе своих исследований ученый также открыл и пропенову кислоту. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  Из Википедии — свободной энциклопедии
Акролеин (лат. acris — острый, едкий + oleum — масло) (пропеналь) — H2C=CH-CHO, альдегид акриловой кислоты, простейший ненасыщенный альдегид. Бесцветная легколетучая слезоточивая жидкость с резким запахом, сильный лакриматор. Видео:Уравнивание реакций горения углеводородовСкачать  Реакционная способностьАкролеин, будучи непредельным альдегидом, проявляет реакционную способность, свойственную как олефинам, так и альдегидам. Так, акролеин образует ацетали: его альдегидная группа легко окисляется до карбоксильной: и восстанавливается до гидроксильной: Карбонильная группа акролеина находится в сопряжении с двойной связью, что обуславливает его высокую реакционную способность по отношению к нуклеофилам, при этом присоединение идёт по β-атому углерода: Галогены присоединяются к акролеину по двойной связи с образованием дигалогенпроизводного, которое далее отщепляет галогеноводород с образованием α-галогенакролеина: Благодаря наличию электронакцепторной альдегидной группы, сопряженной с двойной связью, акролеин является диенофилом и реагирует с диенами с образованием продуктов циклоприсоединения (реакция Дильса-Альдера): Видео:Составление уравнений реакций горения. 11 класс.Скачать  СинтезВ лаборатории акролеин получается дегидратацией глицерина в присутствии гидросульфата калия. В промышленности акролеин получают каталитическим окислением пропилена над оксидными висмут-молибденовыми катализаторами или оксидом меди. Ранее в промышленности был распространён процесс парофазной кротоновой конденсации ацетальдегида с формальдегидом (устаревший метод): Видео:Видеоопыты. Неорганика 106. Сравнение температур воспламенения белого и красного фосфораСкачать  Химические свойстваАкролеин, благодаря явлению таутомерии, находится в постоянном равновесии со своим изомер — пропадиенолом. Это равновесие может быть смещена действием кислотного или основного катализатора: Поскольку акролеин является ненасыщенным альдегидом, то в химических реакциях он проявляет свойства как алкенов, так и альдегидов. В частности акролеин вступает в реакцию гидрогенування, с помощью которой можно получить аллиловый спирт Кроме этого, с помощью действия катализаторов на основе никеля, палладия и платины, реакцию гидрогенування можно повести другим путем и через промежуточное образование пропаналя получить 1-пропанол: В результате хлорирования акролеина получают α, β-дихлоропропаналь. В промышленности α, β-дихлорпропаналь действием соляной кислоты превращают в α-хлоракролеин, который является сырьем для получения α-хлоракрилатних смол: Воздействие на акролеин хлорноватистая кислота приводит к образованию глицеральдегид: Для акролеина характерна реакция окисления с образованием пропеновои кислоты: Гидролиз акролеина может проходить двумя путями. В результате образуются 1,3-пропандиол или сложная димерних состав: Интересна взаимодействие акролеина с аммиаком, в результате которой происходит циклизация с образованием β-пиколина: Как и любая ненасыщенная соединение, акролеин способен соединять собственные молекулы. Так в результате димеризации образуются димеры следующей строения: а полимеризация приводит к образованию полиакролеину. Также с акролеина можно получить незаменимую аминокислоту — метионин. Упрощенно этот процесс записывается следующим образом: Путем реакции Скраупа ароматических аминов с акролеин, который образуется in situ из глицерина в присутствии дегидратирующего агента и окислителя, получают замещены хинолины: Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать  ТоксичностьВследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей соединением, сильный лакриматор. Максимально разовая Предельно допустимая концентрация в воздухе 0,03 мг/м³; Среднесуточная Предельно допустимая концентрация в воздухе 0,01 мг/м³(Список ПДК ГН 2.1.6 1338-03). Вызывает мутагенез у бактерий и дрожжей, проявляет мутагенные свойства на культурах клеток млекопитающих. Относится к I классу опасности (чрезвычайно опасные вещества). Акролеин является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняются раздражающие слизистые оболочки свойства дыма горелого жира. Видео:Взаимодействие безводной азотной кислоты с фосфоромСкачать  ПрименениеНаибольшее количество акролеина расходуется на синтез глицерина без использования хлора, где акролеин гидрогенизують к аллилового спирта, затем с помощью перекиси водорода превращают в глицерин. Наряду с производством аллилового спирта для синтеза глицерина одной из основных областей применения акролеина является синтез метионина. При взаимодействии акролеина с метилмеркаптаном в присутствии катализаторов (пиридин, ацетат меди, пиперидин, этилат натрия) в результате ряда превращений образуется метионин. Реакция акролеина с многофункциональными соединениями приводит к интересным конденсационных полимеров, среди которых особенно известны Полиацетали с многоосновными спиртами. При полимеризации продукта конденсации с пентаэритрита (торговая марка «ультра-лон») получают вещества с хорошей прочностью на разрыв, высокой ударной прочностью, стойкостью к истиранию. Но эти продукты обладают невысокой теплостойкостью (65-104 ° C). В результате гидролиза продукта димеризации акролеина и его дальнейшего гидрирования образуется 1,2,6-гексантриол, который применяется как пластификатор и составная часть при производстве алкидных и полиэфирных смол. Видео:8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать  Физиологическое воздействиеОбщий характер действияОбщий характер действия акролеина выражается в сильном раздражении слизистых оболочек. Кроме этого ненасыщенный альдегид обладает некоторой общей токсичным и слабой наркотической действиями. Влияние на животныхОстрое отравление животных акролеин обычно имеет летальный исход. Так, большинство белых мышей погибает после нескольких минут пребывания в среде с концентрацией акролеина 0,02-0,3 мг / л, а 0,0075 мг / л переносится в течение нескольких часов без серьезных симптомов отравления. Ингаляция паров акролеина вызывает у белых крыс и морских свинок симптомы бронхиальной астмы. Кроме астмы также вызывает эмфизему, полнокровие и расширение капилляров легких, бронхоспазм, поражает нервную систему (прогрессирующие параличи). В результате раздражения слизистых оболочек дыхательных путей возникает значительный отек гортани, отек и деструкция слизистой и подслизистой трахеи и крупных бронхов вплоть до закрытия их просвета. Концентрации 1 и 0,75 мг / л вызывают гибель крыс. При 0,65 мг / л гибель происходит чаще осложнений — возникновение вторичной инфекции и пневмонии. У кошек при 0,25 мг / л возникает слюнотечение, слезотечение, легкий наркоз; при 0,2 мг / л — сильное раздражение легких; при 1,5 мг / л и воздействии 2,5 ч, а также при 2 мг / л и влиянии 2 часа — гибель. Вскрытие показывает, что гибель происходит вследствие ожогов слизистой оболочки верхних дыхательных путей и кровоизлияний и отеков в легких. Хроническое отравление, возникающее при длительном воздействии акролеина на организм животного приводит к тяжелым последствиям для здоровья. При вдыхании акролеина с концентрацией 0,6 мг / л в течение 6 месяцев наблюдались точечные кровоизлияния на слизистой оболочке дыхательных путей, деструкция бронхов с частичным закрытием их просвета. Введение акролеина через рот в течение такого же срока 0,5 мг / кг вызвало нарушение функции почек, а на вскрытии обнаруживали воспалительные изменения в легких и дистрофические изменения в печени и миокарде. Воздействие на человекаПри кратковременном вдыхании небольших концентраций акролеина человеком возникает жжение в глазах, слезотечение, конъюнктивит, отек век, ощущение жжения в горле, кашель и т. Д .. При больших концентрациях возникают резкие явления раздражения, кроме того, легкое головокружение, приливы крови к головы, боли в животе, тошнота, рвота, посинение губ, акроцианоз. В тяжелых случаях — замедление пульса, гипогликемия, слюнотечение, снижение температуры конечностей, онемение кончиков пальцев, расширение зрачков, приглушенные тоны сердца и даже потеря сознания. Отмечались также состояние возбуждения, дезориентация в пространстве и времени. В легких случаях выздоровление длилось 1-2 дня, в более тяжелых случаях — 4-5 дней. Известно смертельное отравление одного из двух рабочих, которые осуществляли в течение двух часов автогенная сварки внутри котла, служивший для транспортировки рапсового масла. Пребывание человека в среде с концентрацией акролеина 0,35 мг / л в течение 10 мин является смертельным; вдыхание воздуха с содержанием 0,002 мг / л акролеина в течение 2-3 мин вызывает раздражение глаз и носа; через 5 мин раздражение становится невыносимым; концентрация 0,0006 мг / л вызывает умеренное раздражение при вдыхании в течение 5 минут. Порог восприятия запаха 0,00007 мг / л. Пороговая концентрация по рефлекторным действием 0,00005 мг / л. При хронических отравлениях человеческого организма акролеин может развиваться повышенная чувствительность к соединения. 📽️ ВидеоВзаимодействие хлора с фосфоромСкачать  Реакция брома с фосфором / Reaction of bromine with phosphorousСкачать  Синтез ПЕНТАХЛОРИДА ФОСФОРАСкачать  Реакция фосфора с металлами и фосфиды / reaction of phosphorous with metals and metal phosphidesСкачать  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||