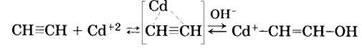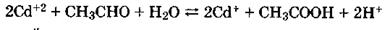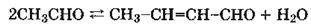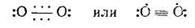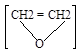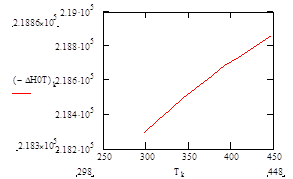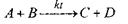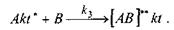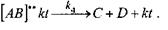Уксусную кислоту можно получать следующими способами:
1) Из метана, являющегося основным компонентом природного газа, получают ацетилен:
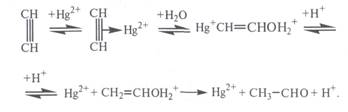
Ацетилен в присутствии сульфата ртути (II) присоединяет воду, образуется уксусный альдегид (реакция Кучерова):
При окислении уксусного альдегида образуется уксусная кислота:
2) При гидратации этилена, являющегося побочным продуктом крекинга нефти, получают этиловый спирт:
При окислении этилового спирта получают уксусную кислоту:
3) Уксусную кислоту можно получить при окислении бутана в присутствии катализатора:
Наиболее перспективным является последний метод, так как бутан является компонентом природного газа и попутных нефтяных газов, а уксусная кислота получается в одну стадию.

задача №12
к главе «Глава XIV. Обобщение знаний по курсу органической химии».
Видео:Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Синтез уксусной кислоты из этилена методом каталитического окисления
Такое вещество как этилен входит в состав большинства газов-отходов заводов, занимающихся нефтепереработкой. В этих газах может содержаться 5-25% этилена, в зависимости от типа переработки нефти. Кроме этого, этилен может быть очень просто получен пиролизом пропана и этана, которые входят в состав тех же газов. Большое количество этилена получается при производстве дивинила из этилового спирта методом акад. С.В. Лебедева. В США большие количества этилена получают из природных газов, а также из бензина. Такое вещество как концентрированная уксусная кислота, также можно получить из этилена, через этиловый спирт-ацетальдегид, а также прямым окислением через ацетальдегид. Этиловый спирт, который получают при гидратации этилена, является очень важным источником для выработки синтетической уксусной кислоты. Что касается синтеза уксусной кислоты из этилового спирта, то его можно выполнить методом каталитического дегидрирования (с одновременным синтезом этилацетата), а также методом каталитического окисления и применяя комбинированный метод. Также существует завод производства уксусной кислоты методом прямого окисления этилового спирта.
Метод каталитического окисления заключается в следующем – над дегидрирующими катализаторами спиртовые пары пропускают в смеси с чистым воздухом, при температуре 550-600°С. В ходе дегидрирования спирта образуются водород и ацетальдегид. Водород сразу же окисляется кислородом воздуха в воду. Следовательно, благодаря связыванию водорода во время его выделения равновесия стремительно сдвигается в сторону ацетальдегидного образования. Поскольку процесс окисления экзотермический, то выделяется большое количество тепла. В реальных условиях тепла выделяется еще больше, поскольку некоторая часть спирта сгорает. В любом случае, тепло, которое выделяется в ходе окисления этилового спирта, способствует поддержанию в каталитической зоне, так что дополнительного подогрева извне не нужно. Катализатор при окислении может служить более продолжительное время, нежели при дегидрировании спирта и, следовательно, не нуждается в частой регенерации. Катализатором может служить серебро на пемзе. Наличие воды в спирте благоприятно влияет на весь процесс окисления, поскольку это уменьшает побочные реакции. Если же применять активные катализаторы, то присутствие воды в спирте просто необходимо.
При контактировании значительная часть спирта сгорает до С02 и Н2О а ацетальдегид, уносимый из конденсаторов большим объемом газов (азотом воздуха, двуокисью углерода и другими газами), в значительной мере теряется в системе улавливания. В этом процессе для получения одной тонны 90%-ного ацетальдегида, благодаря которому потом можно будет купить кислоту, затрачивается до 1,8т 95%-ного спирта. Ввиду экзотермичности процесса здесь не затрачивается тепло на обогревание контактного аппарата. В настоящее время метод получения ацетальдегида окислением спирта широко используется промышленностью. Получающийся ацетальдегид перерабатывают на уксусную кислоту, как описано ранее. Получение ацетальдегида окислением этилового спирта производят также на заводах синтетического каучука, на которых каталитическому превращению в дивинил подвергают смесь этилового спирта и ацетальдегида.
Дмитриевский химический завод — это ведущий производитель растворителей в России. Производство многокомпонентных растворителей, бутилацетата и уксусной кислоты реализуется уже более чем 100 лет. Поставляем растворители на ведущие автоконцерны России. Есть опция изготовления растворителя по рецептуре заказчика. Растворитель 646 от Дмитриевского химического завода — это продукт эталонного качества по доступной цене.
Видео:Опыты по химии. Получение этилена и опыты с нимСкачать

Дипломная работа: Получение уксусной кислоты
| Название: Получение уксусной кислоты Раздел: Рефераты по химии Тип: дипломная работа Добавлен 10:47:14 01 декабря 2010 Похожие работы Просмотров: 4190 Комментариев: 20 Оценило: 2 человек Средний балл: 5 Оценка: неизвестно Скачать | ||||
| Ткип /Тпл, °С | Примечание | |||
| Ацетальдегид | жидкость | 773 | 20,8 / -123,5 | Токсичен, ПДК составляет 5 мг/м 3 . Неограниченно растворим в воде. |
| Этилен | газ | 1,26 | -103,7/-169,15 | |
| Кислород | газ | 1,43 | -182,98/-218,7 |
1.3.2 Электронная структура реагентов и продуктов реакции
1.3.2.1.Электронная структура этилена
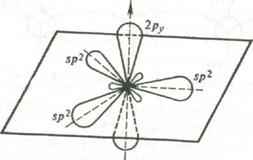
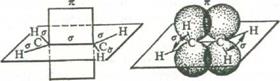
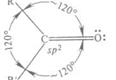
Главным структурным элементом, определяющим реакционную способность этилена, как и всех олефинов, является двойная связь, представляющая собой сочетание σ- и π-связей ( sp 2 -гибридизация).
При образовании двойных связей в молекулах ненасыщенных соединений встречают с гибридизацию одной s- и двух р-орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемую sp 2 -орбиталями. Каждая из них имеет цилиндрическую симметрию относительно одной из трех осей, расположенных в плоскости под углом 120°, В реальной молекуле этилена угол Н-С-Н равен 116,7°[16, с.30].
Рис. 1 Схема образования sp 2 -гибридного состояния электронной оболочки атома углерода
Ось четвертой атомной р-орбитали, не затронутой гибридизацией, расположена под прямым углом к плоскости, в которой лежат три оси sp 2 -гибридных орбиталей.
Перекрывание трех гибридизованных орбиталей с орбиталями других атомов дает σ-связи. Перекрывание двух негибридизованных p-орбиталей между собой дает так называемую π-связь.
π-Связь менее прочна, чем σ-связь, так как p-электронные орбитали с параллельными осями перекрываются значительно меньше, чем при образовании теми же p-электронами или s-электронами σ -связи (перекрывание по оси орбиталей). Общая прочность (σ + π)-связей в этилене составляет 607,1 кДж/моль, в то время как для σ -связи между двумя углеродными атомами в этане она составляет 350,0 кДж/моль. Разница 257,1 кДж/моль является приблизительной мерой прочности π -связи.
Таким образом, двойная связь представляет собой сочетание σ- и π-связей. Последняя обладает максимальной прочностью, когда молекула имеет пленарную (плоскостную) конфигурацию. Для поворота в молекуле этилена одной группы СН2 относительно другой группы СН2 вокруг оси С — С необходимо приложить энергию, достаточную, чтобы разорвать π-связь и вернуть два электрона на отдельные p-орбитали. Энергия молекулярных столкновений при обычной температуре для этого недостаточна и потому вокруг двойной связи нет свободного вращения[16, с. 31].
Рис.2 Схематическое изображение строения молекулы этилена
Длина олефиновой связи (σ + π-связь) между двумя ненасыщенными углеродами в алкенах меньше, чем длина простой σ-связи в насыщенных углеводородах (0,154 нм), и составляет 0,134 нм. Это понятно: чем больше концентрируется электронное облако между ядрами, тем более сильно они стягиваются.
При сравнении структурных и энергетических параметров молекул алканов и алкенов видно, что двойная связь значительно короче и прочнее ординарной связи. Однако энергия двойной связи меньше, чем энергия двух ординарных, на 92,1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерна реакция электрофильного присоединения. [16, с.79]
1.3.2.2Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с -30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. [16, с. 166]
Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3Электронная структура кислорода
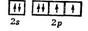
Кислород О имеет электронную конфигурацию невозбужденного атома
В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать следующими структурными формулами:
Тремя точками обозначены связи, обусловленные двумя π св — и одним π разр -электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают π разр -электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).[17, с. 337]
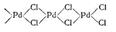
1.3.2.4Электронная структура катализатора PdCl2
В процессе окисления этилена в ацетальдегид как правило применяется катализатор PdCl2, в качестве промотера применяется CuCl2, либо FeCl3.
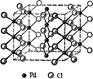
Структурной единицей соединений Pd (II) является квадрат. Кристаллы PdCl2 (рис. 4) имеют цепное строение с квадратной структурной единицей PdCl4 [17, с. 649]:
Рис. 4. Структура PdCl2
1.3.3 Химические свойства реагентов и продуктов реакции
1.3.3.1 Химические свойства этилена
1. Гидрирование. Алкены непосредственно молекулярный водород не присоединяют. Эту реакцию можно осуществить только в присутствии гетерогенных (Pd, Pt, Ni) или гомогенных (например, хлортристрифенилфосфин родия RhCl(Ph3P)3) катализаторов. Наиболее часто проводят каталитическое гидрирование на гетерогенных катализаторах:
СН2=СН2 + Н2 
2. Галогенирование. Олефины легко присоединяют галогены:
СН2=СН2 + Вг2 
Скорость реакции зависит от природы галогена и строения олефина. Фтор реагирует с воспламенением, иод — медленно на солнечном свету.[16, с.79]
Присоединение происходит по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделяется отрицательный ион галогена. К возникающему карбениевому или бромониевому катиону (присоединяется отрицательный ион галогена.
3. Гидрогалогенирование. Олефины присоединяют все галогеноводороды:
CH2 = СН2 + НС1 
Наиболее легко реагирует йодистый водород. Фтористый водород часто (особенно в присутствии влаги) присоединяется с одновременной полимеризацией олефина. С хорошими выходами алкилфториды получаются при действии на алкены растворов HF в третичных аминах (триэтиламин, пиридин) и тетрагидрофуране при О°С. Присоединение хлористого водорода требует обычно нагревания или присутствия катализаторов.
Механизм электрофильного присоединения галогеноводородов двухступенчатый, как и механизм присоединения галогенов, однако π-комплексы в этом случае, вероятно, не образуются: реакции идут через карбениевые ионы и, следовательно, должны быть нестереоспецифичными. Наблюдаемая в ряде случаев стереоспецифичность объясняется тем, что в реакции участвуют не свободные карбениевые ионы, а ионные пары карбениевый ион — анион.[16, с. 81]
4. Гипогалогенирование. Присоединение к олефинам гипогалогенитных кислот и их эфиров осуществляется согласно следующей реакции:
CH2 = СН2 + НОС1 
5. Гидратация . В присутствии катализаторов олефины присоединяют воду, образуя спирты [16, с. 83]:
СН2=СН2 + НОН 
6. Окисление . Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя.
а) Кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических оксидов:
2СН2=СН2 + О2 
б) Разбавленный раствор перманганата калия (реакция Вагнера) или пероксид водорода в присутствии катализаторов (CrO3, OsO4 и др.) с олефинами образуют гликоли. По месту двойной связи присоединяются два гидроксила:
3СН2=СН2 + 2KMnO4 + H2O
СН2=СН2 + H2O2
в) При действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) молекула этилена разрывается по месту двойной связи, образуя муравьиную кислоту:
CH2 = СН2 
д) Прои реакции озонолиза, озон присоединяется по месту двойной связи, образуя нестойкое соединение, озонид, при обработке водой из него образуется пероксид водорода и муравьиный альдегид:
CH2 = СН2 + О3
7. Полимеризация. Одним из наиболее важных для современной техники превращений олефинов является реакция полимеризации. Полимеризация олефинов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов [16, с. 87].
n CH2=CH2
1.3.3.2 Химические свойства ацетальдегида
1. Гидрирование. Присоединение водорода к происходит в присутствии катализаторов гидрирования (Ni, Со, Си, Pt, Pd и др.). При этом он переходит в этиловый спирт:
CH3CHO + H2
При восстановлении альдегидов или кетонов водородом в момент выделения (с помощью щелочных металлов или амальгамированного магния) образуются наряду с соответствующими спиртами в незначительных количествах образуются также гликоли:
2 CH3CHO + 2Н
2. Реакции нуклеофильного присоединения
2.1 Присоединение магнийгалогеналкилов [16, с.168]
СН3 – СН2 – MgBr + CH3CHO
2.2 Присоединение синильной кислоты приводит к образованию нитрила α-гидроксипропионовой кислоты:
CH3CHO + HCN 
2.3 Присоединение гидросульфита натрия дает кристаллические вещество – производное ацетальдегида:
CH3CHO + HSO3Na
2.4 Взаимодействие с аммиаком приводит к образованию ацетальдимина [16, 169] :
CH3CHO + NH3
2.5 С гидроксиламином ацетальдегид, выделяя воду, образует ацетальдоксимоксим:
CH3CHO + H2NOH 
2.6 Особый интерес представляют реакции ацетальдегида с гидразином и его замещенными [16, с. 171]:
CH3CHO + H2N – NH2 + OCHCH3 
2.7 Ацетальдегид способен присоединять по карбонильной группе воду с образованием гидрата — геминального гликоля. При 20˚С ацетальдегид в водном растворе на 58% существует в виде гидрата
–C– + HOH 
2.8При действии на ацетальдегид спиртов образуются полуацетали:
CH3CHO + HOR 
В присутствии следов минеральной кислоты образуются ацетали[16, с. 172]
CH3 – CH + ROH 
2.9 Ацетальдегид при взаимодействии с РС15 обменивает атом кислорода на два атома хлора, что используется для получения геминального дихлорэтана:
CH3CHO + РС15
3. Реакции окисления
Ацетальдегид окисляются кислородом воздуха до уксусной кислоты. Промежуточным продуктом являются надуксусная кислота:
CH3CHO + O2 
CH3CO-OOH + CH3CHO
Аммиачный раствор гидроксида серебра при легком нагревании с альдегидами окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности — образуется серебряное зеркало [16, 173]:
CH3 CHO + 2[Ag(NH3)2]OH
4. Реакции полимеризации
При действии на ацетальдегид кислот происходит его тримеризация, образуется паральдегид:
3CH3CHO
Ацетальдегид реагирует с бромом и иодом с одинаковой скоростью независимо от концентрации галогена. Реакции ускоряются как кислотами, так и основаниями.
CH3CHO + Br2
При нагревании с трис(трифенилфосфин)родийхлоридом претерпевают декарбонилирование с образованием метана:
CH3CHO + [(C6H5)P]3RhCl
7.1 Альдольная конденсация
В слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) ацетальдегид подвергаются альдольной конденсации по А. П. Бородину с образованием альдегидоспирта (3-гидроксибутаналя), сокращенно называемого альдолем. Альдоль образуется в результате присоединения альдегида к карбонильной группе другой молекулы альдегида с разрывом связи С — Н в α-положеиии к карбонилу:
CH3CHO + CH3CHO 
Альдоль при нагревании (без водоотнимающих веществ) отщепляет воду с образованием непредельного кротонового альдегида (2-бутеналя) [16, с. 176]:
CH3–CHOH–CH2–CHO 
Поэтому переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией. Дегидратация происходит благодаря очень большой подвижности водородных атомов в α-положении по отношению к карбонильной группе (сверхсопряжение), причем разрывается, как и во многих других случаях, р-связь по отношению к карбонильной группе.
7.2 Сложноэфирная конденсация
Проходит с образованием уксусноэтилового эфира при действии на ацетальдегид алкоголятов алюминия в неводной среде (по В. Е. Тищенко):
2CH3CHO
7.3 Конденсация Клайзена— Шмидта.
Эта ценная синтетическая реакция состоит в катализируемой основаниями конденсации ароматического или иного альдегида, не имеющего водородных атомов, с алифатическим альдегидом или кетоном. Например, коричный альдегид может быть получен встряхиванием смеси бензальдегида и ацетальдегида примерно с 10 частями разбавленной щелочи и выдерживанием смеси в течение 8—10 суток. В этих условиях обратимые реакции приводят к двум альдолям, но один из них, в котором 3-гидроксил активирован фенильной группой, необратимо теряет воду, превращаясь в коричный альдегид[18, с. 554]:
C6H5—CHO + CH3CHO 

1.3.3.3 Химические свойства кислорода
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды. Лишь по отношению к фтору кислород проявляет восстановительные свойства.
Подобно фтору кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). С галогенами, криптоном, ксеноном, золотом и платиновыми металлами он непосредственно не реагирует, и их соединения получают косвенным путем. Со всеми остальными элементами кислород соединяется непосредственно. Эти процессы обычно сопровождаются выделением теплоты.
Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений принимается равной -2. Кроме того, кислороду приписывают степени окисления +2 и + 4, а также +1(F2O2) и -1(Н2О2) [17, с. 337].
Наиболее активно окисляются щелочные и щелочноземельные металлы, причем в зависимости от условий образуются оксиды и пероксиды:
Некоторые металлы в обычных условиях окисляются лишь с поверхности (например, хром или алюминий). Образующаяся пленка оксида препятствует дальнейшему взаимодействию. Повышение температуры и уменьшение размеров частиц металла всегда ускоряют окисление. Так, железо в нормальных условиях окисляется медленно. При температуре же красного каления (400 °С ) железная проволока горит в кислороде:
3Fe + 2О2 = Fe3 O4
Тонкодисперсный железный порошок (пирофорное железо) самовоспламеняется на воздухе уже при обычной температуре.
С водородом кислород образует воду:
При нагревании сера, углерод и фосфор горят в кислороде. Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:
Водородные соединения горят в кислороде, например:
2H2S + ЗО2 = 2SO2 + 2Н2О (при избытке О2)
2Н2S + О2 = 2S + 2Н2О (при недостатке О2)
СН4 + 2О2 = СО2 + 2Н2О
2. Термодинамический анализ основной реакции
2.1 Исходные данные для термодинамических расчётов
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2 = СН2 + 0,5О2 
Справочные данные термодинамических величин исходных веществ и продукта реакции имеют следующие значения[19]:
| Вещество | ΔН°f, 298, кДж/моль | S°298, Дж/моль•К | с°р= f(T) | |||
| a | b•10 3 | c’•10 -5 | c•10 6 | |||
| СН3СНО | -166 | 264,20 | 13,00 | 153,50 | — | -53,70 |
| С2Н4 | 52,30 | 219,45 | 11,32 | 122,01 | — | -37,90 |
| О2 | 0 | 205,04 | 31,46 | 3,39 | -3,77 | — |
2.2 Расчёт термодинамических функций
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc’T -2 + ΔcT 2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10 -3
Δc’= Σ(υc’)j – Σ(υc’)i = 1,88•10 5
Δc= Σ(υc)j – Σ(υc)i = –15,8•10 -6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298 2 – 298 2 )/2 – Δc'(T -1 – 298 -1 )+ Δc(T 3 – 298 3 )
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т , кДж/моль | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc’/2(T — 2 – 298 — 2 )+ + Δc/2(T 2 – 298 2 )
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
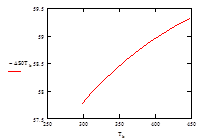
| –ΔS° Т , Дж/моль | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
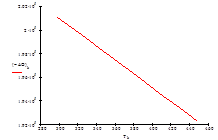
| –ΔG° Т , кДж/моль | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
вычислим значения констант равновесия:
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| lnkp | 76,9388 | 73,1007 | 69,5973 | 66,3866 | 65,7352 | 62,5208 | 59,8453 | 57,3843 | 53,6606 | 51,6252 |
| kp | 2,59•10 33 | 5,59•10 31 | 1,68•10 30 | 6,78•10 28 | 2,47•10 28 | 1,39•10 27 | 9,78•10 25 | 8,35•10 24 | 2,02•10 23 | 2,63•10 22 |
Сведём полученные данные в таблицу термодинамических функций реакции:
| Т, КТ, К | 298 | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т кДж/моль | 218,3 | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
| –ΔS° Т Дж/моль | 57,77 | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
| –ΔG° Т кДж/моль | 201,08 | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
| kp | 1,77•10 35 | 2,59•10 33 | 5,59•10 31 | 1,68•10 30 | 6,78•10 28 | 2,47•10 28 | 1,39•10 27 | 9,78•10 25 | 8,35•10 24 | 2,02•10 23 | 2,63•10 22 |
1. Выполненные расчёты термодинамических функций показывают, что реакция окисления этилена в ацетальдегид идёт с выделением теплоты. Причём с увеличением температуры реакционной массы абсолютное значение ΔН°Т немного увеличивается. Согласно принципу Ле-Шателье для увеличения выхода продукта реакции, идущей с выделением теплоты, необходимо осуществлять отвод тепла от реакционной смеси.
2. Изменение энтропии для данной реакции во взятом интервале температур отрицательно. То есть в изолированной системе самопроизвольное протекание данной реакции в прямом направлении невозможно. Значение ΔS° Т с повышением температуры возрастает, следовательно возрастают и термодинамические трудности протекания процесса. Однако на практике имеют дело с неизолированными системами и этот параметр в нашем случае не может служить критерием направленности химической реакции.
3. О направленности химической реакции в изобарно-изотермических условиях судят по значению изменения свободной энергии Гиббса ΔG° Т. Расчёт показывает, что ΔG° Т во всём изученном интервале температур отрицательно, следовательно в пределах этих температур возможно самопроизвольное протекание реакции в прямом направлении. При увеличении температуры абсолютное значение изменения свободной энергии Гиббса уменьшается, значит с увеличением температуры возникают трудности для протекания процесса в прямом направлении. Следовательно при проведении процесса необходимо отводить тепло, выделяющееся в ходе реакции.
4. Константы равновесия для всего интервала температур значительно больше единицы, поэтому в реакционной смеси при достижении состояния равновесия продукты реакции будут существенно преобладать над исходными веществами. С увеличением температуры соотношение между продуктами реакции и исходными веществами в равновесном состоянии будет уменьшаться (уменьшается значение kp), следовательно и выход продукта уменьшится. Для увеличения выхода необходимо постоянно охлаждать реакционную смесь, отводя выделяющуюся теплоту.
Таким образом для получении максимально возможного выхода ацетальдегида при проведении окисления этилена кислородом следует выбрать реактор, оснащённый теплообменной рубашкой.
3. Механизм реакции получения ацетальдегида
Процесс синтеза ацетальдегида из этилена в присутствии палладиевого катализатора относится к гомогенно-каталитическим.
Гомогенные каталитические процессы, типа:
обычно начинаются с образования промежуточного комплекса Akt в результате обратимого воздействия между катализатором (kt) и одним из исходных реагентов (А):
Во второй стадии, образовавшийся промежуточный комплекс взаимодействует со вторым реагентом, образуя активированный комплекс [АВ]** kt:
В третьей стадии в результате распада [АВ]**kt образуются продукты реакции[20, с. 70]:
3.1 Механизм реакции
Каталитическое окисление этилена до ацетальдегида в гомогенном водном растворе на палладиево-медном катализаторе при 20—60°С известно как вакер-процесс, по названию компании, в которой в конце пятидесятых годов этот процесс был разработан Шмидтом. Этот процесс является одним из ранних примеров промышленного использования гомогенного катализа. В последующие годы значительное внимание исследователей было уделено реакционному механизму и возможностям влияния на состав образующихся продуктов
Стехиометрическая реакция, в которой Pd(II) восстанавливается до металла, была описана еще в 1894 г. Открытие Шмидта заключалось в том, что он сумел окислить Pd(0) действием CuCl2:
Pd° + 2CuCl2 
Этот факт в сочетании с простым окислением соли меди кислородом или воздухом:
2CuCl + 2HCl + 1/2O2 
позволил использовать данную реакцию в промышленно важном производстве.
Общая реакция окисления этилена воздухом приведена в суммарном уравнении:
C2H4 + 1/2O2
Окисление Pd° ионом Cu 2+ облегчается присутствием избытка ионов Сl, так как окислительный потенциал Pd°
Общая экспериментальная скорость определяется уравнением [21, с. 246]:
rOx= – d[C2H4]/dt=k[PdCl 2- ][C2H4]/[H + ][Cl — ] 2
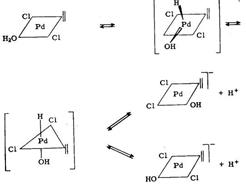
На начальной стадии происходит очень сильное поглощение этилена, затем этилен поглощается медленнее. Объем поглощаемого вначале этилена превышает количество, необходимое для насыщения реакционного раствора этиленом (установлено в отсутствие палладиевой соли). Это четко свидетельствует об образовании этилен-палладиевого комплекса. Избыточный объем поглощаемого этилена уменьшается по мере увеличения в растворе концентрации ионов С1 — но на него не влияет изменение концентрации кислоты. Довольно правдоподобное объяснение этого заключается в том, что начальную реакцию можно представить равновесной реакцией обмена лигандов:
[PdCl4] 2- + C2H4 
Очевидно, избыток С1 — сдвигает равновесие влево. Последующее более медленное поглощение этилена определяется уравнением скорости, приведённым выше.
Если предположить, что плоскоквадратный комплекс [PdCl3(C2H4)] — является основным промежуточным соединением в общем процессе, то становится понятным дополни то становится понятным дополнительное ингибирование С1 — ионами и Н + -ионами и результате следующих двух равновесий:
[PdCl3(C2H4)] — + H2O
[PdCl2(H2O)(C2H4)] 
Следующей, определяющей скорость реакции стадией, будет внедрение координационно связанного алкена в связь Pd—ОН с образованием палладийорганического промежуточного соединения:
[PdCl2(OH)(C2H4)] — 
Затем быстрое разложение последнего продукта дает альдегид и металлический палладий:
[PdCl2(CH2CH2OH)] — 
Детали именно этой реакции до сих пор являются предметом разнообразных спекуляций. Существует доказательство, что имеет место перенос водорода от β-атома углерода к α-атому углерода у палладия; предполагается также, что происходит взаимодействие металл—водород[21, с. 247]:
[PdCl2(CH2CH2OH)] — 


3.2 Анализ факторов, влияющих на протекание реакции окисления этилена
3.2.1 Влияние строения субстрата
Вакер-процесс применим для большинства алкенов; в общем случае α-алкены дают метилкетоны и некоторое количество альдегидов:
RCH=CH2
Замещенные алкены с электроноакцепторными группами (Y = =CN, NO2) непосредственно при двойной связи присоединяют кислород к углероду, удаленному от этой группы:
YCH=CH2 
Как было сказано наиболее важной стадией вакер-процесса является внедрение алкена в полярную связь Pd + —ОH — . Направление присоединения кислорода предсказывается правилом Марковникова.
Алкены с карбоксильной группой и винилгалогениды теряют заместитель в процессе реакции, давая метилкетоны:
RCH=CH–COOH 
RCCl=CH2 
Циклические алкены, вплоть до циклогептена, дают циклические кетоны:
(CH2)n 
Диеновые углеводороды реагируют с миграцией двойной связи:
CH2=CH – CH=CH2
CH2=CH –CH2–CH=CH2 
Высшие алкены требуют более высоких температур. Они имеют тенденцию давать смесь кетонов (по причине миграции двойной связи)[21, c. 246].
3.2.2 Влияние строения атакующей частицы. Влияние строения уходящей группы
Замещение С1 — на ОН — предположительно затрагивает Cl-лиганд в транс-положении по отношению к этилену. С другой стороны, внедрение согласно современным представлениям требует взаимного цис-положения для алкена и ОН-лиганда. Предполагают, что значительная концентрация цис-молекул обеспечивается обратимой изомеризацией, которая идет через образование промежуточного пентакоординационного соединения[21, с. 249]:
3.2.3 Влияние растворителя
Процесс окисления этилена является гомогенным каталитическим, протекает при действии соли палладия (другие окисляющие агенты , например Fе 3+ и К2 Сг07 , тоже можно в принципе использовать, но все же Сu 2+ предпочтительнее из-за легкости окисления Сu + кислородом). По этой причине проведение превращения требует наличия полярного растворителя, хорошо растворяющего соль палладия.
В промышленности в качестве растворителя применяют воду. Как было показано выше замещение С1 — на ОН — в лиганде [PdCl4] 2- является одной из стадий процесса. При замене растворителя ион ОН — заменяется на другой. Соответственно применение других растворителей может привести к изменению течения реакции, получению совершенно других продуктов.
Так, Если этилен окислить в уксусной кислоте в качестве растворителя, то получается винилацетат с примесью побочных продуктов[21, с. 246]:
CH3 – COOPd + C2H4 

4. Выбор типа реактора
При изучении процесса синтеза ацетальдегида окислением этилена кислородом были выявлены ряд особенностей данного процесса, основываясь на этих особенностях следует выбрать тип аппарата для проведения реакции.
Процесс окисления этилена в ацетальдегид идёт при действии соли палладия, растворённой в воде, то есть он относится к группе гомогенно-каталитических процессов. Для проведения синтеза необходимо пропускать газообразный этилен, либо смесь кислорода и этилена, через раствор катализатора. Это предполагает выбор такого реактора, в котором создаются условия для перехода газообразного этилена в водный раствор, содержащий катализатор. Требуется обеспечить эффективный контакт газа с жидкость, который может обеспечить газораспределительное устройство. Для интенсификации процесса аппарат целесообразно заполнить насадкой.
Раствор катализатора приготовляется с использованием соляной кислоты, поэтому он обладает сильными коррозионными свойствами. В условиях такой агрессивной среды для изготовления корпуса аппарата пригоден не любой материал, а лишь обладающий кислотоупорными свойствами. Таким материалом может быть, например, титан. В случае необходимости применения насадки, при её выборе также следует учесть коррозионную устойчивость её материала. Например, в качестве насадки могут быть выбраны керамические кольца.
Синтез идёт при избыточном давлении 0,8-1,3 МПа, поэтому должно выполняться условие герметичности аппарата. Аппарат должен быть спроектирован таким образом, чтобы выдерживать это давление, особое внимание следует уделять прочности сварных швов.
Процесс ведётся при 100–120°С, в этих условиях, как показывает термодинамический анализ, тепловой эффект реакции синтеза ацетальдегида будет равен –218,6 — –218,68 кДж/моль. То есть реакция идёт со значительным выделением тепла. Величина теплового эффекта влияет на поверхность теплообмена реактора. С другой стороны тепло реакции расходуется на нагрев реагентов и свежих порций катализаторного раствора. В условия проведения реакции катализаторный раствор кипеть не будет, поэтому для отвода избыточного количества тепла необходимо оборудовать реактор рубашкой.
Побочные реакции последовательны, то есть для большей селективности процесса следует как можно быстрее выводить продукт основной реакции из реактора. Реактор следует выбрать из той группы аппаратов, где процесс по гидродинамическому режиму приближен к реактору идеального вытеснения.
Проведению процесса синтеза ацетальдегида окислением этилена кислородом с учётом всех этих особенностей наиболее полно удовлетворяют аппараты барботажного типа. В них создаются оптимальные условия для перехода этилена в раствор катализатора. Гидродинамический режим аппаратов этого типа по газовой фазе приближен к РИВ, по жидкой – к РИС. Как было показано выше, корпус аппарата должен быть выполнен из титана.
5. Расчёт реактора
5.1 Материальный баланс
Проведём расчёт материальных потоков процесса получения ацетальдегида окислением этилена кислородом воздуха.
СН2=СН2 + 0,5О2 
СН2=СН2 + О2 
СН2=СН2 + 3О2 
Производительность реактора по этилену 50 кг/час.
Число дней работы реактора в году n=340.
Технологический выход продукта 89%;
Степень превращения этилена 92%.
Селективность (1) – 90%, (2) – 3%, (3) – 7%.
Состав этилено-воздушной смеси: этилен – 10%, об.; воздух – 90%, об.
Состав воздуха: О2 – 21%, об., N2 и др. инертные примеси – 79%, об.
1. Производительность реактора по этилену в кмоль/час:
GC2H4= GC2H4/М C2H4=50/28=1,786 кмоль/час
2. Производительность по этаналю согласно стехиометрии реакции:
G»’CH3СНО= GC2H4=1,786 кмоль/час (78,58 кг/час)
С учётом степени превращения этилена:
G»CH3СНО= G»’CH3СНО ·XC2H4= 1,786 · 0,92=1,643 кмоль/час (72,29 кг/час)
С учётом селективности реакции:
G’CH3СНО= G»CH3СНО · Ф CH3СНО= 1,643· 0,9=1,479 кмоль/час (65,08 кг/час)
С учётом технологического выхода:
GCH3СНО= G’CH3СНО ·fCH3СНО=1,479·0,89=1,316 кмоль/час (57,90 кг/час)
Технологические потери ацетальдегида:
Gпотерь = G’CH3СНО – GCH3СНО= 65,08 – 57,90= 7,18 кг/час
3. Этилен, идущий на побочные реакции (согласно стехиометрии):
GC2H4= G»CH3СНО – G’CH3СНО=1,643 – 1,479=0,164 кмоль/час
В том числе на реакцию (2):
GC2H4= [Ф(2)/(Ф(2)+Ф(3))] · GC2H4=[3/10] ·0,164=0,049 кмоль/час
GC2H4= [Ф(3)/(Ф(2)+Ф(3))] · GC2H4=[7/10] ·0,164=0,115 кмоль/час
4. Количество непрореагировавшего этилена (согласно стехиометрии реакции (1)):
G0ст.C2H4= G»’CH3СНО – G»CH3СНО=1,786 – 1,643=0,143 кмоль/час (4,00 кг/час)
5. Количество воздуха:
Gвозд= (G»’CH3СНО·90)/10=(1,786·22,4·90)/10=360,06 м³/час
В том числе азота:
GN2= Gвозд·0,79=360,6·0,79=284,45 м³/час (12,698 кмоль/час; 355,54 кг/час)
GО2= Gвозд·0,21=360,6·0,21=75,61 м³/час (7,367 кмоль/час; 108,02 кг/час)
6. Кислород, расходуемый на химические реакции:
G (1) О2= (ν О2/ ν CH3СНО ) ·G’ CH3СНО=(1/2) ·1,479= 0,739 кмоль/час (23,65 кг/час)
G (2) О2= (ν О2/ ν C2H4 ) ·GC2H4=(11) ·0,049=0,049 кмоль/час (1,57 кг/час)
G (3) О2= (ν О2/ ν C2H4 ) ·GC2H4=(31) ·0,115=0,345 кмоль/час (11,04 кг/час)
1. Непрореагировавший кислород:
G’О2= GО2 – (GО2+ GО2+ GО2) = 108,03 – (23,65 – 1,57 – 11,04)=71,77 кг/час (2,243 кмоль/час)
2. Количество СН3СНО:
GCH3СООН = (ν CH3СООН/ ν C2H4 ) GC2H4= (1/1) ·0,049 кмоль/час (2,95 кг/час)
3. Количество СО2:
GCО2 = (ν CО2/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (10,12 кг/час)
4. Количество Н2О:
GН2О = (ν Н2О/ ν C2H4 ) GC2H4=(2/1) · 0,115= 0,230 кмоль/час (4,14 кг/час)
Полученные данные сведём в таблицу материального баланса:
| Состав сырья | Кг/час | %,масс | Кмоль/час | %, моль | м³/час | %, об. |
| С2Н4 | 50 | 9,7 | 1,786 | 10 | 40,0 | 10 |
| N2 | 355,54 | 69,2 | 12,698 | 71,1 | 284,45 | 71,1 |
| O2 | 108,03 | 21,1 | 3,376 | 18,9 | 285,61 | 18,9 |
| Итого | 513,57 | 100 | 17,86 | 100 | 400,06 | 100 |
| Состав реакц. смеси | Кг/час | %,масс | Кмоль/час | %, моль | м³/час | %, об. |
| С2Н4 | 4,00 | 0,8 | 0,143 | 0,8 | 3,1 | 0,8 |
| N2 | 355,54 | 69,2 | 12,698 | 74,4 | 284,48 | 74,4 |
| O2 | 71,77 | 14,0 | 2,243 | 13,1 | 50,2 | 13,1 |
| СН3СНО | 57,90 | 11,2 | 1,316 | 7,7 | 29,5 | 7,7 |
| потери СН3СНО | 7,18 | 1,4 | 0,163 | 0,9 | 3,6 | 0,9 |
| СН3СООН | 2,93 | 0,6 | 0,049 | 0,3 | 1,1 | 0,3 |
| СО2 | 10,12 | 2,0 | 0,230 | 1,4 | 5,1 | 1,4 |
| Н2О | 4,14 | 0.8 | 0,230 | 1,4 | 5,1 | 1,4 |
| Итого | 513,58 | 100 | 17,072 | 100 | 382,15 | 100 |
Массовые потоки приходной и расходной части совпадают, следовательно материальный баланс составлен верно.
5.2 Расчет параметров реактора
Определим количество катализаторного раствора, необходимое для окисления 50 кг/час этилена. Согласно литературным данным катализаторный раствор содержит 0,3 – 0,5 % PdCl2. Примем содержание PdCl2 равным 0,5 %.
Согласно стехиометрии реакции:
CH2=CH2 +PdCl2 + H2O 
количество вещества PdCl2 равно:
GPdCl2 = GC2H4 = 1,786 кмоль/час
Тогда масса катализатора m
PdCl2 = GPdCl2 · MPdCl2 = 1,786 · 177 = 316,12 кг/час
Расход катализаторного раствора:
mр = 316,2 · 100/0,5 = 63224,4 кг/час
Плотность раствора 1281,6 кг/м³ [22, с. 106], тогда объёмный расход катализаторного раствора:
Gkt = mр/ρ = 63224,4/1281,6 = 49,33 м³/час
Коэффициент газонасыщения: k = GC2H4/ Gkt = 40/49,33 = 0,81 м³/м³
Пользуясь методикой для расчёта барботажных колонн [23, с. 265], рассчитаем параметры реактора.
Диаметр барботажной колонны:
где ωг – приведённая скорость (ωг 0,1), примем ωг = 0,01
Vг – расход барботирущего газа, приведённый к рабочим условиям
Vг = Vг,0 TрP0/T0Рр = (40/3600) · (383/298) · (0,1/1,0) = 1,43 · 10 -3 м³/с
D = 4 · 1,43 · 10 -3 /(3,14 · 0,01) = 0,43 м
Примем D = 0,5 м, действительная скорость газа в колонне составит:
ωг =4Vг/πD 2 = 4 · 1,43 · 10 -3 /(3,14 · 0,5 2 ) = 0,007 м/с
Плотность этилена при рабочих условиях:
ρ C2H4 = ρ C2H4,0 T0Pр/TрР0 = 1,26 · (298/383) · (1,0/0,1) = 9,80 кг/м 3
Объёмное газосодержание системы
φг = 0,4(ρг/ ρж) 0,15 [ωг Δρ/σg ] 0,68 =
0,4 · (9,8/ 1281,6) 0,15 [0,007 · 1272,8/58,6 · 10 -3 · 9,8] 0,68 = 0,024
Высота газожидкостной смеси:
Hсм = (Vж – Vдн)4/[ πD 2 a(1 – φг)]
где Vж – объём жидкости в колонне
Vдн – объём днища
a – коэффициент, учитывающий заполнение колонны
Hсм = (1 – 0,1) · 4/[ 3,14 · 0,5 2 · 0,9(1 – 0,024)] = 5,2 м
Общая высота колонны:
Hк = Hсм + hц + Hсеп + 2hдн = 5,2 + 0,1 + 0,5 + 2 · 0,3 = 6,4 м
где hц – расстояние от барботёра до днища колонны,
Hсеп – высота сепарационной части колонны,
Hдн – высота крышки днища.
5.3 Определение тепловой нагрузки на реактор
Примем температуру реакции Tк =110°С, а температуру исходных веществ Tн = 30°С.
Для расчёта теплоёмкостей веществ при температуре реакции и начальной температуре веществ-участников реакции воспользуемся уравнениями вида сp=a + bT + cT² + c’ T‾². Согласно справочным данным [19] соответствующие коэффициенты в уравнении для веществ будут равны:
| Вещество | a | b·10³ | c·10 . | c´·10 — 5 . |
| С2Н4 | 11,32 | 122,01 | –37,9 | – |
| O2 | 31,46 | 3,39 | – | –3,77 |
| СН3СНО | 13,00 | 153,5 | –53,7 | – |
| СН3СООН | 14,82 | 196,7 | –77,7 | – |
| СО2 | 44,14 | 9,04 | – | –8,54 |
| Н2О | 3,00 | 10,71 | – | 0,33 |
| N2 | 27,88 | 4,27 | – | – |
Рассчитаем теплоёмкости исходных веществ и продуктов реакции при заданных температурах:
cp ( C2H4)=11,32 + 122,01·10 -3 ·303 – 37,9·10 — ·303 2 =44,81 кДж/кмоль
cp 8 ( C2H4)=11,32 + 122,01·10 -3 ·383 – 37,9·10 — ·383 2 =52,49 кДж/кмоль
cp ( О2)=31,46 + 3,39·10 -3 ·303 – 3,77·10 5 ·303 -2 =28,38 кДж/кмоль
cp 8 ( О2)=31,46 + 3,39·10 -3 ·383 – 3,77·10 5 ·383 -2 =24,04 кДж/кмоль
cp 8 ( CH3СНО)=13,00 + 153,5·10 -3 ·383 – 53,7·10 — ·383 2 =80,46 кДж/кмоль
cp 8 ( CH3СООН)=14,82 + 196,7·10 -3 ·383 – 77,7·10 — ·383 2 =78,76 кДж/кмоль
cp 8 ( СО2)=44,14 + 9,04·10 -3 ·383 – 8,54·10 5 ·383 -2 =41,78 кДж/кмоль
cp 8 ( Н2О)=30,00 + 10,71·10 -3 ·383 + 0,33·10 5 ·383 -2 =34,36 кДж/кмоль
cp 0 ( N2)=27,88 + 4,27·10 -3 ·303 =29,17 кДж/кмоль
cp 8 ( N2)=27,88 + 4,27·10 -3 ·383 =29,51 кДж/кмоль
1. Тепло, приходящее с исходными веществами:
Qисх. в-в = ΣGni · cpi · Tн = G C2H4· cp ( C2H4) · Tн + G О2· cp ( О2) · Tн + G N2 · cp 0 ( N2) · Tн =
=1,786 ·44,81· 303 + 3,376· 28,38· 303 + 12,698· 29,17· 303 = 165511,4 кДж/час
2. Тепло химических реакций:
Qр= Q обр кон – Q обр исх
Теплота образования конечных веществ:
Q обр кон = Σ(–ΔН°j) · Gnj
Q обр C2H4 = –52,3 · 0,143 · 10 = –7478,9 кДж/час
Q обр CH3СНО = 166,00 · (1,316 + 0,163) · 10 = 245 514 кДж/час
Q обр CH3СООН = 434,84 · 0,049 · 10 = 21307,2 кДж/час
Q обр СО2 = 393,51 · 0,23 · 10 = 90507,3 кДж/час
Q обр Н2О = 241,81 · 0,23 · 10 = 55616,3 кДж/час
Теплота образования исходных веществ:
Q обр кон = Σ(–ΔН°i) · Gni
Q обр C2H4 = –52,3 · 1,786 · 10 = –93407,8 кДж/час
Qр=495465,9 – (– 93407,8 ) =498873,3 кДж/час
3. Тепло фазовых переходов.
В условиях реакции фазовых переходов продуктов реакции и реагентов не происходит.
4. Итого, приход тепла:
Qприх = Qисх. в-в + Qр = 165511,4 + 498873,7 = 664385,1 кДж/час
1. Тепло, уносимое из реактора продуктами реакции и непрореагировавшими веществами:
Qпрод= ΣGnj· cpj · Tк = GC2H4· cp 8 ( C2H4) · Tк + G О2 · cp 8 (О2) · Tк + GN2 · cp 8 ( N2) · Tк + G СО2 · cp 8 ( СО2) · Tк + G Н2О · cp 8 (Н2О) · Tк = (0,143·52,49 + 2,243·24,04+ 12,698·29,51 + 0,23·41,78 + 0,23·34,36)·383 = 173751,0 кДж/час
2. Тепло, затрачиваемое на подогрев исходных реагентов:
Qнагр = ΣGni· cpi · (Tк – Tн) = [GC2H4· cp (C2H4) + GN2 · cp 0 (N2) + G О2· cp ( О2)]· (Tк – Tн) = (1,786·44,81 + 12,698·29,17 + 3,376·28,38) · (383 – 303) = 43699,4 кДж/час
Δ Q= 0,04·Qприх = 0,04·664385,1 = 26575,4 кДж/час
4. Тепловая нагрузка:
QF = Qприх – Qпрод – Qнагр – Δ Q = = 664385,1– 173751,0 – 43699,4 – 26575,4 = 420 359,3 кДж/час
Таблица теплового баланса:
| Приход тепла | кДж/час | % | Расход тепла, кДж/моль | кДж/час | % |
| Тепло, приходящее с исходными веществами Qисх.в-в | 165511,4 | 24,9 | Тепло, уносимое из реактора продуктами реакции Qпрод | 173751,0 | 26,1 |
| Тепло химических реакций Qр | 498873,7 | 75,1 | Тепло, затрачиваемое на подогрев исходных реагентов Qнагр | 43699,4 | 6,6 |
| Тепло фазовых переходов | – | – | потери Δ Q | 26575,4 | 4,0 |
| Тепловая нагрузка QF | 420 359,3 | 63,3 | |||
| Итого | 664385,1 | 100 | Итого | 664385,1 | 100 |
Примем разность температур реакционной массы и теплоносителя равной Δtср = 50 К, коэффициент теплопередачи k = 150 вт/м 2 ·К , тогда площадь поверхности реактора составит
F = QF/(k· Δtср) = (420 359,3 · 1000)/(150 · 50 · 3600) = 15,57 м 2
1. Соколов Р.С. Химическая технология в 2-х т.: Учебное пособие для вузов Т.2:Металлургические процессы. Переработкам химического топлива. Производство органических веществ и полимерных материалов. — М. «Владос», 2000 — 447 с.
2. Химическая энциклопедия: в 5 т., Т.1 под ред. Кнукянц И.Л., М: Советская энциклопедия, 1988 — 623 с.
3. Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза: Учеб. Пособие для вузов — 2-е изд., перераб. — М.: Высш. шк., 2003. — 536 с.
4. Лебедев Н.Н. Химия и технология основного органического синтеза. — М. Химия, 1988, 582 с.
5. Юкельсон И.И. Технология основного органического синтеза. — М. Химия, 1968 — 848 с.
6. Паушкин Я.Н., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза. В 2-х ч. Ч.1 Углеводородное сырьё и продукты его окисления. — М.: «Химия», 1973 — 352 с
7. Реферативный журнал «Химия», 1999 №9 Патент 5679870 США МПК 6 С07С45/00 TustinGeraldCharles, DepewLeslieSharon; EastmanChemicalCo. — № 619385; Заявл 21.3.96.; Опубл. 21.10.97; НПК 568/489
8. Реферативный журнал «Химия», 2000 №13 Патент 23981 Украина МПК 6 С07С47/06 Осiйський Едуард Йосипович, Гомонал Василь Iванович: Ужгород, держ. цн-т – № 961124485. Заявл. от 02.12.1996. Опубл. 31.08.1998 Бюл. №20
9. Реферативный журнал «Химия», 2003 №24. Превращение этиленгликоля до ацетальдегида – дегидратация или согласованный механизм. Ethyleneglycol to acetaldehyde – dehydration or a concered mechanism. Smith William B. (Department of Chemistry, Texas) Texas Christian University, Fort Worth, TX, 76129 USA Tetrahedron, 2002, 58 №11, с. 2091-2094
10.Реферативный журнал «Химия», 2003 №19 Селективное гидрирование уксусной кислоты в ацетальдегид на нанесённых на SBA-15 оксидах железа. Zhang Xue-Zheng, Yue Ying-Hong, Gao Zi Gaodeng xuexiao huahxun xuebao= Chem J. Chin. Univ. 2003 24, № 1, с 121-124
11.Реферативныйжурнал «Химия», 1998 №7 Влияниеконцентрациикислороданавыходацетальдегидаприокисленииэтанолавприсутствииоксидовкальцияиалюминия. Oxidation of concentration on acetaldehyde yield/Karafyllis J. Phillipponlos C. Grigoroponlon H.//Chem and Biochem – Eng., Quart – 1997 – 11, №3 – с. 121-125
12.Реферативныйжурнал «Химия», 2002 №2 Different mechanism for the formation of acetaldehyde and ethanol on the Rh-based catalysts. Wang Xi, Luo Hongyuan, Liang Dongbai, Bao Xinhe J Catal, 2000. 190 №1 с.46-55
13.Реферативный журнал «Химия», 2002 №6 Оптимизация процесса производства ацетальдегида. Wu Xuan-chun Nanjing huegong daxue xuebao= J. Nanjing Univ. Chem Technol. 2001 23, №4, с. 47-49
14.О. К. Бабакова, Ю.А. Писаренко, В.С. Тимофеев, А.С. Шувалов Разработка узла гидролиза производства ацетальдегида косвенной гидратацией ацетилена. 2002 Химическая промышленность с. 16-20
15.Краткий справочник по химии под ред. А. Т. Пилипенко, Киев: «Наукова думка», 1987
16.Петров А.А. , Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для ВУЗов.//Под ред. Стадничука М.Д. — 5-е изд., перераб. и доп. — СПб.: «Иван Фёдоров», 2002. — 624 с., ил.
17.Ахметов Н.С. Неорганическая химия. Учебное пособие для вузов. М., «Высшая школа», 1975
18.Физер Л., Физер М.Органическая химия. Углубленный курс. В 2-х т., Т.1/ Пер с англ. Под ред. Вульфсона — М. «Химия», 1966. — 680 с.
19.Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономарёвой А. М., — Спб.: «Иван Федоров», 1999
20.Попов Ю.В., Но Б.И. Инженерная химия: Учебное пособие / Волгоградский Государственный Технический Университет, Волгоград, 2003.
21.Хенреце-Оливе Г., Оливе С. Координация и катализ. М., «Мир», 1980
22.Краткий справочник физико-химических величин под ред. К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. – 200 стр.
23.Машины и аппараты химических производств: Примеры и задачи. Учеб. пособие для студентов втузов, обучающихся по специальности «Машины и аппараты химических производств» под ред. В.Н. Соколова – Л.: Машиностроение ,1982.
🔍 Видео
КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Уравнивание реакций горения углеводородовСкачать

Получение и изучение свойств этилена. Опыт 2Скачать

Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Практическая работа.Получение и свойства уксусной кислоты.Скачать

Опыты по химии. Окисление спирта в альдегидСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Взаимодействие уксусной кислоты с карбонатом натрияСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение уксусной кислоты (реакция ацетата натрия и серной кислоты)Скачать

7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Задача на разбавление уксусного ангидрида уксусной кислотой. Органика. Олимпиада.Скачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Получение этилена и изучение его свойств. | Практическая работа № 1.Скачать

Взаимодействие уксусной кислоты с оксидом медиСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать



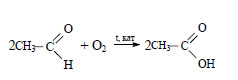

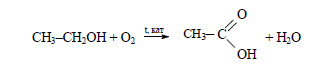

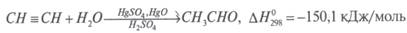
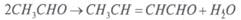
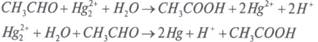
 Fe 2+ + Hg 2+
Fe 2+ + Hg 2+