Среди элементов IIIa группы один лишь бор относится к неметаллам. Представляет собой аморфное кристаллическое вещество красного или темного цвета, может быть бесцветным.
- Структура оксида бора (B2O3), свойства, номенклатура и применение
- Структура оксида бора
- Блок БО3
- Кристаллическая структура
- Стекловидное строение
- свойства
- Внешний вид
- Молекулярная масса
- аромат
- плотность
- Точка плавления
- Точка кипения
- стабильность
- номенклатура
- приложений
- Синтез тригалогенидов бора
- инсектицид
- Растворитель оксидов металлов: образование стекол, керамики и сплавов бора
- связующее вещество
- Оксид бора (B2O3): структура, свойства и применение
- Содержание:
- Структура оксида бора
- Блок BO3
- Кристальная структура
- Стекловидная структура
- Свойства
- Внешность
- Молекулярная масса
- Вкус
- Плотность
- Температура плавления
- Точка кипения
- Стабильность
- Номенклатура
- Приложения
- Синтез тригалогенидов бора
- Инсектицид
- Растворитель для оксидов металлов: образование стекол, керамики и сплавов бора
- Связующее
- Ссылки
Общая характеристика элементов IIIa группы
От B к Tl (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Оксид бора проявляется кислотные свойства, алюминий и галлий — типичные амфотерные элементы, у соединений индий и таллия преобладают основные свойства.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 1 :
- B — 2s 2 2p 1
- Al — 3s 2 3p 1
- Ga — 4s 2 4p 1
- In — 5s 2 5p 1
- Tl — 6s 2 6p 1
Природные соединения
Получение
Бор получают путем пиролиза бороводородов, методом металлотермии (вытеснением активным металлом) и термическим разложением бромида бора в присутствии катализатора
BBr3 + H2 → (вольфрам, t = 1000-1200 С°) B + HBr
Химические свойства
- Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При комнатной температуре без нагревания он реагирует только со фтором:
Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом, фосфором, углеродом и кислородом.
При сильном нагревании бор способен восстановить кремний из его оксида:
Ионы бора окрашивают пламя в оттенки зеленого цвета.
Оксид и гидроксид бора
Оксид и гидроксид бора (борная кислота) проявляют кислотные свойства.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Структура оксида бора (B2O3), свойства, номенклатура и применение
оксид бора или борный ангидрид представляет собой неорганическое соединение, химическая формула которого B2О3. Так как бор и кислород элементов р-блока периодической таблицы и даже больше головок их соответствующих групп, разница электроотрицательности между ними не очень велика; следовательно, следует ожидать, что B2О3 быть ковалентным в природе.
Б2О3 его готовят растворением буры в концентрированной серной кислоте в плавильной печи и при температуре 750 ° С; термически дегидратирующая борная кислота, B (OH)3, при температуре около 300 ° С; или он также может быть образован как продукт диборановой реакции (В2H6) с кислородом.
Оксид бора может иметь полупрозрачный стеклянный или кристаллический вид; Последний может быть получен путем измельчения в виде порошка (верхнее изображение).
Хотя это может показаться не на первый взгляд, это считается B2О3 как один из самых сложных неорганических оксидов; не только со структурной точки зрения, но и благодаря переменным свойствам, которые приобретают стекла и керамика, к которым они добавляются в свою матрицу.
- 1 Структура оксида бора
- 1.1 Блок BO3
- 1.2 Кристаллическая структура
- 1.3 Стекловидное строение
- 2 свойства
- 2.1 Внешний вид
- 2.2 Молекулярная масса
- 2.3 Вкус
- 2.4 Плотность
- 2.5 Точка плавления
- 2.6 Точка кипения
- 2.7 Стабильность
- 3 Номенклатура
- 4 использования
- 4.1 Синтез тригалогенидов бора
- 4.2 Инсектицид
- 4.3 Растворитель оксидов металлов: образование стекол, керамики и сплавов бора
- 4.4 Binder
- 5 ссылок
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Структура оксида бора
Блок БО3
Б2О3 является ковалентным телом, поэтому теоретически в его структуре нет ионов B 3+ ни о 2- , но B-O ссылки. Бор, согласно теории валентных связей (VTE), может образовывать только три ковалентные связи; в этом случае три B-O ссылки. Как следствие этого, ожидаемая геометрия должна быть тригональной, BO3.
Молекула БО3 дефицит электронов, особенно атомов кислорода; однако некоторые из них могут взаимодействовать друг с другом для восполнения указанного недостатка. Итак, треугольники BO3 они объединяются, разделяя кислородный мостик, и распределяются в пространстве в виде треугольных рядовых сетей, плоскости которых ориентированы по-разному.
Кристаллическая структура
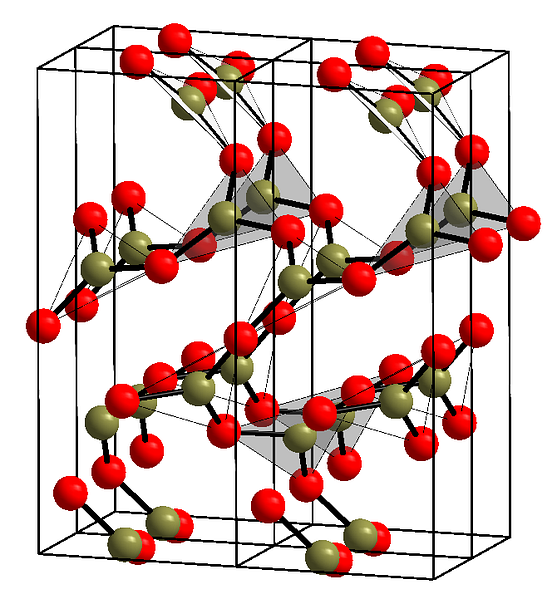
Верхнее изображение показывает пример упомянутых рядов с треугольными единицами BO3. Если вы внимательно посмотрите, не все грани плоскостей указывают на читателя, но на другую сторону. Ориентация этих граней может быть ответственна за то, как определяется B2О3 при определенной температуре и давлении.
Когда эти сети имеют дальний структурный рисунок, это кристаллическое твердое тело, которое может быть построено из его элементарной ячейки. Это где B, как говорят,2О3 Он имеет два кристаллических полиморфа: α и β.
Α-B2О3 происходит при атмосферном давлении (1 атм) и считается кинетически нестабильным; на самом деле, это одна из причин, по которой оксид бора, вероятно, представляет собой соединение сложной кристаллизации..
Другой полиморф, β-B2О3, его получают при высоких давлениях в диапазоне ГПа; следовательно, его плотность должна быть больше плотности α-B2О3.
Стекловидное строение
Сети БО3 естественно, они имеют тенденцию принимать аморфные структуры; это отсутствие модели, которая описывает молекулы или ионы в твердом теле. Синтезируя B2О3 его преобладающая форма является аморфной, а не кристаллической; правильными словами: это твердое вещество более стекловидное, чем кристаллическое.
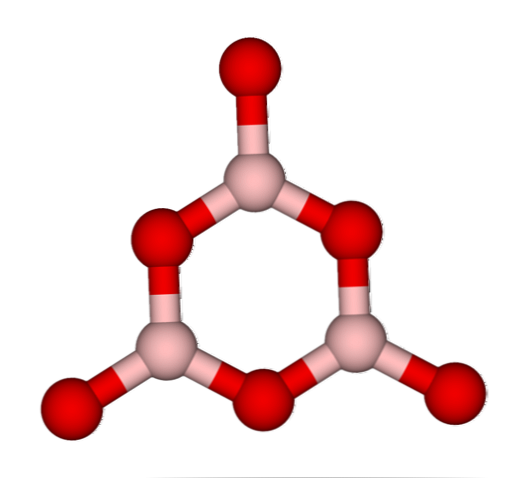
Тогда говорят, что B2О3 это стекловидное или аморфное, когда его сети BO3 Они грязные. Не только это, но и они меняют способ, которым они собираются вместе. Вместо того, чтобы располагаться в треугольной геометрии, они заканчивают тем, что были связаны, чтобы создать то, что исследователи называют бороксольным кольцом (верхнее изображение).
Обратите внимание на очевидную разницу между треугольными и шестиугольными единицами. Треугольные характеризуют B2О3 кристаллический и шестиугольный B2О3 стекловидное тело. Другим способом обозначить эту аморфную фазу является борное стекло или по формуле: g-B2О3 («g» происходит от слова «гладкий» на английском языке).
Таким образом, сети G-B2О3 они состоят из бороксольных колец, а не единиц БО3. Тем не менее, G-B2О3 может кристаллизоваться в α-B2О3, что подразумевает взаимопревращение колец в треугольники, а также определяет степень достигнутой кристаллизации.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

свойства
Внешний вид
Это бесцветное и стеклообразное твердое вещество. В своей кристаллической форме он белый.
Молекулярная масса
аромат
плотность
-Кристаллический: 2,46 г / мл.
-Стекловидное тело: 1,80 г / мл.
Точка плавления
Он не имеет полностью определенной точки плавления, поскольку зависит от того, насколько он кристаллический или стекловидный. Чисто кристаллическая форма плавится при 450 ° С; однако стеклообразная форма плавится при температуре от 300 до 700ºC.
Точка кипения
Опять же, сообщенные значения не соответствуют этому значению. По-видимому, жидкий оксид бора (расплавленный из его кристаллов или стекла) кипит при 1860ºC.
стабильность
Он должен быть сухим, так как он поглощает влагу и превращается в борную кислоту, B (OH)3.
Видео:8 класс. Составление уравнений химических реакций.Скачать

номенклатура
Оксид бора можно назвать другими способами, такими как:
-Diboro триоксид (систематическая номенклатура).
-Оксид бора (III) (номенклатура сырья).
-Оксид бора (традиционная номенклатура).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

приложений
Некоторые из применений оксида бора:
Синтез тригалогенидов бора
Из Б2О3 могут быть синтезированы тригалогениды бора, BX3 (Х = F, Cl и Br). Эти соединения представляют собой кислоты Льюиса, и с их помощью можно вводить атомы бора в определенные молекулы, чтобы получить другие производные с новыми свойствами..
инсектицид
Твердая смесь с борной кислотой, B2О3-Б (ОН)3, представляет собой формулу, которая используется в качестве бытового инсектицида.
Растворитель оксидов металлов: образование стекол, керамики и сплавов бора
Жидкий оксид бора способен растворять оксиды металлов. Из этой полученной смеси после охлаждения получают твердые вещества из бора и металлов..
В зависимости от количества Б2О3 Используемый, а также метод и тип оксида металла, вы можете получить богатое разнообразие стекол (боросиликатов), керамики (нитридов и карбидов бора) и сплавов (если используются только металлы).
В целом, стекло или керамика приобретают большую прочность и прочность, а также большую долговечность. В случае очков, они в конечном итоге используются для оптических линз и телескопов, а также для электронных устройств.
связующее вещество
При строительстве сталеплавильных печей используются огнеупорные кирпичи на магниевой основе. В них оксид бора используется в качестве связующего вещества, помогая держать их крепко связанными.
Видео:Оксиды. Получение оксидов. Урок 9. Химия 8 классСкачать

Оксид бора (B2O3): структура, свойства и применение
Оксид бора (B2O3): структура, свойства и применение — Наука
Видео:Разложение Борной Кислоты. Получение Оксида Бора. Разложение H3BO3.Скачать

Содержание:
В оксид бора или борный ангидрид представляет собой неорганическое соединение, химическая формула которого B2ИЛИ3. Поскольку бор и кислород являются элементами блока p периодической таблицы, и даже больше глав их соответствующих групп, разница в электроотрицательности между ними не очень велика; следовательно, следует ожидать, что B2ИЛИ3 ковалентен по своей природе.
B2ИЛИ3 Его получают растворением буры в концентрированной серной кислоте в плавильной печи при температуре 750ºC; термически дегидратирующая борная кислота, B (OH)3при температуре около 300 ° C; или он также может быть образован как продукт реакции диборана (B2ЧАС6) с кислородом.
Оксид бора может иметь полупрозрачный стекловидный или кристаллический вид; последний путем измельчения может быть получен в виде порошка (верхнее изображение).
Хотя на первый взгляд это может показаться не так, но считается,2ИЛИ3 как один из самых сложных неорганических оксидов; не только со структурной точки зрения, но также из-за переменных свойств, приобретаемых стеклами и керамикой, к которым они добавляются в их матрицу.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Структура оксида бора
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Блок BO3
B2ИЛИ3 является ковалентным твердым телом, поэтому теоретически в его структуре нет ионов B 3+ ни O 2- , но Б-О ссылки. Бор, согласно теории валентных связей (TEV), может образовывать только три ковалентные связи; в данном случае — три связи BO. Как следствие этого, ожидаемая геометрия должна быть тригональной, BO3.
Молекула BO3 в нем электронодефицит, особенно атомы кислорода; Однако некоторые из них могут взаимодействовать друг с другом для восполнения указанного недостатка. Таким образом, треугольники BO3 они соединяются, разделяя кислородный мостик, и они распределены в пространстве в виде сетей треугольных рядов, плоскости которых ориентированы по-разному.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Кристальная структура
Пример таких рядов с треугольными блоками БО показан на изображении выше.3. Если приглядеться, не все грани планов указывают на читателя, а наоборот. Ориентация этих граней может быть ответственной за то, как определяется B2ИЛИ3 при определенной температуре и давлении.
Когда эти сети имеют структурный образец дальнего действия, это кристаллическое твердое тело, которое может быть построено из его элементарной ячейки. Здесь говорится, что B2ИЛИ3 Он имеет два кристаллических полиморфа: α и β.
Α-B2ИЛИ3 это происходит при атмосферном давлении (1 атм) и считается кинетически нестабильным; Фактически, это одна из причин того, что оксид бора, вероятно, является трудно кристаллизующимся соединением.
Другой полиморф, β-B2ИЛИ3, получается при высоких давлениях в диапазоне ГПа; следовательно, его плотность должна быть больше, чем у α-B2ИЛИ3.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Стекловидная структура
BO сети3 они естественно имеют тенденцию принимать аморфные структуры; В них отсутствует узор, описывающий молекулы или ионы в твердом теле. При синтезе B2ИЛИ3 его преобладающая форма — аморфная, а не кристаллическая; правильными словами: это твердое вещество более стеклянное, чем кристаллическое.
Тогда говорят, что B2ИЛИ3 он стекловидный или аморфный, когда его БО сети3 они беспорядочные. Не только это, но они также меняют то, как они собираются вместе. Вместо того, чтобы располагаться в тригональной геометрии, они в конечном итоге соединяются вместе, чтобы создать то, что исследователи называют бороксольным кольцом (верхнее изображение).
Обратите внимание на очевидную разницу между треугольными и шестиугольными элементами. Треугольные характерны для B2ИЛИ3 кристаллический и гексагональный до B2ИЛИ3 стекловидное тело. Другой способ обозначить эту аморфную фазу — борсодержащее стекло или формулой: g-B2ИЛИ3 («g» происходит от английского слова glassy).
Таким образом, сети g-B2ИЛИ3 состоят из бороксольных колец, а не из звеньев БО3. Однако g-B2ИЛИ3 может кристаллизоваться до α-B2ИЛИ3, что означало бы взаимное преобразование колец в треугольники, а также определило бы степень достигнутой кристаллизации.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Свойства
Видео:Бор - B. Получение Бора. Реакция Лития и Тетрабората Натрия. Реакция Na2B4O7 и Li.Скачать

Внешность
Это бесцветное стеклообразное твердое вещество. В кристаллической форме он белый.
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Молекулярная масса
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Вкус
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Плотность
-Кристаллический: 2,46 г / мл.
-Vitreous: 1,80 г / мл.
Видео:Получение ТРИФТОРИДА БОРА. Реакция Фторида Натрия, Тетрабората Натрия и Серной Кислоты.Скачать

Температура плавления
У него нет полностью определенной точки плавления, потому что это зависит от того, насколько он кристаллический или стекловидный. Чисто кристаллическая форма плавится при 450 ° C; однако стеклообразная форма плавится в диапазоне температур от 300 до 700ºC.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Точка кипения
Опять же, указанные значения не совпадают с этим значением. Судя по всему, жидкий оксид бора (расплавленный из его кристаллов или стекла) кипит при 1860ºC.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Стабильность
Он должен быть сухим, так как он впитывает влагу и превращается в борную кислоту B (OH).3.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Номенклатура
Оксид бора можно назвать по-другому, например:
-Диборон триоксид (систематическая номенклатура).
-Оксид бора (III) (стоковая номенклатура).
-Оксид бора (традиционная номенклатура).
Приложения
Некоторые из применений оксида бора:
Синтез тригалогенидов бора
От B2ИЛИ3 могут быть синтезированы тригалогениды бора, BX3 (X = F, Cl и Br). Эти соединения являются кислотами Льюиса, и с их помощью можно ввести атомы бора в определенные молекулы, чтобы получить другие производные с новыми свойствами.
Инсектицид
Твердая смесь с борной кислотой, B2ИЛИ3-B (ОН)3, представляет собой формулу, которая используется в качестве домашнего инсектицида.
Растворитель для оксидов металлов: образование стекол, керамики и сплавов бора
Жидкий оксид бора способен растворять оксиды металлов. Из полученной смеси после охлаждения получают твердые частицы, состоящие из бора и металлов.
В зависимости от количества B2ИЛИ3 Используемый, а также метод и тип оксида металла, можно получить большое разнообразие стекол (боросиликатов), керамики (нитриды и карбиды бора) и сплавов (если используются только металлы).
Как правило, стекло или керамика приобретают большую прочность и прочность, а также большую долговечность. Что касается очков, они в конечном итоге используются для оптических линз и линз телескопов, а также для электронных устройств.
Связующее
При строительстве сталеплавильных печей используется огнеупорный кирпич на основе магния. Оксид бора используется в качестве связующего, помогая удерживать их вместе.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2019). Трехокись бора. Получено с: en.wikipedia.org
- PubChem. (2019). Оксид бора. Получено с: pubchem.ncbi.nlm.nih.gov
- Рио Тинто. (2019). Оксид борикса. 20 Mule Team Borax. Получено с: borax.com
- А. Муханов, О. О. Куракевич, В. Л. Соложенко. (н.д.). О твердости оксида бора (III). LPMTMCNRS, Université Paris Nord, Villetaneuse, Франция.
- Хансен Т. (2015). B2ИЛИ3 (Оксид бора). Получено с: digitalfire.com
Ganoderma lucidum: характеристики, среда обитания и польза
Синдром Поттера: симптомы, причины и лечение