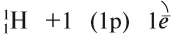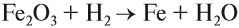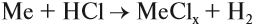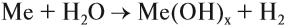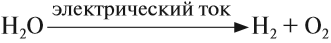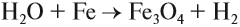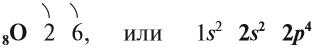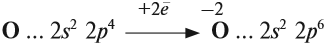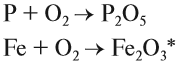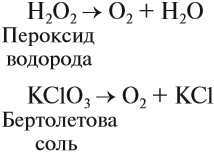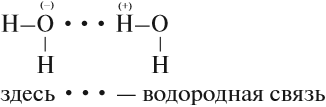Разделы: Химия
Класс: 8
Задачи урока:
- обобщить и систематизировать знания по теме
- закрепить и откорректировать умение составлять формулы веществ и химические уравнения
- повторить и закрепить понятие “валентность” и “степень окисления”, “окисление” и “восстановление”.
- закрепить знания по типам химических реакций
- развивать у школьников умение выделять главное, умения сравнивать и делать выводы
- формировать умение работать в коллективе
Формы организации учебной деятельности: коллективная, групповая, индивидуальная
Методы работы: самостоятельная и под руководством учителя.
Средства обучения: таблица ПСХЭ и ряд напряжений металлов.
Ход урока.
1 этап – организация начала урока.
Учитель говорит о плане работы на уроке, цели урока, формах работы и системе оценивания работы. Ученики подписывают индивидуальные рабочие листы, которые в конце урока сдают учителю. Каждой парте присваивается порядковый номер (это будет нужно на 3 этапе работы). Учитель просит положить на парты “шпаргалки” по этой теме (составление таких “шпаргалок” было задано на дом, и объявлен конкурс на лучшую “шпаргалку”. Лучшие работы этого конкурса могут быть оценены отдельно и затем представлены на стенде в кабинете.)
2 этап – активизация учебной деятельности.
Учитель проводит фронтальную беседу, в ходе которой ученики отвечают на вопросы:
- Каковы химические формулы изученных веществ — кислорода, водорода, воды?
- Какие валентности и степени окисления проявляют элементы в этих веществах?
- К каким веществам (простым или сложным) можно отнести изученные вещества?
- Какой тип связи реализуется в этих веществах?
- Какие физические свойства определяются типом химической связи в изученных веществах?
- Какие реакции характерны для кислорода?
- Что такое “окислитель” и “окисление”?
- Дайте определение оксидам.
- Какие реакции характерны для водорода?
- Что такое “восстановитель” и “восстановление”?
- Как изменяется степень окисления элементов при окислении и восстановлении?
- Какой класс веществ содержит в своем составе атомы водорода?
- Как кислоты реагируют с металлами? Как в лабораторной практике используется эта реакция?
- К какому классу веществ можно отнести воду?
- Как металлы реагируют с водой?
- Как проявляют себя металлы с точки зрения окислительно-восстановительных процессов в реакциях с водой и с кислотами?
Во время беседы с классом учитель раздает за правильные ответы синие карточки, за два не прозвучавших ответа желтую карточку. Когда ученик получает 5 синих карточек в течение одного или нескольких уроков, он получает “5”; когда две желтых – “2”.
В конце урока карточки сдаются учителю, и учитель учитывает их у себя в журнале.
Ответы учащихся учитель записывает на доске, а ученики – на индивидуальных листах.
Этот этап урока позволяет проверить выполнение домашнего задания (на дом было задано повторение пройденного материала по данной теме).
3 этап – парная работа. На этом этапе ученики могут пользоваться рабочими тетрадями, “шпаргалками” и получать консультации учителя.
Учащиеся работают на индивидуальных листах. Парты с четными номерами выполняют 1-ый вариант, с нечетными – 2-ой вариант заданий.
1 задание. Допишите уравнения реакций, поставьте коэффициенты, определите степень окисления элементов, укажите переход электронов, окислитель и восстановитель в реакциях, укажите тип реакции:
- 1 –ый вариант Сu + O2 = ? CuO + H2 = ?+?
- 2-ой вариант ? + O2 = Fe2O3 Fe2O3+ H2 = ?+?
2 задание. Допишите уравнения реакций получения водорода, расставьте коэффициенты, укажите тип реакции.
- 1 –ый вариант Fe + серная кислота? FeSO4 + ?
Fe + Н2О —> FeO + ? - 2-ой вариант Zn + соляная кислота ? ZnCl2 + ?
Zn + Н2О —> ZnO + ?
3 задание. Допишите уравнения химический реакций получения кислорода, укажите тип реакции
- 1 –ый вариант KMnO4 —> ? + K2MnO4 + O2
- 2-ой вариант KClO3 —> ? + O2
На этом этапе урока учитель может оказывать помощь слабым учащимся.
4 этап – контроль и самопроверка знаний, умений навыков проходит в игровой форме.
Класс делится на три команды по рядам рабочих мест: “Кислородики”, “Водородики” и “Паровозики”.
Команды получают задания.
“Кислородики” — написать известные им способы получения кислорода и реакции, отражающие химические свойства кислорода, указать тип каждой реакции.
“Водородики” — написать возможные способы получения и химические свойства водорода, указать тип каждой реакции.
“Паровозики” — написать возможные реакции, при которых образуется вода, и реакции, отражающие химические свойства воды, указать тип каждой реакции.
Учитывая мотивированность учащихся, учитель для более слабых классов может написать заранее на доске названия предлагаемых к написанию реакций (перечень реакций учитель может изменять в зависимости от объема изученного материала).
— для команды “Кислородиков”
способы получения кислорода
1. разложение перманганата калия
2. разложение хлората калия
3. разложение оксида ртути (II)
4. электролиз воды
5. разложение перекиси водорода
химические свойства кислорода
6. окисление простых веществ
7. горение сложных веществ
— для команды “Водородиков”
способы получения водорода
1. Взаимодействие активных металлов с водой
2. Взаимодействие металлов средней активности с водой при нагревании
3. Взаимодействие металлов средней активности с кислотами
4. электролиз воды
5. горение водорода
химические свойства водорода
6. восстановление металлов из их оксидов
7. реакции соединения водорода с неметаллами
— для команды “Паровозиков”
реакции, имеющие продуктом воду
1. горение водорода
2. восстановление металлов из их оксидов
3. разложение перекиси водорода
4. горение водородных соединений неметаллов
химические свойства воды
5. взаимодействие металлов средней активности с водой при нагревании
6. взаимодействие активных металлов с водой
7. электролиз воды
На этом этапе ученики не могут пользоваться дополнительной литературой.
Ученики каждой команды выходят по очереди к доске и пишут уравнения реакции или исправляют ошибки, допущенные ранее их товарищами по команде. Учащиеся, которые в данный момент работают на рабочем месте, а не у доски,записывают уравнения реакций по теме команды на свои индивидуальные листы, которые в конце урока сдают учителю.
После написания указанных реакций ученики разных команд проверяют друг друга и исправляют ошибки. Учитель подводит итоги выполнения задания, учитывая как правильность написания уравнений, так и быстроту выполнения задания. Команда-победитель получает “5”. Ученики, чаще других выходившие к доске, получают дополнительную оценку.
5 этап – подведение итогов урока и домашнее задание: проработать повторно материал, вызвавший затруднения на уроке, и решить задачу на определение массовой доли растворенного вещества в растворе.
Учитель может указать номера заданий в учебнике для домашней доработки. Например,
а) учебник Л.С.Гузея, Р.П.Суровцевой, В.В.Сорокина “Химия”, 8 класс
— стр.77, в.1-3 (кислород)
— стр.116, в.6,8,9 (водород)
-стр.145, в.1 (вода)
б) учебник Г.Е.Рудзитиса, Ф.Г. Фельдмана “Химия”, 8 класс
— глава II (кислород)
— глава III (водород)
— глава IV (вода)
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Урок 12. Водород и кислород
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Водород
Водород — самый распространённый химический элемент во Вселенной. Именно он составляет основу горючего вещества Звёзд.
Водород — первый химический элемент Периодической системы Менделеева. Его атом имеет простейшее строение: вокруг элементарной частицы «протон» (ядро атома) вращается один-единственный электрон:
Природный водород состоит из трех изотопов: протий 1 Н, дейтерий 2 Н и тритий 3 Н.
Задание 12.1. Укажите строение ядер атомов этих изотопов.
Имея на внешнем уровне один электрон, атом водорода может проявлять единственно возможную для него валентность I:
Вопрос. Образуется ли завершённый внешний уровень при приёме атомом водорода электронов?
Таким образом, атом водорода может и принимать, и отдавать один электрон, т. е. является типичным неметаллом. В любых соединениях атом водорода одновалентен.
Простое вещество «водород» Н2 — газ без цвета и запаха, очень лёгкий. Он плохо растворим в воде, но хорошо растворим во многих металлах. Так, один объём палладия Рd поглощает до 900 объёмов водорода.
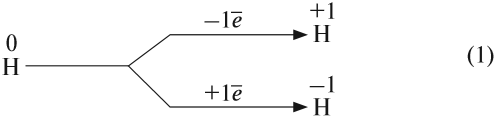
Схема (1) показывает, что водород может быть и окислителем, и восстановителем, реагируя с активными металлами и многими неметаллами:
Задание 12.2. Определите, в каких реакциях водород является окислителем, а в каких — восстановителем. Обратите внимание, что молекула водорода состоит из двух атомов.
Смесь водорода и кислорода является «гремучим газом», поскольку при поджигании её происходит сильнейший взрыв, который унёс многие жизни. Поэтому опыты, в которых выделяется водород, нужно выполнять подальше от огня.
Чаще всего водород проявляет восстановительные свойства, что используется при получении чистых металлов из их оксидов*:
* Аналогичные свойства проявляет алюминий (см. урок 10 — алюминотермия).
Разнообразные реакции происходят между водородом и органическими соединениями. Так, за счёт присоединения водорода (гидрирование) жидкие жиры превращаются в твёрдые (подробнее урок 25).
Водород можно получить разными способами:
- Взаимодействием металлов с кислотами:
Задание 12.3. Составьте уравнения таких реакций для алюминия, меди и цинка с соляной кислотой. В каких случаях реакция не идет? Почему? В случае затруднения см. уроки 2.2 и 8.3;
- Взаимодействие активных металлов с водой:
Задание 12.4. Составьте уравнения таких реакций для натрия, бария, алюминия, железа, свинца. В каких случаях реакция не идёт? Почему? В случае затруднений см. урок 8.3.
В промышленных масштабах водород получают электролизом воды:
а также при пропускании паров воды через раскалённые железные опилки:
Водород — самый распространённый элемент Вселенной. Он составляет бОльшую часть массы звёзд и участвует в термоядерном синтезе — источнике энергии, которую эти звёзды излучают.
Видео:Водород и кислород. 1 часть. 8 класс.Скачать

Кислород
Кислород — самый распространённый химический элемент нашей планеты: более половины атомов Земной коры приходится на кислород. Вещество кислород О2 составляет около 1/5 нашей атмосферы, а химический элемент кислород — 8/9 гидросферы (Мирового океана).
В Периодической системе Менделеева кислород имеет порядковый номер 8 и находится в VI группе второго периода. Поэтому строение атома кислорода следующее:
Имея на внешнем уровне 6 электронов, кислород является типичным неметаллом, т. е. присоединяет два электрона до завершения внешнего уровня:
Поэтому кислород в своих соединениях проявляет валентность II и степень окисления –2 (за исключением пероксидов).
Принимая электроны, атом кислорода проявляет свойства окислителя. Это свойство кислорода исключительно важно: процессы окисления происходят при дыхании, обмене веществ; процессы окисления происходят при горении простых и сложных веществ.
Горение — окисление простых и сложных веществ, которое сопровождается выделением света и теплоты. В атмосфере кислорода горят или окисляются почти все металлы и неметаллы. При этом образуются оксиды:
При горении в кислороде сложных веществ образуются оксиды химических элементов, входящих в состав исходного вещества. Только азот и галогены выделяются в виде простых веществ:
Вторая из этих реакций используется как источник тепла и энергии в быту и промышленности, так как метан CH4 входит в состав природного газа.
Кислород позволяет интенсифицировать многие промышленные и биологические процессы. В больших количествах кислород получают из воздуха, а также электролизом воды (как и водород). В небольших количествах его можно получить разложением сложных веществ:
Задание 12.5. Расставьте коэффициенты в приведенных здесь уравнениях реакций.
Воду нельзя ничем заменить — этим она отличается практически от всех других веществ, которые встречаются на нашей планете. Воду может заменить только сама вода. Без воды нет жизни: ведь жизнь на Земле возникла тогда, когда на ней появилась вода. Жизнь зародилась в воде, поскольку она является естественным универсальным растворителем. Она растворяет, а значит, измельчает все необходимые питательные вещества и обеспечивает ими клетки живых организмов. А в результате измельчения резко возрастает скорость химических и биохимических реакций. Более того, без предварительного растворения невозможно протекание 99,5 % (199 из каждых 200) реакций! (См. также урок 5.1.)
Известно, что взрослый человек в сутки должен получать 2,5–3 л воды, столько же выводится из организма: т. е. в организме человека существует водный баланс. Если он нарушается, человек может просто погибнуть. Например, потеря человеком всего 1–2 % воды вызывает жажду, а 5 % — повышает температуру тела вследствие нарушения терморегуляции: возникает сердцебиение, возникают галлюцинации. При потере 10 % и более воды в организме возникают такие изменения, которые уже могут быть необратимы. Человек погибнет от обезвоживания.
Вода — уникальное вещество. Её температура кипения должна составлять –80 °C (!), однако равна +100 °C. Почему? Потому что между полярными молекулами воды образуются водородные связи:
Поэтому и лёд, и снег — рыхлые, занимают больший объём, чем жидкая вода. В результате лёд поднимается на поверхность воды и предохраняет обитателей водоёмов от вымерзания. Свежевыпавший снег содержит много воздуха и является прекрасным теплоизолятором. Если снег покрыл землю толстым слоем, то и животные и растения спасены от самых суровых морозов.
Кроме того, вода имеет высокую теплоёмкость и является своеобразным аккумулятором тепла. Поэтому на побережьях морей и океанов климат мягкий, а хорошо политые растения меньше страдают от заморозков, чем сухие.
Без воды в принципе невозможен гидролиз, химическая реакция, которая обязательно сопровождает усвоение белков, жиров и углеводов, которые являются обязательными компонентами нашей пищи. В результате гидролиза эти сложные органические вещества распадаются до низкомолекулярных веществ, которые, собственно, и усваиваются живым организмом (подробнее см. уроки 25–27). Процессы гидролиза были нами рассмотрены в уроке 6. Вода реагирует со многими металлами и неметаллами, оксидами, солями.
Задание 12.6. Составьте уравнения реакций:
- натрий + вода →
- хлор + вода →
- оксид кальция + вода →
- оксид серы (IV) + вода →
- хлорид цинка + вода →
- силикат натрия + вода →
Изменяется ли при этом реакция среды (рН)?
Вода является продуктом многих реакций. Например, в реакции нейтрализации и во многих ОВР обязательно образуется вода.
Задание 12.7. Составьте уравнения таких реакций.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Выводы
Водород — самый распространённый химический элемент во Вселенной, а кислород — самый распространённый химический элемент на Земле. Эти вещества проявляют противоположные свойства: водород — восстановитель, а кислород — окислитель. Поэтому они легко реагируют друг с другом, образуя самое удивительное и самое распространённое на Земле вещество — воду.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

«Кислород. Водород. Вода» урок химии в 8 классе
презентация к уроку по химии (8 класс)
ТЕМА УРОКА Повторение и обобщение знаний по темам «Кислород», «Водород», «Вода. Растворы»
Видео:Водород. 8 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| urok_kislorod-vodorod.pptx | 978.18 КБ |
Предварительный просмотр:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Подписи к слайдам:
Обобщающий урок по темам «Кислород. Водород. Вода» Урок химии 8 класс Учитель: Волохова И.В. в ысшая квалификационная категория
Лаборатория теоретиков Оксиды Тепловой эффект химической реакции Экзотермическая реакция Термохимическое уравнение Эндотермическая реакция Катализатор Термохимическое уравнение Горение
Группа I газа Н 2 Группа II газа О 2 Химический знак Ar ( )= Валентность Распространение в природе … Формула простого вещества М r ( )= г/моль Кем открыт Характеристика химического элемента
Нахождение в природе
Карл Шееле Джозеф Пристли Антуан Лавуазье
Открытие кислорода Карл Шееле Джозеф Пристли Антуан Лавуазье
Генри Кавендиш Антуан Лавуазье М.В. Ломоносов
Открытие водорода Генри Кавендиш Антуан Лавуазье М.В. Ломоносов
Лаборатория раскрытия тайн
Физические свойства 1 Газ без цвета, без запаха 2 В 14,5 раза легче воздуха 6 Растворимость в воде очень мала 3 Относительно мало растворим в воде 5 Немного тяжелее воздуха 4 Сжижается при температуре -253°С 7 Сжижается при температуре — 183°С Н 2 О 2 8 Этот газ хорошо поддерживает горение . 9. Самый распространённый элемент космоса. 10. Входит в состав оксидов.
Физические свойства 1 Газ без цвета, без запаха 2 В 14,5 раза легче воздуха 6 Растворимость в воде очень мала 3 Относительно мало растворим в воде 5 Немного тяжелее воздуха 4 Сжижается при температуре -253°С 7 Сжижается при температуре — 183°С Н 2 О 2 8 Этот газ хорошо поддерживает горение . 9. Самый распространённый элемент космоса. 10. Входит в состав оксидов. 1 Газ без цвета, без запаха
Лаборатория формул ОКСИДЫ металлы неметаллы H 2 O Ca Cl Al 2 O 3 K 3 PO 4 N 2 O 5 S ZnO N Na
Лаборатория формул ОКСИДЫ металлы неметаллы H 2 O Ca Cl Al 2 O 3 K 3 PO 4 N 2 O 5 S ZnO N Na
1 Химические свойства кислорода 2 Химические свойства водорода 3 Химические свойства воды Лаборатория формул
Применение кислорода О 2
Применение водорода Н 2
Кислород – это … Водород – это … Оксиды – это … Вода- это…. Домашнее задание: Подготовиться к контрольной работе Билеты на выход
Рефлексия Я Мы Урок Теоретик Активные Интересный Аналитик Внимательные Увлекательный Ученик Трудолюбивые Полезный Экспериментатор Любознательные Нужный Сотрудник Креативные Коллективный Химик Целеустремленные Творческий МБОУ «Обоянская СОШ №1»
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

По теме: методические разработки, презентации и конспекты
Контрольная работа по химии в 8 классе: «Кислород. Водород. Вода.»
Цель: проверить усвоение учащимися знаний о свойствах и получении кислорода и водорода; катализаторе, растворах. проверить умение учащихся решать задачи на приготовление растворов. .
Разноуровневые варианты контрольных работ по темам: «Кислород. Водород. Вода, растворы, основные классы неорганических соединений»
Дифференцированные задания для работы с учащимися различными способностями.
Презентация к уроку химии 8 класс по теме «Растворение. Растворимость веществ в воде»
Презентация к уроку 8 класса по химии по теме «Растворение. Растворимость веществ в воде», можно использовать при объяснении нового материала. Первый урок по данной теме.
Конспект урока химии 9 класс по теме: «Кислород, его общая характеристика и нахождение в природе. Получение кислорода»
Урок химии 9 класс по теме: «Кислород, общая характеристика и нахождение в природе. Получение кислорода».
Урок химия 8 класс «вода — растворитель. Растворы.
Презентация к уроку химия 8 класс «Вода — растворитель . Растворы.».
8 класс, Контрольная работа по темам «Кислород», «Водород», «Вода»
Материал для самоподготовки, 8 класс.
Контрольная работа по химии по теме «Кислород, водород, вода, растворы» 8 класс
Контрольная работа по химии по теме «Кислород, водород, вода, растворы» 8 класс.
🎬 Видео
Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

8 класс. Составление уравнений химических реакций.Скачать

Водород/химические свойства водорода/8 классСкачать

Задание №8 в ЕГЭ по химии | Саша Сильвер | ЕГЭ 2024 | SMITUPСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Водород и кислород. 2 часть. 8 класс.Скачать

Уравнивание реакций горения углеводородовСкачать

Химия | ВодородСкачать

Химические свойства воды/часть 1/химия 8 классСкачать

Свойства и применение водорода. 8 класс.Скачать