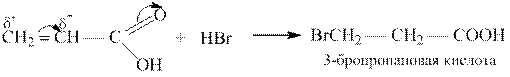Муравьиная кислота НСООН – жидкость с резким запахом. Соли и сложные эфиры муравьиной кислоты называются формиатами. Она обладает многими химическими свойствами карбоновых кислот, но ей присущи и некоторые специфические свойства.
Муравьиная кислота, в отличие от других карбоновых кислот, обладает восстановительными свойствами, легко окисляется при действии KMnO4 и Ag2O, при этом образуется оксид углерода (IV) и вода. При нагревании с концентрированной серной кислотой муравьиная кислота дегидратируется с образованием оксида углерода (II):
Акриловая кислота CH2 = CHCOOH – простейшая ненасышенная алифатическая карбоновая кислота. Соли и эфиры её называются акрилатами.
Акриловая кислота – типичный представитель α, β-ненасыщенных кислот, связь С = С в молекулах которых находится в сопряжении с карбонильной группой. Вследствие электроноакцепторного действия карбоксильной группы реакции электрофильного присоединения к двойной связи акриловой кислоты протекают против правила Марковникова:
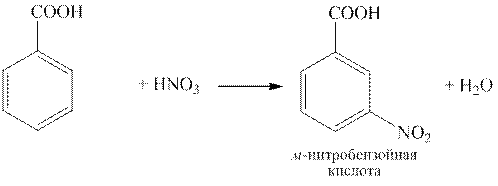
Бензойная кислота C6H5COOH – простейшая ароматическая карбоновая кислота. Соли и эфиры бензойной кислоты называются бензоатами. Как кислота она несколько сильнее уксусной вследствие электроноакцепторного действия фенильного радикала.
Бензойная кислота по химическим свойствам подобна карбоновым кислотам жирного ряда, но также ей присущи реакции электрофильного замещения (SE). Так как карбоксильная группа является ориентантом второго ряда, электрофильное замещение у бензойной кислоты проходит в мета-положение и весьма трудно:
Щавелевая кислота HOOC ─ COOH – простейшая дикарбоновая кислота, широко распространена в растительном мире. В виде солей содержится в листьях щавеля, кислицы, ревеня. Малорастворимая в воде кальциевая соль является составной частью почечных камней. Щавелевая кислота – одна из самых сильных органических кислот, соли и эфиры её называются оксалатами.
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия в оксид углерода (IV). Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. На восстановительных свойствах щавелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
Качественной реакцией для обнаружения щавелевой кислоты и её солей служит образование малорастворимого оксалата кальция.
Бутендиовая кислота HOOCCH = CHCOOH – простейшая ненасышенная дикарбоновая кислота. Существует в виде стероизомеров: цис-изомера (малеиновой кислоты) и транс-изомера (фумаровой кислоты). Эти кислоты отличаются по своим физическим и химическим свойствам.
Малеиновая кислота термодинамически менее устойчива, чем фумаровая. Поэтому при нагревании и под действием радикалобразующих веществ малеиновая кислота превращается в фумаровую.
Малеиновая кислота ядовита и среди природных соединений не найдена. Фумаровая кислота содержится во многих растениях.
Как фумаровая, так и малеиновая кислота при восстановлении дают одну и ту же янтарную кислоту:
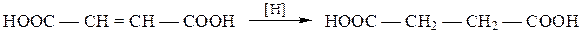
и присоединяют воду с образованием яблочной кислоты:
Видео:Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Муравьиная кислота
В 1670 г. английский ботаник и зоолог Джон Рей (1627—1705) провёл необычный эксперимент. Он поместил в сосуд рыжих лесных муравьёв, налил воды, нагрел её до кипения и пропустил через сосуд струю горячего пара. Такой процесс химики называют перегонкой с паром и широко используют для выделения и очистки многих органических соединений. После конденсации пара Рей получил водный раствор нового химического соединения. Оно проявляло типичные свойства кислот, поэтому и было названо муравьиной кислотой (современное наименование — метановая). Названия солей и эфиров метановой кислоты — формиатов — также связаны с муравьями (лат. formica — «муравей»).
Впоследствии энтомологи — специалисты по насекомым (от греч. «энтокон» — «насекомое» и «логос» — «учение», «слово») определили, что у самок и рабочих муравьёв в брюшках есть ядовитые железы, вырабатывающие кислоту. У лесного муравья её примерно 5 мг. Кислота служит насекомому оружием для зашиты и нападения. Вряд ли найдётся человек, который не испытал их укусов. Ощущение очень напоминает ожог крапивой, ведь муравьиная кислота содержится и в тончайших волосках этого растения. Вонзаясь в кожу, они обламываются, а их содержимое болезненно обжигает.
Муравьиная кислота есть также в пчелином яде, сосновой хвое, гусеницах шелкопряда, в небольших количествах она найдена в различных фруктах, в органах, тканях, выделениях животных и человека. В XIX в. муравьиную кислоту (в виде натриевой соли) получили искусственно действием оксида углерода(II) на влажную щёлочь при повышенной температуре: NaOH + СО = HCOONa. И наоборот, под действием концентрированной серной кислоты муравьиная кислота распадается с выделением газа: НСООН = СО + Н2О. Эта реакция используется в лаборатории для получения чистого СО. При сильном нагревании натриевой соли муравьиной кислоты — формиата натрия — идёт совсем другая реакция: углеродные атомы двух молекул кислоты как бы сшиваются и образуется оксалат натрия — соль щавелевой кислоты: 2HCOONa = NaOOC—COONa + Н2.
Важное отличие муравьиной кислоты от других карбоновых кислот в том, что она, как двуликий Янус, обладает одновременно свойствами и кислоты, и альдегида: в её молекуле с одной «стороны» можно увидеть кислотную (карбоксильную) группу —СО—ОН, а с другой — тот же атом углерода, входящий в состав альдегидной группы Н—СО—. Поэтому муравьиная кислота восстанавливает серебро из его растворов — даёт реакцию «серебряного зеркала», которая характерна для альдегидов, но не свойственна кислотам. В случае муравьиной кислоты эта реакция, что тоже необычно, сопровождается выделением углекислого газа в результате окисления органической кислоты (муравьиной) до неорганической (угольной), которая неустойчива и распадается: НСООН + [O] = НО—СО—ОН = СО2 + Н2O.
Муравьиная кислота — самая простая и при этом сильная карбоновая кислота, она в десять раз сильнее уксусной. Когда немецкий химик Юстус Либих впервые получил безводную муравьиную кислоту, оказалось, что это очень опасное соединение. При попадании на кожу оно не только жжёт, но и буквально растворяет её, оставляя трудно заживающие раны. Как вспоминал сотрудник Либиха Карл Фогт (1817—1895), у него на всю жизнь остался шрам на руке — результат «эксперимента», проведённого совместно с Либихом. И неудивительно — впоследствии обнаружилось, что безводная муравьиная кислота растворяет даже капрон, нейлон и прочие полимеры, которые не берут разбавленные растворы других кислот и щелочей.
Неожиданное применение муравьиная кислота нашла при изготовлении так называемых тяжёлых жидкостей — водных растворов, в которых не тонут даже камни. Такие жидкости нужны геологам для разделения минералов по плотности. Растворяя металлический таллий в 90-процентном растворе муравьиной кислоты, получают формиат таллия НСООТl. Эта соль в твёрдом состоянии, может быть, и не рекордсмен по плотности, но её отличает исключительно высокая растворимость: в 100 г воды при комнатной температуре можно растворить 0,5 кг (!) формиата таллия. У насыщенного водного раствора плотность изменяется от 3,40 г/см 3 (при 20 о С) до 4,76 г/см 3 (при 90 о С). Еще большая плотность у раствора смеси формиата таллия и малоната таллия — соли малоновой кислоты CH2(COOTl)2.
При растворении этих солей (в пропорции 1:1 по массе) в минимальном количестве воды образуется жидкость с уникальной плотностью: 4,324 г/см 3 при 20 о С, а при 95 о С плотность раствора можно довести и до 5,0 г/см 3 . В таком растворе плавают барит (тяжёлый шпат), кварц, корунд, малахит и даже гранит!
Муравьиная кислота обладает сильными бактерицидными свойствами. Поэтому её водные растворы используют как пищевой консервант, а парами дезинфицируют тару для продовольственных товаров (в том числе винные бочки), уничтожают пчелиных клещей. Слабый водно-спиртовой раствор муравьиной кислоты (муравьиный спирт) применяют в медицине для растираний.
Видео:11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🎦 ВидеоСвойства карбоновых кислот. 1 часть. 11 класс.Скачать  Свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Карбоновые кислотыСкачать  Почему муравьиная кислота такая странная??Скачать  11.2. Карбоновые кислоты: Способы получения. ЕГЭ по химииСкачать  44. Карбоновые кислоты (часть 3)Скачать  46. Соли карбоновых кислотСкачать  11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Карбоновые кислоты #shortsСкачать  Карбоновые кислоты | Органическая химия | Химия ЕГЭ, ЦТСкачать  Все о получении карбоновых кислот за 45 минут | Химия ЕГЭ 10 класс | УмскулСкачать  Карбоновые кислотыСкачать  Высшие карбоновые кислоты #shortsvideoСкачать  43. Карбоновые кислоты (часть 2)Скачать  Химические свойства карбоновых кислотСкачать  КАРБОНОВЫЕ КИСЛОТЫСкачать  Специфические химические свойства карбоновых кислот | Химия ЕГЭ 10 класс | УмскулСкачать  |