Перед изучением этого раздела рекомендую прочитать следующую статью:
Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH4 + ) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания, которые самопроизвольно разлагаются.
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно:
2K 0 + 2 H2 + O → 2 K + OH + H2 0
3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4 Fe +2 (OH)2 + O2 0 + 2H2O → 4 Fe +3 ( O -2 H)3
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Т аким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Видео:8 класс. Составление уравнений химических реакций.Скачать

Степень окисления в неорганической химии
Главная > Документ
| Информация о документе | |
| Дата добавления: | |
| Размер: | |
| Доступные форматы для скачивания: |
2. Неметалл + неметалл = бинарное соединение.
Чаще всего неметаллы реагируют с другими неметаллами при нагревании, образуя бинарные соединения (неметалл с более низкой электроотрицательностью выступает как восстановитель, с более высокой – как окислитель). Исключение составляют реакции между галогенами (кроме F 2 ) и кислородом, поэтому оксиды галогенов получают косвенными способами. F 2 , как самый активный неметалл, при обычных условиях реагирует со всеми неметаллами (с Н 2 со взрывом).
F 2 + H 2 = 2HF (так же с Н 2 реагируют Cl 2 , Br 2 и I 2 ), F 2 + O 2 = O 2 F 2 ,
2H 2 + O 2 = 2H 2 O, H 2 + S = H 2 S,
2S + C = CS 2 , S + O 2 = SO 2 ,
2C + O 2 (недост.) = 2CO, C + O 2 (изб.) = CO 2 ,
2P + 3Cl 2 (недост.) = 2PCl 3, 2P + 5Cl 2 (изб.) = 2PCl 5 ,
4P + 3O 2 (недост.) = 2P 2 O 3 , 4P+ 5O 2 (изб.) = 2P 2 O 5 ,
3. Металл (в ряду напряжений до Al) + H 2 O = гидроксид + H 2 
Металл (в ряду напряжений от Мn до H 2 ) + H 2 O 

Металл (в ряду напряжений после H 2 ) + H 2 O 
Металлы, стоящие в ряду напряжений по Al включительно, взаимодействуют с водой при обычных условиях, образуя гидроксид металла и водород (Mg реагирует при нагревании, Al – при снятии плотной пленки оксида Al 2 O 3 , Be с водой не взаимодействует). Например:
2K + 2H 2 O = 2KOH + H 2 
Металлы, стоящие в ряду напряжений от Al до Н 2 , взаимодействуют с перегретым паром, образуя водород и оксид металла:
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2 

Металлы, стоящие в ряду напряжений после Н 2 , с водой не взаимодействуют:
Cu + H 2 O 
4. Неметалл + вода.
При обычных условиях с водой взаимодействует только F 2 . При этом образуется cложная смесь веществ, т.к. выделяющийся атомарный кислород обладает высокой химической активностью:
F 2 + H 2 O = 2HF + O (H 2 O + O = H 2 O 2 , O + O 2 = O 3 , O + F 2 = OF 2 ).
Частично с водой взаимодействуют Cl 2 и Br 2 , однако равновесие этих реакций сильно смещено влево:
Cl 2 + H 2 O 

Иногда этими реакциями пренебрегают, считая, что имеют дело с растворами Cl 2 и Br 2 в воде – хлорной и бромной водой.
При высокой температуре некоторые неметаллы реагируют с водяным паром:
С + H 2 O = CO 


Взаимодействие металлов и неметаллов с другими соединениями будет изучено позже.
П р о в е р ь с е б я
Упражнение 1. Стрелками отметь результаты взаимодействия воды с металлами.
Упражнение 2. Закончи уравнения реакций:
Упражнение 3. Определи, о каких элементах идет речь:
а) элемент А – жидкий при н.у. металл . ;
б) неметалл Б при взаимодействии с водяным паром образует песок . ;
в) элемент В образует два газообразных простых вещества . ;
г) элемент Г образует самое легкое газообразное при н. у. простое вещество . ;
д) оксид элемента Д – самый распространенный на Земле . .
Упражнение 4. Составь уравнения реакций согласно схемам (в отдельной тетради):
а) С 




б) Cl 2 



в) N 2 

Упражнение 5. По схемам реакций определи вещества A, В и С (А и В – простые, т.е. состоят из атомов одного элемента):
A + B 

7.1. Kлассификация оксидов
Оксиды – соединения атомов двух элементов, один из которых кислород в степени окисления –2.
В оксидах атомы кислорода связаны только с атомами другого элемента и не связаны друг с другом. Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (–О–О–), называют пероксидами .
Не образуют оксидов только Hе, Ne, Аr и F. Различают высшие оксиды , в которых атом элемента проявляет высшую степень окисления (обычно равна номеру группы, в которой находится элемент), и низшие оксиды – те, в которых атом элемента проявляет низшую степень окисления. Оксиды, содержащие атомы элемента в разных степенях окисления, называют двойными, например:
Fe 3 O 4 


По химическим свойствам оксиды делятся на солеобразующие (образуют соли при взаимодействии с кислотами и/или щелочами) и несолеобразующие (не образуют солей, безразличны к кислотам и щелочам; к ним относятся СO, NO, N 2 O, SiO, S 2 O).
Многие солеобразующие оксиды присоединяют воду. Этот процесс называется гидратацией, а его продукты – гидратами оксидов, или гидроксидами (содержат одну или несколько гидроксигрупп –ОН).
Некоторые оксиды с водой не взаимодействуют, их гидроксиды можно получить косвенным путем.
Оксид и гидроксид соответствуют друг другу, если содержат один и тот же элемент с одной и той же степенью окисления атома.
Солеобразующие оксиды разделяют на осн о вные, кислотные и амфотерные в зависимости от типа соответствующего гидроксида. Kислотно-осн о вные свойства родственных оксидов и гидроксидов (Na 2 O и NaOH, SO 3 и H 2 SO 4 ) cовпадают.
Основными называют оксиды, которым соответствуют гидроксиды – основания.
Kислотными называют оксиды, которым соответствуют гидроксиды – кислоты.
Амфотерными называют оксиды, которым соответствуют амфотерные гидроксиды.
Неметаллы образуют только кислотные и несолеобразующие оксиды; металлы образуют все осн о вные, все амфотерные и некоторые кислотные оксиды. Многие металлы побочных подгрупп, имеющие в соединениях переменную с.о. атомов, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от с.о. атома элемента. С ростом степени окисления атома элемента его электроотрицательность растет. Соответственно растут неметаллические свойства элемента, а также кислотные свойства его оксида и гидроксида.
Оксиды металлов в с.о. атомов +1 (Na 2 O, K 2 O и др.), а также большинство оксидов металлов в с.о. атомов +2 (FeO, MgO и др.) являются осн о вными. Исключения: BeO, ZnO, PbO, SnO – амфотерные. Большинство оксидов металлов в с.о. атомов +3 и +4 – амфотерные (Al 2 O 3 , Cr 2 O 3 , Fe 2 O 3 , SnO 2 , PbO 2 и др.). Оксиды металлов в с.о. атомов +5, +6, +7, +8 – кислотные (Mn 2 O 7 , CrO 3 , Sb 2 O 5 и др.) (схема 1).
П р о в е р ь с е б я
Упражнение 1. Выбери из списка формулы оксидов, назови их и составь их графические формулы (в оксидах число связей Э–О равно с.о. атома элемента, связей О–О нет):
H 2 O, CO 2 , As 2 O 3 , P 2 O 5 , SO 2 , OF 2 , H 2 O 2 , I 2 O 7 ,
HClO, SO 3 , Na 2 O 2 , KO 2 , KO 3 , P 4 O 6 , P 4 O 10 , СO.
Упражнение 2. Составь графические формулы веществ:
углекислый газ, угарный газ, веселящий газ, негашеная известь, глинозем, жженая магнезия, кремнезем, сернистый газ.
Упражнение 3. Не обращаясь к периодической системе (ПС), определи, в какой группе находятся химические элементы, образующие высшие оксиды:
PbO 2 – ………. , Sb 2 O 5 – ………. , TeO 3 – ………. ,
Mn 2 O 7 – ………. , OsO 4 – ………. , Sc 2 O 3 – ………. .
Упражнение 4. Составь формулы высших оксидов элементов с порядковыми номерами 14, 34, 41, 75, 33, 50, 40, назови их и определи их характер (основный, кислотный, амфотерный, несолеобразующий).
Упражнение 5. Изобрази графические формулы и укажи характер оксидов:
а) азота со степенями окисления атома +1, +2, +3, +5;
б) хлора со степенями окисления атома +1, +3, +5, +7;
в) марганца со степенями окисления атома +2, +3, +4, +7.
Упражнение 6. Составь формулы и укажи характер высших оксидов всех элементов: а) VIа группы ПС; б) 3-го периода ПС. Kакая существует закономерность в изменении свойств высших оксидов элементов одного периода?
Упражнение 7. Определи элементы по следующим данным:
а) элемент 3-го периода, высший оксид – Э 2 О 5 , ……………………. ;
б) элемент 2-го периода, высший оксид – ЭО 2 , …………………….. ;
в) элемент V группы ПС, образует высший оксид, в котором суммарное число протонов в молекуле меньше 80, а суммарное число электронов больше 55, …………………. ;
г) элемент Х образует два бинарных соединения с кислородом, ни одно из которых оксидом не является, …………………. ;
д) элемент Y образует два газообразных оксида (с.о. равны +2 и +4), один из них – несолеобразующий …………………….. ;
е) элемент Z в виде простого вещества входит в состав земной атмосферы, образует два несолеобразующих оксида и несколько солеобразующих …………………………. .
Упражнение 8. Используя литературные источники, определи агрегатное состояние, цвет и летучесть следующих оксидов:
SO 2 , SO 3 , NO 2 , N 2 O 3 , N 2 O 5 , Cl 2 O, Cl 2 O 7 , HgO, WO 3 , Mn 2 O 7 , MnO 2 ,
Fe 2 O 3 , FeO, Cr 2 O 3 , CrO 3 , ZnO, CuO, Cu 2 O, SnO 2 , P 2 O 3 , P 2 O 5 .
7.2. Оксиды и соответствующие им гидроксиды
Программа деятельности № 4
«Составление формулы оксида, соответствующего гидроксиду»
1) Определи степень окисления атома элемента в гидроксиде
2) Составь формулу оксида элемента с найденной степенью окисления атома (с.о. атома кислорода в оксиде равна –2)
Программа деятельности № 5
«Составление формулы гидроксида, соответствующего оксиду»
Программа деятельности № 6
«Составление графической формулы гидроксида»*
* Для гидроксидов, в составе которых один атом «гидроксидобразующего» элемента.
7.3. Несолеобразующие оксиды
Несолеобразующие оксиды (СO, NO, N 2 O, SiO, S 2 O) в химические реакции вступают редко, они безразличны к кислотам и щелочам и не имеют соответствующих гидроксидов. Наибольший интерес представляет СО, который при высокой температуре восстанавливает многие металлы и неметаллы из их оксидов.
CO + CuO = Cu + CO 2 

CO + H 2 O 



П р о в е р ь с е б я
Упражнение 1. Составь графические формулы оксидов, соответствующих гидроксиду:
а) HNO 3 ; б) H 4 P 2 O 7 ; в) Cr(OH) 3 ; г) H 2 Cr 2 O 7 ; д) HNO 2 ; е) H 2 SO 3 .
Упражнение 2. Составь графические формулы гидроксидов, соответствующих оксиду:
а) N 2 O 3 ; б) P 2 O 5 ; в) NO 2 ; г) BeO; д) CrO 3 ; е) CO; ж) СO 2 ; з) Co 2 O 3 ; и) Cl 2 O 7 .
Упражнение 3. Заполни таблицу, составь формулы оксидов, гидроксидов и солей, соответствующих друг другу (кислота и соответствующая ей соль имеют одинаковый кислотный остаток; основание и соответствующая ему соль имеют одинаковый катион).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Металлы Неметаллы Оксиды Основания Кислоты Соли
Свойства химических соединений в первую очередь определяются их составом, поэтому надо четко разбираться в закономерностях составления химических формул, отражающих этот состав. При изучении отдельных классов неорганических соединений надо знать определение каждого класса, классификацию, способы получения и свойства. Оксиды.Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. В оксидах атомы кислорода соединяются только с атомами других элементов и не связаны между собой. Названия оксидов элементов, имеющих постоянную степень окисления, составляются из двух слов «оксид + название элемента в родительном падеже»: MgO — оксид магния, Na2O — оксид натрия, СаО — оксид кальция.Если элемент образует несколько оксидов, то после названия элемента указывается его степень окисления римской цифрой в скобках: МnО — оксид марганца (II), Мn2О3 — оксид марганца (III).Название оксидов можно также образовывать добавлением к слову «оксид» греческих числительных. Например, СО2 — диоксид углерода, SO2 — диоксид серы, SO3 — триоксид серы, OsO4 — тетраоксид осмия.По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Оксиды, которые при химических реакциях образуют соли, называются солеобразующими: СО2 + Са(ОН)2 = СаСО3 + Н2О оксид углерода (IV) гидроксид кальция карбонат кальция MgO + 2НС1 = MgCl2 + Н2О оксид магния хлороводородная кислота хлорид магния СО2 и MgO — солеобразующие оксиды. Оксиды, которые не образуют солей, называются несолеобразующими: NO — оксид азота (II), N2O — оксид азота (I), SiO — оксид кремния (II) — это несолеобразующие оксиды. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.К основным оксидам относятся только оксиды металлов: щелочных (Li, Na, К, Rb, Cs, Fr), щелочноземельных (Mg, Ca, Sr, Ba, Ra), лантана, а также всех остальных металлов в их низших степенях окисления. Например, Na2O, CaO, Cu2O, CrO, MnO, BaO, La2O3 — основные оксид. Гидраты всех основных оксидов являются основаниями:
| Na2O → NaOH | СаО | → Са(ОН)2. |
| оксид основание | оксид | основание |
| натрия гидроксид | кальция | гидроксид |
| натрия | кальция |
К кислотным оксидам относятся оксиды неметаллов, а также металлов в высших степенях окисления. Например, SO2, SO3, СО2, СrО3, Мn2О7 — кислотные оксиды. Гидраты всех кислотных оксидов являются кислотами:
| SO2 → Н2SO3 | N2О5 → | НNO3 |
| оксид сернистая | оксид | азотная |
| cеры (IV) кислота | азота (V) | кислота |
К амфотерным оксидам относятся оксиды некоторых металлов главных подгрупп (оксиды бериллия, алюминия), а также оксиды некоторых металлов побочных подгрупп периодической системы элементов Д. И. Менделеева в промежуточных степенях окисления. Например, BeO, A12O3, ZnO, MnO3, Fe2O3, Cr2O3 — амфотерные оксиды. Гидроксиды амфотерных оксидов проявляют свойства кислот и оснований: Zn(OH)2 ← ZnO → H2ZnO2 гидроксид цинка оксид цинка цинковая кислота
Составление формул оксидов. При составлении формул оксидов рекомендуем придерживаться следующего плана (на примере оксида азота (III)): 1) записать химические знаки элементов, входящих в состав вещества, и указать их степени окисления: N +3 O -2 2) найти наименьшее общее кратное степеней окисления: 3 x 2 = 6 3) определить индексы элементов, разделив наименьшее общее кратное на модуль степени окисления каждого элемента: 6 : 3 = 2; 6 : 2 = 3. 4) полученные индексы приписать справа к знакам элементов: N2O3. Основания.Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп (OH — ). Например, Fe(OH)3, Ca(OH)2 . Названия оснований складывается из слов «гидроксид» и названия металла в родительном падеже: Ва(ОH)2 – гидроксид бария; NaOH – гидроксид натрия. Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 — гидроксид железa (II), Bi(OH)3 — гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 — дигидроксид кальция, Вi(ОН)3 — тригидроксид висмута. Число гидроксогрупп в молекуле основания определяет его кислотность. В зависимости от числа протонов, которые может присоединить основание, различают: 1) однокислотные (NaOH, КОН, NH4OH), 2) двухкислотные (Ca(OH)2, Sr(OH)2, Ва(OH)2), 3) трехкислотные (La(OH)3, Bi(OH)3) и т.д. основания. Остатки оснований.Положительно заряженные группы атомов (катионы), которые остаются после отрыва от молекулы основания одной или нескольких гидроксогрупп, называются остатками основания. Величина положительного заряда остатка основания определяется числом оторвавшихся гидроксогрупп. В табл. 1 приведены формулы и названия некоторых оснований и их остатков. Таблица 1 — Названия и формулы некоторых оснований и их остатков (по номенклатуре ИЮПАК)
| Формула основания | Название основания | Остаток основания | Название остатка |
| NaОН | Гидроксид натрия | Na + | Натрий-ион |
| NH4OH | Гидроксид аммония | NH4 + | Аммоний-ион |
| Mg(ОН)2 | Гидроксид магния | MgOH + Mg 2+ | Гидроксомагний-ион Магний-ион |
| Bi(OH)3 | Гидроксид висмута (III) | Bi(OH) + Bi(OH) 2+ Bi 3+ | Дигидроксовисмут (III) — ион Гидроксовисмут (III)-ион Висмут (III)-ион |
| Mn (OH)2 | Гидроксид марганца (II) | MnOH+ Mn 2+ | Гидроксомарганец (II)-ион Марганец (II)-ион |
Амфотерные гидроксиды. Амфотерными называются такие гидроксиды, которые в зависимости от условий проявляют основные и кислотные свойства. Например: Zn(OH)2 + 2HCI = ZnCl2 + 2H2O Zn(OH)2 + 2H + = Zn 2+ + 2H2O Zn(OH)2 + 2NaOH = [Na2[Zn(OH)4] Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O в растворе тетрагидроксоцинкат натрия при сплавлении цинкат натрия С позиций теории электролитической диссоциации, амфотерными называются гидроксиды, которые при диссоциации образуют и катионы водорода, и гидроксид-ионы. К амфотерным гидроксидам относятся гидроксиды некоторых металлов главных подгрупп (бериллия, алюминия), а также некоторых металлов побочных подгрупп периодической системы элементов в промежуточных степенях окисления. Например, Ве(ОН)2, А1(ОН)3, Zn(OH)2, Ge(OH)2, Sn(OH)4, Fe(OH)3, Cr(OH)3 — амфотерные гидроксиды. Кислоты. Кислотами называют сложные соединения, в состав которых входят атомы водорода, способные замещаться атомами металла. Кислоты различают: 1) по наличию или отсутствию кислорода в составе кислоты: а) бескислородные (это водные растворы водородных соединений неметаллов VI и VII групп периодической системы элементов H2S, Н2Те, HF, HC1, HBr, HI, а также HSCN и HCN); б) кислородсодержащие (это гидраты оксидов неметаллов, а также некоторых металлов в высших степенях окисления (+5, +6, +7) — Н2СО3, H2SO4, Н2СlO4 и т.д.); 2) по основности(т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов с образованием соли) а) одноосновные (НС1, HNO3, HCN, CH3COOH), б) двухосновные (H2S, H2SO4, H2CO3), в) трехосновные (Н3РО4, H3AsO4) и т.д.
Названия бескислородных кислот составляют из названия элемента + О + слово «водородная»: НС1 — хлороводородная кислота; H2S — сероводородная кислота; HCN — циановодородная кислота; HI — йодоводородная кислота. Названия кислородных кислот производятся от названия неметалла с прибавлением –ная, — вая, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке : —оватая; — истая; — оватистая: HCIO4 – хлорная кислота; HCIO2 – хлористая кислота; HCIO3 – хлорноватая кислота; HCIO − хлорноватистая кислота; HNO3 − aзотная; HNO2 – азотистая; H2SO4 − серная; H2SO3 – сернистая. Анионы кислоты. Отрицательно заряженные группы атомов и одиночные атомы (отрицательные ионы), которые остаются после отрыва от молекулы кислоты одного или нескольких атомов водорода, называются анионами кислоты. Величина отрицательного заряда аниона кислоты определяется числом атомов водорода, замещенных металлом (табл. 2). Соли. Соли – это продукты замещения водорода кислоты металлом или гидроксогрупп основания кислотными остатками. Например, 2НСl + Zn = ZnCl2 + H2 Н2SO4 + 2NaOH = Na2SO4 + 2H2O кислота соль кислота основание соль С позиций теории электролитической диссоциации, соли — это электролиты, при диссоциации которых образуются катионы,отличные от катионов водорода, и анионы, отличные от анионов ОН — .
Таблица 2 — Названия и формулы некоторых кислотных остатков
| Формула кислоты | Название кислоты | Анион | Название аниона |
| НС1 | Хлороводородная (соляная) | Сl — | Хлорид-ион |
| НВr | Бромоводородная | Вr — | Бромид-ион |
| HI | Йодоводородная | I | Йодид-ион |
| H2S | Сероводородная | HS – S 2– | Гидросульфид-ион Сульфид-ион |
| HClO | Хлорноватистая | ClO – | Гипохлорит-ион |
| HClO2 | Хлористая | ClO2 — | Хлорит-ион |
| НСlO3 | Хлорноватая | СlO3 — | Хлорат-ион |
| HClO4 | Хлорная | ClO4 — | Перхлорат-ион |
| H2SO3 | Сернистая | HSO3 – SO3 2– | Гидросульфит-ион Сульфит-ион |
| H2SO4 | Серная | HSO4 — SO4 2− | Гидросульфат-ион Сульфат-ион |
| HNO2 | Азотистая | NO2 − | Нитрит-ион |
| HNO3 | Азотная | NO3 − | Нитрат-ион |
| H3PO4 | Ортофосфорная | н2ро4 — нро4 2 — ро4 3 — | Дигидрофосфат-ион Гидрофосфат-ион Ортофосфат-ион |
| H2CO3 | Угольная | НСО3 — СО3 2- | Гидрокарбонат-ион Карбонат-ион |
| H2SiO3 | Кремниевая | HSiO3 — SiO3 2- | Гидросиликат-ион Силикат-ион |
| HMnO4 | Марганцовая | МnО4 — | Перманганат-ион |
| H3BO3 | Борная (ортоборная) | ВО3 3- | Борат-ион |
| Н2СrO4 | Хроматы | СrO4 2- | Хромат-ион |
| H2Cr2O7 | Дихромовая | Cr2O7 2 — | Дихромат-ион |
| HCN | Циановодородная | CN − | Цианид-ион |
Соли принято делить на средние, кислые и основные. Средняя соль — это продукт полного замещения водорода кислоты металлом или гидроксогруппы основания кислотным остатком. Например, Na2SO4, Са(NО3)2 — средние соли. Кислая соль — продукт неполного замещения водорода многоосновной кислоты металлом. Например, NaHSO4, Са(НСО3)2 — кислые соли. Основная соль — продукт неполного замещения гидроксогрупп многокислотного основания кислотными остатками. Например, Mg(OH)NO3, Al(OH)Cl2 — основные соли. Если атомы водорода в кислоте замещаются атомами разных металлов или гидроксогруппы оснований замещаются различными кислотными остатками, то образуются двойные соли. Например, KA1(SO4)2, Са(ОС1)С1. Двойные соли существуют только в твердом состоянии. Комплексные соли — это соли, в состав которых входят комплексные ионы. Например, соль K4[Fe(CN)6] — комплексная, так как в ее состав входит комплексный ион [Fe(CN)6] 4- . Составление формул солей.При составлении формул солей нужно помнить правило: абсолютная величина произведения зарядов катионов на их число равна абсолютной величине произведения заряда кислотного остатка на число кислотных остатков. Например, для составления формулы карбоната натрия: 1) записывают катион и рядом анион из таблиц 1 и 2: Na + CO3 2- ; 2) находят наименьшее общее кратное модулей зарядов: 1х2=2; 3) делят общее кратное на модуль заряда катиона и получают их число (индекс): 2/1=2. Также находят число анионов: 2/2=1; 4) проставляют индексы и получают формулу Na2CO3. Название солей образуется из названия кислотного остатка (табл.2) в именительном падеже и названия катиона (табл. 1) в родительном падеже (без слова «ион»): NaCI – хлорид натрия; FeS — сульфид железа (II); NH4CN — цианид аммония. Окончания названий анионов кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента:
| Окончание названия кислоты | Название аниона |
| -ная, -овая | -ат |
| -истая | -ит |
| -оватистая | гипо- + -ит |
Например, CaCO3 – карбонат кальция; Fe2(SO3)3— сульфит железа (III). Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро-,указывающей на наличие незамещенных атомов водорода (число атомов водорода указывают греческими числительными приставками). Катион основной соли получает приставку гидроксо-,указывающую на наличие незамещенных гидроксогрупп. Например, СаНРО4 – гидроортофосфат кальция; (MgOH)2SO4 — сульфат гидроксомагния; NaHCO3 — гидрокарбонат натрия; КА1(SO4)2 — сульфат калия-алюминия. Генетические связи.Генетические связи — это связи между разными классами, основанные на их взаимопревращениях. Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент. Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений: металл– основный оксид–щёлочь–соль, например генетический ряд калия K – K2O –KOH–KCl.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание. Данный ряд можно представить цепочкой превращений: металл–основный оксид–соль–нерастворимое основание–основный оксид–металл. Например: Cu – CuO – CuCl2 – Cu(OH)2 – CuO – Cu.
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл–кислотный оксид–растворимая кислота–соль. Например: P – P2O5 – H3PO4 – Na3PO4.
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота: неметалл – кислотный оксид – соль – кислота –кислотный оксид – неметалл. Например:
Si – SiO2 – Na2SiO3 – H2SiO3 – SiO2 – Si. При изучении химических свойств различных классов неорганических соединений необходимо помнить, что взаимодействовать друг с другом могут только вещества, относящиеся к различным генетическим рядам (металла и неметалла), что отражено схемой:
2.3 Семинар № 1. «Способы получения и химические свойства оксидов, кислот, оснований, солей»Цель: отработка навыков составления молекулярных и структурных формул веществ, составления названий и определения принадлежности соединений к определенным классам. Вопросы для обсуждения и задания: 1.Какие вещества называют оксидами? Составьте формулы и дайте названия оксидов следующих элементов:а) калия; б) цинка; в) фосфора (III); г) кремния (IV); д) хрома (VI); е) хлора (VII); ж) ртути (II).2.Изобразите графически формулы следующих оксидов: а) оксида меди (I); б) оксида фосфора (V); в) оксида серы (VI); г) оксида марганца (VII); д) оксида азота (III).3. Приведите примеры несолеобразующих оксидов.Какие оксиды называются: а) основными; б) кислотными; в) амфотерными? Приведите примеры всех видов оксидов.4.Как зависит характер оксида от положения элемента в периодической системе элементов Д.И. Менделеева? Ответ проиллюстрируйте примерами.5. Какие из следующих соединении будут реагировать с оксидом серы (VI): P2O3, СаО, НNO3, Ва(ОН)2, MgO, H2O, SO2? Напишите уравнения возможных реакций.6. Cоставьте формулы оксидов и их гидратов для следующих элементов: железа (III), марганца (II, VII), серы (IV, VI), хлора (I, VII). Назовите гидроксиды.7. Составьте уравнения реакций между: а) оксидом кальция и оксидом фосфора (V); б) оксидом железа (III) и оксидом серы (VI); в) гидроксидом калия и оксидом цинка; г) серной кислотой и оксидом цинка; д) ортофосфорной кислотой и оксидом цинка. 8. Какие соединения называются основаниями? Чем определяется кислотность оснований? Что называется остатком основания? Приведите примеры. 9. Напишите названия и графические изображения формул следующих оснований и их остатков: Ва(ОН)2, КОН, Cа(ОН)2, La(OH)3, Th(OH)4. 10. Какие основания являются щелочами? Как щелочи изменяют цвет индикаторов? 11. Какая реакция называется реакцией нейтрализации? Напишите уравнения реакций между следующими соединениями (со всеми возможными продуктами): а) гидроксидом калия и азотной кислотой; б) гидроксидом калия и хлоридом никеля (II), в) тригидроксидом висмута и серной кислотой; г) гидроксидом калия и оксидом кремния (IV); д) гидроксидом натрия и сульфатом магния; ж) гидроксидом калия и хлоридом цинка. 12. Напишите уравнения реакций, при помощи которых можно осуществить превращения: а) К → КОН; б) FeSO4 → Fe(OH)2; в) Са(ОН)2 → СаСО3. 13. Какие соединения называются кислотами? Чем определяется основность кислоты? Что называется кислотным остатком и чем определяется его заряд? 14. Напишите формулы оксидов, которые соответствуют кислотам: ортоборной Н3ВО3, марганцовой НMnО4, ортофосфорной Н3РО4. 15. Напишите уравнения реакций разбавленной серной кислоты: а) с алюминием; б) с оксидом магния; в) с гидроксидом железа (III); г) с нитратом бария. Что общего в этих реакциях? 16.Напишите уравнения реакций, с помощью которых можно получить:а) серную кислоту Н2SО4; б) сероводородную кислоту H2S; в) угольную кислоту Н2СО3.17. Какие из следующих металлов вытесняют водород из хлороводородной кислоты: К, Ва, Hg, Fe, Сu, Al, Ag, Na, Mg, Au? Составьте уравнения реакций. 18. Какие соединения называются солями? Какие соли вы знаете?Составьте формулы солей из следующих остатков: а) гидроксомагний-ион иортофосфат-ион; б) гидроксовисмут(III)-ионисульфат ион; в) гидроксовисмут (III)-ион и нитрат-ион; г) висмут(III)-ион и xлорид-ион; д) никель(II)-ион и ортофосфат-ион.19.Дайте названия следующим солям и изобразите графические формулы: MgCl2, Na2SO4, K3PO4, Cu(NO3)2, BaCO3, Fe(NO3)3 FeS, KHCO3, Na2HPO4, NaH2PO4, Fe(OH)Cl.20.Напишите формулы следующих солей: а) сульфат железа (III); б) дигидрофосфат магния; в) хлорид гидроксоалюминия. 21. Какие из следующих веществ взаимодействуют между собой: оксид меди (II), серная кислота, гидроксид кальция, оксид углерода (IV), гидроксид цинка, гидроксид натрия? Напишите уравнения реакций. 22. С соединениями каких классов взаимодействуют металлы? Напишите уравнения соответствующих реакций. 24. При взаимодействии соединений каких классов образуются соли? Напишите уравнения соответствующих реакций. Индивидуальное задание: Для заданной преподавателем соли указать: — название соли; — формулы гидроксидов, ее образовавших, их названия, степень окисления гидроксидообразующего элемента; — формулы оксидов для вышеприведенных гидроксидов, их характер; — уравнения диссоциации гидроксидов (общее и по ступеням): а) основания б) кислоты в) для амфотерных гидроксидов уравнения диссоциации по типу кислоты, и по типу основания; — уравнения реакции получения соли в молекулярном и ионном виде; — графическую формулу соли; — определите значения эквивалентов гидроксидов и соли. Варианты заданий: AlCl3, KNO3, KBr, Na3PO4, Na2CO3, CaCl2, KMnO4, NaClO, KClO3, KClO4, Cr(NO3)3, Zn(NO3)2, K2ZnO2, KAlO2, Na2SO3, Na2S, LiHS, KCN,K2CO3, KHCO3, NaHCO3, (CuOH)2CO3, AlOHCl2 Предлагаемый алгоритм выполнения: — формула соли Al2(SO4)3, ее название – сульфат алюминия — данная соль образована гидроксидом алюминия Al(OH)3, и серной кислотой Н2SO4. Cпень окисления кислотообразующего элемента (серы) +6 — формулы оксидов и их характер: оксид алюминия Al2O3 проявляет амфотерные свойства; оксид серы (VI) SO3 – кислотный оксид. — уравнения диссоциации гидроксидов (общее и по ступеням): а) основания по типу основания: Al(OH)3«Al 3+ +3OH — — общее по ступеням: 1) Al(OH)3«Al(OH)2 + +OH — 2) Al(OH)2 + «AlOH 2+ +OH — 3) AlOH + «Al 3+ +OH — по типу кислоты: H3AlO3 « H2O + HAlO2 Ортоформа метаформа – более устойчивая HAlO2«H + + AlO2 — б) кислоты: H2SO4«2H + +SO4 2- — общее по ступеням: 1) H2SO4«H + +HSO4 — 2) HSO4 — «H + +SO4 2- — реакции образования: а) в молекулярном виде 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2Oб) в полном ионном 2Al(OH)3 +6H + +3SO4 2- = 2Al 3+ + 3SO4 2- + 6H2O в) в сокращенном ионном 2Al(OH)3 +6H + = 2Al 3+ + 6H2O — графическая формула соли
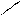





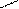
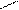
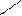
2.5 Тесты для самоконтроля Тест 1 1. Молярная масса гидросульфида натрия равна: 1) 56 2) 64 3) 74 4) 87 2. Какие из оксидов, формулы которых приведены ниже, не реагируют со щелочью? 1) СО2 2) А12О3 3) CuO 4) SiO2 3. В отличие от гидроксида калия гидроксид алюминия реагируем с: 1)хлоридом натрия 2) соляной кислотой 3) гидроксидом натрия (р-р) 4) серной кислотой 4. В каких парах соединения не реагируют между собой? 1)азотная кислота и гидроксид бария 2) гидроксид натрия и гидроксид цинка 3) гидроксид калия и хлорид железа (II) 4) гидроксид кальция и оксид натрия 5. С какими веществами не реагирует разбавленная серная кислота? 1)медью 2) гидроксидом меди (II) 3) оксидом меди (II 4) хлоридом меди (II) 6. Отметьте схемы реакций, в результате которых может получиться кислота: 1) SO3 + Н2О → 2) SiO2+ Н2О → 3) ВаС12 + H2SO4 (разб.) → 4) Na2SiO3 + HNO3 → 7. Гидросульфиту кальция отвечает формула: 1) Ca(HSO3)2 2) (CaOH)Cl 3) Ca(HS)2 4) CaHSO3. 8. Два типа кислых солей образует кислота: 1) угольная 2) сернистая 3) сероводородная 4) ортофосфорная 9. Сумма коэффициентов в молекулярном уравнении реакции Al(OH)3 + SO3 → средняя соль + … равна 1) 4 2) 5 3) 6 4) 9 10. Составьте краткое ионное уравнение реакции взаимодействия гидроксида железа (III) с избытком раствора соляной кислоты. Сумма коэффициентов равна 1) 3 2) 4 3) 6 4) 8
1. Отметьте символ элемента, образующего как кислотный, так и основный оксиды: 1) К 2) S 3) Сu 4) Мn 2. При внесении каких металлов в разбавленный раствор серной кислоты выделяется водород? 1)меди 2) железа 3) цинка 4) серебра 3. Сумма коэффициентов в молекулярном уравнении реакции KOH + H3P O4 → K2HPO4 + … равна: 1) 4 2) 5 3) 6 4) 7 4. Составьте краткое ионное уравнение реакции взаимодействия гидроксида магния с избытком раствора азотной кислоты. Сумма коэффициентов равна 1) 3 2) 5 3) 6 4)9 5. Гидросульфат калия взаимодействует по отдельности в растворе с веществами: 1)К2SO3, HCl, KOH 2) Zn, SiO2, BaCl2 3) CO2, K2CO3, NaOH 4) Mg, K2S, LiOH 6. В какой группе указаны формулы только щелочей? 1) NaOH, Са(ОН)2, Mg(OH)2 2) КОН, NH4OH, Сu(ОН)2 3) NaOH, КОН, Ва(ОН)2 4) LiОН, КОН, Fe(OH)2 7.Укажите формулу дигидроортофосфата кальция: 1) СаНРО4 2) Са3(РО4)2 3) Са(Н2РО4)2 4) Са2Р2О7 8.Каким кислотам, формулы которых приведены ниже, отвечает оксид фосфора (V)? 1) Н3РО4 2) НРО3 3) Н3РО2 4) Н4Р2О7 9. У каких солей заряд кислотного остатка равен -1: 1) сульфид натрия 2) гидросульфит кальция 3) дигидрофосфат натрия 4) гидросульфат калия 10. С какими веществами не реагирует разбавленная серная кислота? 1)медью 2) гидроксидом меди (II) 3) оксидом меди (II) 4) хлоридом меди (II)
Тема 3. «Химическая термодинамика. Энергетика химических процессов»3.1 Содержание программыОсновные понятия химической термодинамики.Первое начало термодинамики. Энтальпия системы.Термохимические расчеты. Закон Гесса.Второе начало термодинамики.Энтропия и ее статистическая интерпретация. Свободная энергия Гиббса.Направление химических процессов. Энтальпийный и энтропийный факторы. Критерий самопроизвольного протекания процесса.
Уровень теоретической и практической подготовки Студент должен знать важнейшие термодинамические понятия и законы. Студент должен уметь производить термохимические расчеты;предсказывать возможность и направление протекания реакций.
🔍 Видео
ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Проклятая химическая реакция 😜 #shortsСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства ОСНОВАНИЙ 8 класс | ПРИНЦИП составления ЛЮБОЙ реакции с участием основанийСкачать