Оксид серы (IV) – это кислотный оксид . Бесцветный газ с резким запахом, хорошо растворимый в воде.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Cпособы получения оксида серы (IV)
1. Сжигание серы на воздухе :
2. Горение сульфидов и сероводорода:
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например , сульфит натрия взаимодействует с серной кислотой:
4. Обработка концентрированной серной кислотой неактивных металлов.
Например , взаимодействие меди с концентрированной серной кислотой:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства оксида серы (IV)
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя .
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов .
Например , оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2(изб) + NaOH → NaHSO3
Еще пример : оксид серы (IV) реагирует с основным оксидом натрия:
2. При взаимодействии с водой S O2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например , оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
Сернистый ангидрид обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистый газ:
Озон также окисляет оксид серы (IV):
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
Оксид свинца (IV) также окисляет сернистый газ:
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение и свойства диоксида углерода и соды
Задача 952.
Как химическим путем можно освободить СО2 от примеси SO2?
Решение:
Для разделения СО2 от примеси SO2 смесь можно пропустить через раствор сероводорода. При этом произойдёт реакция:
СО2 как плохо растворимый газ можно выделить в чистом виде из водного раствора.
Задача 953.
Как получают соду по аммиачному способу? Имеет ли значение порядок насыщения раствора (какого?) диоксидом углерода и аммиаком? Можно ли аналогичным способом получить поташ? Ответ обосновать.
Решение:
Аммиачный способ получения карбоната натрия основан на образовании Na2CO3 при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе. Для этого концентрированный раствор хлорида натрия насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка. При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония:
который затем, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия:
Гидрокарбонат натрия сравнительно мало растворим в холодной воде, и выделяется в виде осадка, который отфильтровывают. При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь поступающий в производство:
Нагревая раствор, содержащий хлорид аммония, с гашёной известью выделяется аммиак:
Аммиак, образуемый в данной реакции, возвращается в производство.
Значение имеет порядок насыщения раствора хлорида натрия сначала аммиаком, а затем только уже диоксидом углерода. Потому что ионы NH4 + , образуемые при насыщении раствора аммиаком, которые не связываются с ионами Cl – , Na + , OH – и Н + . Наоборот, при насыщении раствора хлорида натрия диоксидом углерода происходит связывание ионов СО3 2- с ионами Н + и, процесс может сопровождаться образованием NaHCO3. Поэтому очень важно сначала насытить раствор хлорида натрия аммиаком, а уж затем диоксидом углерода, которые, в таком порядке образуют (NH4)HCO3.
Выработка поташа из хлорида натрия аналогичным способом не может быть осуществлена, потому что КНСО3, в отличие от NаHCO3, хорошо растворим в воде и, поэтому отщепить его от NH4Cl невозможно. Поташ обычно получают из KCl двумя методами. Один из них сводится к обработке СО2 раствора КОН, полученного при электролизе KCl. Другой метод основан на малой растворимости двойной соли KHCO3 . MgCO3 . 4H2O, образуется при насыщении СО2 взвеси MgCO3 . 3H2O в растворе KCl. Под действием MgO разлагается на К2СО3 и MgCO3 . 3H2O, который возвращается в производство.
Задача 954.
Какой объем СО2 (условия нормальные) можно получить из 210 г NaHСО3: а) прокаливанием; б) действием кислоты?
Решение:
а) Уравнение реакции имеет вид:
Рассчитаем объём СО2 из пропорции:
(2 . 84) : 22,4 = 210 : х;
х = (210 . 22,4)/ (2 . 84) = 28 л.
б) Уравнение реакции имеет вид:
Рассчитаем объём СО2 из пропорции:
(2 . 84) : (2 . 22,4) = 210 : х;
х = [210 . (2 . 22,4)]/ (2 . 84) = 56 л.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Оксид серы (IV) SO2, сернистый газ
Взаимодействуя с кислородом, сера образует два оксида:
- SO2 (IV) — сернистый газ (сернистый ангидрид, диоксид серы)
- SO3 (VI) — серный ангидрид
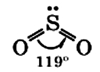
Молекула сернистого газа сильно полярна, угловой формы (угол между связями составляет 119°):
Физические свойства сернистого газа:
- бесцветный ядовитый газ с резким запахом;
- в 2 раза тяжелее воздуха;
- хорошо растворим в воде — при н.у. в 1 объеме воды растворяется 40 объемов SO2 (IV) с образованием сернистой кислоты.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические свойства сернистого газа
Сернистый газ является типичным кислотным оксидом.
- сернистый газ реагирует с основаниями с образованием гидросульфитов (кислые соли) и сульфитов (средние соли):
- реакции сернистого газа с основными оксидами:
- с водой образует сернистую кислоту, которая существует только в растворе и относится к двухосновным кислотам:
Ступенчатая диссоциация сернистой кислоты с образованием гидросульфит-иона на первой ступени диссоциации, и сульфит-иона — на второй:
- пример реакции сернистой кислоты в качестве восстановителя:
- пример реакции сернистой кислоты в качестве окислителя:
Сернистая кислота может образовывать средние соли (сульфиты) — Na2SO3, и кислые соли (гидросульфиты) — NaHSO3.
В окислительно-восстановительных реакциях сернистый газ может выступать, как в роли окислителя (восстанавливаясь в S и H2S), так и в роли восстановителя (окисляясь в H2SO4), т.к. сера в этом соединении занимает промежуточную степень окисления +4.
- в реакции с сероводородом сернистый газ является окислителем:
- в реакции с кислородом при нагревании сернистый газ является восстановителем:
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Получение и применение сернистого газа
В промышленности сернистый газ получают или сжиганием серы, или как побочный продукт обжига сульфидных руд, например, железного колчедана.
В лабораторных условиях диоксид серы можно получить действием концентрированных кислот на соли сернистой кислоты (гидросульфиты и сульфиты), а также в процессе реакции серной кислоты с тяжелым металлом.
Сернистый газ используют для:
- получения оксида серы (VI);
- получения серной кислоты;
- получения сульфитов и гидросульфитов;
- отбеливания тканей в текстильной промышленности;
- уничтожения вредных микроорганизмов в качестве дезинфицирующего средства при консервировании продуктов питания.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📽️ Видео
Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать