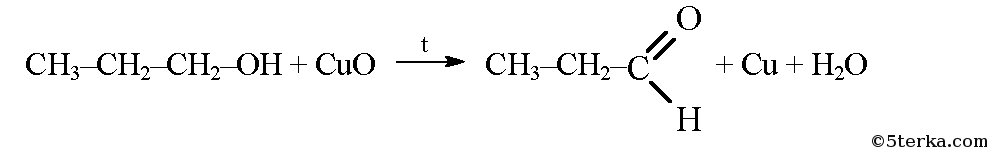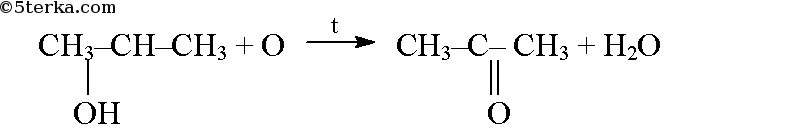При окислении пропанола-1 образуется пропаналь (пропионовый альдегид).
При окислении пропанола-2 образуется ацетон (диметилкетон):
В молекуле пропионового альдегида карбонильная группа связана с углеводородным радикалом (этилом) и атомом водорода и представляет собой альдегидную группу. В молекуле ацетона карбонильная группа связана с двумя метильными радикалами. Пропаналь является альдегидом, а ацетон -кетоном. Эти два вещества изомерны друг другу.

задача №6
к главе «Глава VIII. Альдегиды и карбоновые кислоты §1 (стр. 102) Вопросы».
- webHimik
- Составьте уравнения реакции спиртов пропанол-1 и пропанол-2
- Окисление спиртов пропанол-1 и пропанол-2
- Взаимодействие спиртов пропанол-1 и пропанол-2 с металлическим натрием
- Реакции спиртов пропанол-1 и пропанол-2 с уксусной кислотой
- Внутримолекулярная дегидратация спиртов пропанол-1 и пропанол-2
- Межмолекулярная дегидратация спиртов пропанол-1 и пропанол-2
- Пропанол-1: химические свойства и получение
- Строение пропанола-1
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-1
- Структурная изомерия
- Химические свойства пропанола-1
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CH2–CH2–OK + H2O → СН3–CH2–CH2–OH + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование спиртов
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- 🎥 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

webHimik
подробное решение задач по химии
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Составьте уравнения реакции спиртов пропанол-1 и пропанол-2
Составьте следующие уравнения реакции спиртов пропанол-1 и пропанол-2:
- окисление
- с натрием металлическим
- с уксусной кислотой
- внутримолекулярная дегидратация
- межмолекулярная дегидратация
Решение:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Окисление спиртов пропанол-1 и пропанол-2
Окисление первичных спиртов приводит к образованию молекул альдегидов, а вторичных – кетонов. Соответственно первичный спирт пропанол-1 окисляется до альдегида, а вторичный спирт пропанол-2 окисляется до кетона.

Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие спиртов пропанол-1 и пропанол-2 с металлическим натрием
Спирты со щелочными металлами реагируют как кислоты. Иными словами, щелочные металлы вытесняют водород из гидроксильной группы в молекулах спиртов:

Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакции спиртов пропанол-1 и пропанол-2 с уксусной кислотой
В реакциях с кислотами спирты проявляют основные свойства. Их взаимодействие с карбоновыми кислотами приводит к образованию сложных эфиров.

Видео:Составление уравнений реакций. 1 часть. 9 класс.Скачать

Внутримолекулярная дегидратация спиртов пропанол-1 и пропанол-2
Дегидратация спиртов проходит в присутствии серной кислоты и при нагревании. Какие при этом образуются продукты, зависит от условий. Так, внутримолекулярная дегидратация с отщеплением молекул воды и образованием двойной связи внутри молекулы идет в жестких условиях при высоких температурах

Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Межмолекулярная дегидратация спиртов пропанол-1 и пропанол-2
Дегидратация спиртов в более мягких условиях может приводит к образованию молекул простых эфиров:
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Пропанол-1: химические свойства и получение
Пропанол-1, пропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Составление уравнений реакций. 1 часть. 8 класс.Скачать

Строение пропанола-1
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол смешивается с водой в любых соотношениях.
Видео:Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Изомерия пропанола-1
Видео:8 класс. Составление уравнений химических реакций.Скачать

Структурная изомерия
Для пропанола-1 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические свойства пропанола-1
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-1
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-1 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-1 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-1 взаимодействует с калием с образованием пропилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, пропилат калия разлагается водой: |
СН3–CH2–CH2–OK + H2O → СН3–CH2–CH2–OH + KOH
Видео:Составление уравнений реакций горения. 11 класс.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-1 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-1 с аммиаком образуется пропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, пропанол-1 реагирует с уксусной кислотой с образованием пропилацетата (пропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-1 с азотной кислотой образуется пропилнитрат. |
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-1 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-1 при низкой температуре образуется дипропиловый эфир: |
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов.
| Например, пропанол-1 окисляется оксидом меди до пропионового альдегида |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов.
| Например, при окислении пропанола-1 образуется пропаналь |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии пропанола-1 с перманганатом калия в серной кислоте образуется пропионовая кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-1: |
Видео:Проклятая химическая реакция 😜 #shortsСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-1 образуется пропаналь. |
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Получение пропанола-1
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 1-хлорпропана с водным раствором гидроксида натрия образуется пропанол-1 |
Видео:Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты.
🎥 Видео
Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать