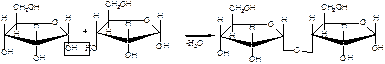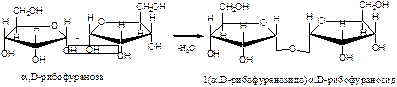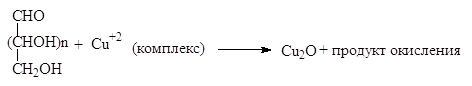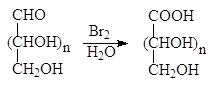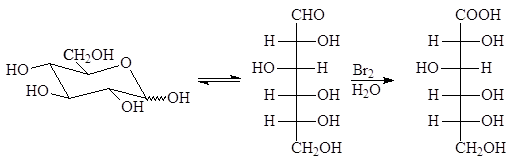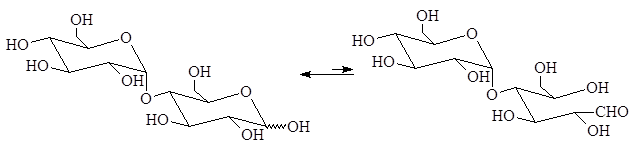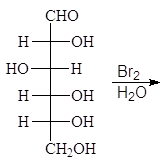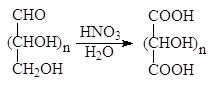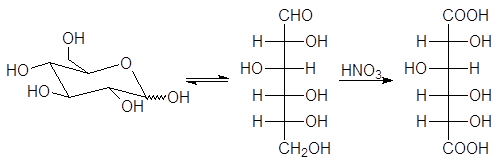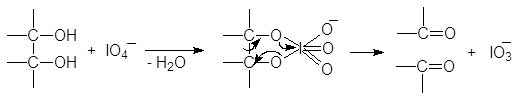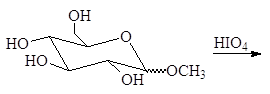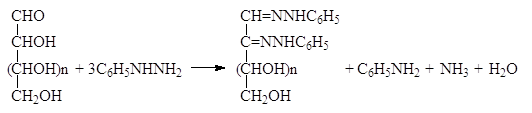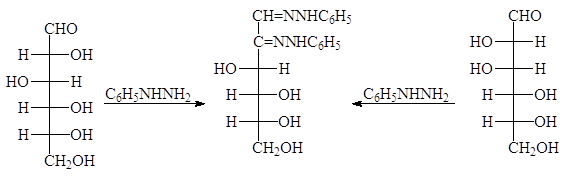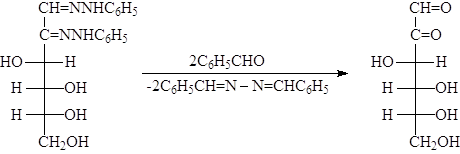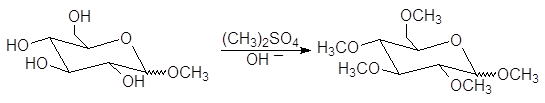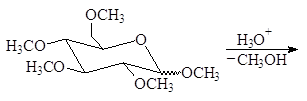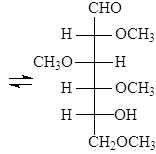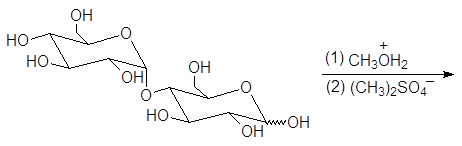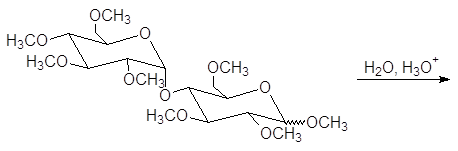Решение:
В реакцию окисления (реакция «серебряного зеркала») вступает открытая форма D-рибозы, при этом окисление идет по альдегидной группе с образованием альдоновой кислоты:
D-рибоза D-рибоновая кислота
Название кислоты – замена альд на корень соответствующей монозы, поэтому — рибоновая кислота.
В более жестких условиях, например при взаимодействии с таким окислителем, как азотная кислота, окисление происходит по альдегидной и по первичной гидроксильной группе. В результате образуется аровая (сахарная) кислота:
D-рибоза D-рибоаровая кислота (корень монозы + аровая кислота).
Во взаимодействие со спиртами вступает циклическая форма углевода. В этой реакции углеводы проявляют свойства многоатомных спиртов. Полуацетальный гидроксил наиболее активен и при взаимодействии со спиртами дает полуацетали, которые в классе углеводов называются гликозидами:


1. Напишите уравнения образования восстанавливающего и невосстанавливающего дисахарида из двух молекул 
Решение:
Восстанавливающий дисахарид образуется за счет полуацетального гидроксила одной молекулы монозы и любого другого спиртового гидроксила (гликозид-гликозная связь) другой молекулы:



3( 

В полученном дисахариде остается один свободный полуацетальный гидроксил, за счет которого в водных растворах возможно существование таутомерных форм, т.е. восстанавливающий дисахарид в водном растворе мутаротирует.
Невосстанавливающий дисахарид образуется в результате взаимодействия полуацетальных гидроксилов двух молекул моноз (гликозид-гликозидная связь):
В полученном дисахариде отсутствует полуацетальный гидроксил, поэтому углевод в водном растворе не образует таутомерных форм (не мутаротирует). Такие дисахариды проявляют свойства только многоатомных спирт.
РАЗДЕЛ 5. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Амины. Аминокислоты
Литература
1. Иванов, В.Г. Органическая химия: учеб. пособие для вузов / В.Г. Иванов, В.А. Горленко. – М.: Издательский центр «Академия», 2009. -С. 255-262, 426-442, 275-285.
2. Грандберг, И.И. Органическая химия: учеб. для вузов / И.И. Грандберг. — М.: Дрофа, 2002. -С. 314-329, 484-508.
3. Артеменко, А.И. Органическая химия: учеб. для вузов / А.И. Артеменко. — М.: Высшая школа, 2009. -С. 248-251, 274-280, 375-386.
4. Денисов, В.Я. Органическая химия: учеб. для студентов вузов, обучающихся по направлению подготовки и специальности «Химия»/ В.Я. Денисов, Д.Л. Мурышкин, Т.В. Чуйкова. – М.: Высшая школа, 2009, -С. 163-170,329-345, 196-201.
5. Петров, А.А. Органическая химия: учеб. для вузов / А.А. Петров. — С-Пб.: Иван Федоров, 2002. -С. 226-233, 384-396, 286-293.
Основные вопросы по данной теме в достаточном объеме освещены в рекомендуемых учебниках. Однако объем материала по ароматическим аминам выходит за рамки программы по дисциплине, поэтому необходимо отбирать материал в соответствии с программой и методическими рекомендациями. Подробно электронное и пространственное строение аминов, механизмы различных типов реакций рассмотрены в учебнике [4], в учебниках [1-3,5] материал изложен систематично и более кратко. При изучении аминокислот лучше использовать учебники [1,2], где материал представлен в компактной форме.
Амины можно рассматривать как производные аммиака (NH3), в молекуле которого атомы водорода замещены на радикалы алифатического (R-) или ароматического (Ar-) ряда: R–NН2 и Ar–NH2 – первичные амины, (R)2NH и (Ar)2NH – вторичные амины, (R)3N и (Ar)3N – третичные амины.
При изучении аминов следует обратить внимание на номенклатуру. Для данных соединений более характерны названия, построенные по радикально-функциональной, а не по заместительной номенклатуре. Для ароматических аминов широко представлены тривиальные названия, некоторые следует запомнить — анилин, толуидины и т.д.
При изучении строения аминов следует обратить внимание на различия в строении алифатических и ароматических аминов (см. «Электронные эффекты»).
При изучении химических свойств аминов прежде всего следует рассмотреть основные свойства, которые обусловлены свободной парой электронов на атоме азота аминогруппы. Поэтому амины могут реагировать с кислотами, образуя соли аммония, которые неустойчивы, особенно в ароматическом ряду, и способны разлагаться в присутствии гидроксидов металлов:
Основные свойства аминов зависят от количества и природы радикалов.
Необходимо подробно рассмотреть реакции алкилирования, ацилирования, в которых амины проявляют нуклеофильные свойства, причем более выраженные в алифатических аминах.
Студенту следует обратить внимание на отношение аминов различных типов к азотистой кислоте, так как эта реакция является характерной для них и дает возможность определять природу амина.
Необходимо рассмотреть характерные для ароматических аминов реакции электрофильного замещения, протекающие по бензольному кольцу.
При изучении способов получения аминов следует обратить внимание на реакции Гофмана и Зимина.
Аминокислоты – гетерофункциональные соединения, в составе которых присутствуют амино — и карбоксильная группы. В водных растворах аминокислоты существуют в виде внутренней соли, образуемой в результате внутримолекулярного взаимодействия обеих функциональных групп.
При изучении аминокислот следует обратить внимание на оптическую изомерию (D, L –конфигурации).
Необходимо запомнить тривиальные названия некоторых аминокислот (глицин, аланин и т.д). При изучении химических свойств кислот следует отметить сходство аминокислот с карбоновыми кислотами (образование солей, сложных эфиров, галогенангидридов), а также с аминами (образование солей, алкилирование, ацилирование, взаимодействие с азотистой кислотой). Необходимо обратить внимание на образование пептидных связей.
При рассмотрении полипептидов более подробно следует рассмотреть белки. Если выделить повторяющееся звено в полипептидной цепи, то таким образом можно определить общую формулу первичной структуры молекулы белка:
Поскольку белки построены из молекул α-аминокислот, то по химическим свойствам они подобныаминокислотам. Белки обладают амфотерными свойствами. Существуют качественные реакции, определяющие особенности в строении молекулы белка. Для белков характерно явление осаждения: обратимое осаждение или высаливание, необратимое осаждение или денатурация.
Контрольные вопросы и упражнения:
1. Среди представленных соединений, формулы которых приведены ниже, укажите амины:
ж) 
Определите первичные, вторичные, третичные амины алифатического и ароматического ряда. Назовите амины.
2. Приведите структурные формулы всех изомерных аминов состава C4H11N. Назовите структурные изомеры.
3. Напишите уравнения реакций соляной кислоты с анилином, метиламином. Назовите полученные соединения. Сравните основные свойства указанных аминов и аммиака
4.Представьте формулы биполярных ионов лизина (α, ε – диаминокапроновая кислота), глицина, аминомалоновой кислоты. Рассмотрите поведение ионов в кислой и щелочной средах.
5. Напишите уравнение образования дипептида из глицина (аминоуксусная кислота). Назовите полученное соединение.
- Уравнения реакций окисления d рибозы
- Как написать хороший ответ?
- Реакции углеводов
- Альдегидные группы альдоз вступают в обычные реакции карбонильной группы и реагируют с гидроксиламином и фенилгидразином. Если с гидроксиламином при этом образуются оксимы, то в случае избытка фенилгидразина образуются озазоны.
- 📽️ Видео
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Уравнения реакций окисления d рибозы
Вопрос по химии:
Напишите уравнения реакций и структурные формулы реакций окисления и восстановления рибозы
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Реакции углеводов
| Реклама от Google |
| Доступные действия |
|
|
1. Реакции углеводов
1.2.1. Действие реагентов Бенедикта, Феллинга и Толленса
1.2.2. Окисление альдоз бромной водой
1.2.3. Окисление азотной кислотой
1.2.4. Окисление периодной кислотой
1.3. Реакции с фенилгидразином
2. Образование простых эфиров
В живой природе широко распространены вещества, многим из которых соответствует формула Сх(Н2О)у. Они представляют собой, таким образом, как бы гидраты углерода, что и обусловило их название – углеводы. К углеводам относится обычный сахар – сахароза, виноградный сахар – глюкоза, фруктовый сахар – фруктоза и молочный сахар – мальтоза. Этим объясняется еще одно их общепринятое название сахара. Растения синтезируют углеводы из двуокиси углерода и воды в процессе фотосинтеза. При этом солнечная энергия переходит в химическую:
При окислении углеводов в организме энергия высвобождается и используется для жизнедеятельности:
1. Реакции углеводов
Химические свойства углеводов определяются карбонильной группой, гидроксильными группами и кольчато-цепной таутомерией. Реакции по карбонильной группе протекают с ациклическими структурами, а реакции по гидроксильным группам – с циклической формой.
При восстановлении карбонильной группы моноз тетрагидроборатом натрия или гидрированием в присутствии платины образуются многоатомные спирты:
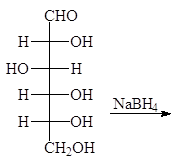 |  |
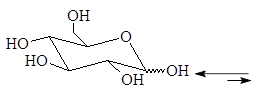 |
Упр. 16. При восстановлении D-маннозы тетрагидроборатом натрия образуется D-маннит. Напишите эту реакцию.
Упр. 17. При восстановлении D-фруктозы тетрагидроборатом натрия образуется два продукта. Напишите эту реакцию и назовите образующиеся продукты.
5.
Для идентификации функциональных групп углеводов или с целью получения других соединений используются различные окислитекли. Наиболее важными из них являются (1) реагенты Бенедикта и Толленса, (2) бромная вода, (3) азотная кислота и (4) периодная кислота.
1.2.1 Действие реагентов Бенедикта, Феллинга и Толленса
Реактив Бенедикта (щелочной раствор цитрата двухвалентной меди), реактив Феллинга (тартрат меди) и реактив Толленса (аммиачная окись серебра) дают положительную реакцию (окисляют) альдозы и кетозы, несмотря на то, что они существуют в основном в циклической форме. При действии на альдозы реактивов Бенедикта и Феллинга образуется осадок кирпичного цвета. В щелочной среде кетозы превращаются сначала в альдозы, а затем окисляются.
Сахара, дающие положительную реакцию на эти реактивы, называют восстанавливающими сахарами, а не дающие – невосстанавливающими. Мальтоза, целлобиоза и лактоза дают положительную реакцию на эти реактивы, а сахароза — не дает.
Упр. 18. Как можно отличить глюкозу от метилглюкозида?
 |
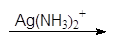 |
1.3.2. Окисление альдоз бромной водой
При окислении альдоз такими слабыми окислителями как бромная вода, окислению подвергается только альдегидная группа и образуются альдоновые кислоты.
альдоза альдоновая кислота
Восстанавливающие дисахариды (мальтоза целлобиоза и лактоза также окисляются бромной водой.
мальтоновая кислота
8.
1.2.3. Окисление азотной кислотой
Разбавленная азотная кислота, являющаяся более сильным окислителем, чем бромная вода, окисляет не только альдегидную группу, но и терминальную спиртовую группу в карбоксильную. Образующиеся при этом полигидроксидикарбоновые кислоты называют альдаровыми кислотами.
альдаровая кислота
Альдаровую кислоту, получаемую из D-глюкозы, называют D-глюкаровой кислотой.
D-глюкоза D-глюкаровая кислота
Упр. 19. Окисление D-маннозы азотной кислотой приводит к образованию маннаровой кислоты. Напишите эту реакцию.
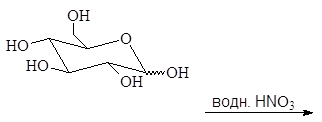 |
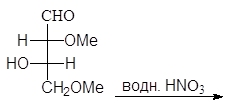 |
1.2.4. Окисление периодной кислотой.
При изучении спиртов (12.3.2.2) мы видели, что периодная или метаиодная кислота окисляет гликоли с разрывом углерод-углеродной связи. Метаиодная кислота растворима в воде; ее обычно генерируют, добавляя метаперйодат калия (или натрия) к подкисленному водному раствору диола. Реакция проходит по следующему механизму:
Следует заметить, что при этом окислении вместо разорванной С¾С-связи у каждого из атомов углерода появляется связь С¾О. Если в молекуле рядом с гидроксильной группой имеется две другие гидроксильные группы, то образуется муравьиная кислота. По составу и соотношению образующихся продуктов окисления можно судить о строении исследуемого вещества. Напиример, периодатное окисление глицерина приводит к образованию двух мольэквивалентов формальдегида и одного муравьиной кислоты.
Периодатное окисление глицеринового альдегида приводит к образованию двух мольэквивалентов муравьиной кислоты и одного формальдегида, а его изомера дигидроксиацетона — двух мольэквивалентов формальдегида и одного диоксида углерода.
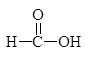 | |||
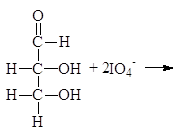 | |||
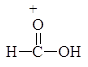 | |||
 | |||
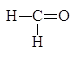 | |||
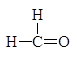 | |||
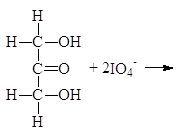 | |||
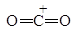 | |||
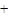 | |||
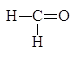 | |||
дигидроксиацетон
Упр. 20. Какие продукты и в каком соотношении образуются при периодатном окислении (а) 2,3-бутандиола, (б) 1,2-бутандиола, (в) 1,2,3-бутантриола, (г) D-глюкозы, (д) D-фруктозы, (е) D-рибозы, (ж) D-арабинозы, (з) 2-дезокси-D-рибозы.
Упр. 21. Какие продукты образуются при окислении глюкозы бромной водой и азотной кислотой?
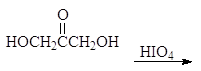 | |
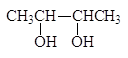 | 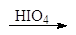 |
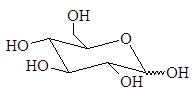 |
 |
1.3. Реакции с фенилгидразином
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Альдегидные группы альдоз вступают в обычные реакции карбонильной группы и реагируют с гидроксиламином и фенилгидразином. Если с гидроксиламином при этом образуются оксимы, то в случае избытка фенилгидразина образуются озазоны.
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Образование озазона приводит к потере одного стереоцентра, но не затрагивает остальных, поэтому D-глюкоза и D-манноза образуют один и тот же озазон:
Упр. 22. Фруктоза дает тот же фенилозазон, что и D-глюкоза и D-манноза. Напишите реакцию D-фруктозы с избытком фенилгидразина.
Озазоны представляют собой легко очищаемые кристаллизацией вещества желтого цвета. При действии соляной кислоты озазоны гидролизуются с образованием озонов. Однако в большинстве случаев используется расщепление озазонов при нагревании с бензальдегидом. Эта реакция точно также приводит к образованию озонов, но протекает с лучшими выходами, поскольку при этом одновременно связывается высвобождающийся фенилгидразин:
При взаимодействии озонов с амальгаммой натрия в слабокислых растворах протекает селективное восстановление альдегидной группы до первичной спиртовой группы. Таким методом можно осуществлять переход от альдоз через озазоны и озоны к кетозам.
2. Образование простых эфиров
При действии на алкилгликозиды алкилгалогенидов или диалкилсульфатов в щелочной среде образуются пентаалкильные производные:
Процесс называется исчерпывающим алкилированием. Метоксигруппы при С-2, С-3, С-4 и С-6 пентаметилглюкопиранозида являются обычными эфирными группами. Эти группы устойчивы в слабокислых водных растворах. В то же время метоксигруппа при С-1 отличается от других тем, что она является ацетальной (гликозидной). Поэтому при гидролизе в слабокислом растворе отщеплению подвергается лишь гликозидная группа:
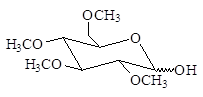
Метилирование мальтозы с последующим гидролизом приводит к образованию 2,3,4,6-тетра-О-метил-D-глюкозы и 2,3,6-три-О-метил-D-глюкозы:
Упр. 23. Напишите реакции взаимодействия D-глюкозы а) с этанолом в присутствии сухого хлороводорода и (б) с диметилсульфатом. Продукт реакции
📽️ Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Уравнивание реакций горения углеводородовСкачать

Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Что такое рибоза и дезоксирибоза? Душкин объяснитСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Окислительно-восстановительные реакции/классификация химических реакцийСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений реакций горения. 11 класс.Скачать

Биохимия. Лекция 49. Углеводы. Гликолиз. Челночные системы. Обезвреживание этанола.Скачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать