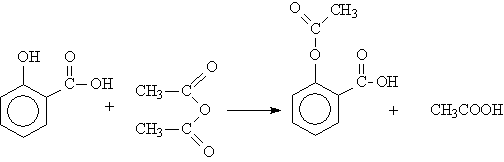
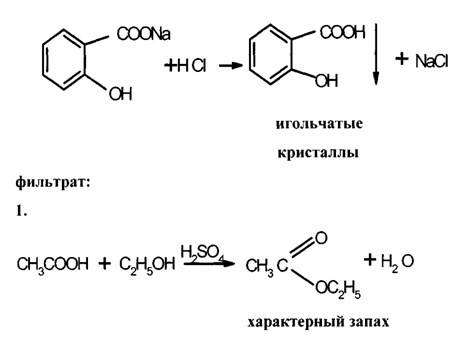
АЦЕТИЛСАЛИЦИЛОВАЯ (2-(АЦЕТИЛОКСИ)-БЕНЗОЙНАЯ) КИСЛОТА – белое кристаллическое вещество, малорастворимое в воде, хорошо растворимо в спирте, в растворах щелочей. Это вещество получают взаимодействием салициловой кислоты с уксусным ангидридом:
Ацетилсалициловая кислота уже более 100 лет широко применяется как лекарственное средство – жаропонижающее, обезболивающее и противовоспалительное. Существует более 50 названий – торговых марок препаратов, основным действующим началом которых является это вещество. Это необычное лекарственное средство можно назвать рекордсменом среди лекарств. Ацетилсалициловая кислота – долгожитель в мире лекарств, в 1999 официально отметила свой столетний юбилей, и до сих пор это самое популярное лекарство в мире. Ежегодное потребление лекарственных препаратов содержащих ацетилсалициловую кислоту превышает 40 млрд. таблеток.
Еще одна особенность ацетилсалициловой кислоты – это первое синтетическое лекарственное вещество. Человек испокон веков использовал лечебные растения, затем научился выделять из экстрактов растений лекарственные вещества в чистом виде, но первым лекарством, полного аналога которому не существует в природе, стала ацетилсалициловая кислота.
В природе есть похожее вещество – салициловая кислота. Это соединение содержится в коре ивы, и его целебные свойства были известны с древности. Отвар коры ивы как жаропонижающее, обезболивающее и противовоспалительное средство рекомендовал применять еще Гиппократ. В 1828 немецкий химик Бюхнер из коры ивы выделил вещество, которое назвал салицин (от латинского названия ивы – Salix). Чуть позже из салицина была получена чистая салициловая кислота, и доказано, что она обладает лечебными свойствами. Салицин, выделенный из ивовой коры – отхода от производства корзин, использовали в качестве лекарственного средства, однако он производился в очень небольших количествах, и был дорог. В 1860 немецкий химик А.Кольбе разработал метод синтеза салициловой кислоты взаимодействием фенолята натрия с углекислым газом, и вскоре в Германии появился завод по производству этого вещества:
И салицин, и более дешевая синтетическая салициловая кислота использовались в медицинской практике, но широкого распространения как лекарственное средство для внутреннего применения салициловая кислота не получила. Из-за высокой кислотности она вызывает сильное раздражение слизистой рта, горла, желудка, а ее соли – салицилаты – обладают таким вкусом, что большинство пациентов от них тошнило.
Новое лекарство, обладающее теми же терапевтическими свойствами, но менее выраженными побочными эффектами, что и салициловая кислота, было открыто и запатентовано немецкой фирмой «Bayer». По официальной версии отец химика Феликса Хоффмана, работавшего в фирме, страдал ревматизмом, и любящий сын задался целью получить вещество, которое облегчило бы страдания отца-ревматика, но обладало бы более приятным вкусом, чем салицилаты и не вызывало бы болей в желудке. В 1893 он обнаружил искомые свойства у ацетилсалициловой кислоты, впервые полученной из салициловой кислоты сорока годами ранее, но не нашедшей применения. Хоффман разработал методику получения чистой ацетилсалициловой кислоты, и после испытаний препарата на животных (кстати, они проводились тоже впервые в истории) в 1899 фирма «Bayer» запатентовала торговую марку аспирин – имя, под которым наиболее известно это лекарство. Считается, что название лекарству дали в честь святого Аспиринуса – покровителя всех страдающих головной болью, хотя есть и более прозаичное объяснение. Салициловую кислоту в то время часто называли spirsaeure, поскольку она содержится также в болотном растении таволге (spiraea). И фирменное название просто является сокращением от принятого в то время названия ацетилсалициловой кислоты acetylspirsaeure. Кстати, салициловая кислота тоже нашла свое место в медицине, ее раствор – салициловый спирт лечит кожные воспалительные процессы и входит в состав многих косметических лосьонов.
Ацетилсалициловая кислота понижает температуру, уменьшает местные воспалительные процессы, обезболивает. А еще разжижает кровь и поэтому применяется при опасности возникновения кровяных тромбов. Доказано, что длительный прием небольшой дозы ацетилсалициловой кислоты людьми, склонными к заболеваниям сердечно-сосудистой системы, значительно снижает риск инсульта и инфаркта миокарда. При этом препарат абсолютно лишен страшного недостатка многих обезболивающих средств – к нему не развивается пристрастие. Казалось бы, идеальное лекарственное средство. Некоторые люди настолько привыкли к этому препарату, что принимают его по поводу и без повода – при малейшей боли или просто «на всякий случай».
Но ни в коем случае нельзя забывать, что лекарственными средствами, нельзя злоупотреблять. Как и любое лекарственное средство, ацетилсалициловая кислота небезопасна. Передозировка может привести к отравлению, проявляющемуся тошнотой, рвотой, болями в желудке, головокружением, а в тяжелых случаях – к токсическому воспалению печени и почек, поражению центральной нервной системы (расстройство координации движений, помрачение сознания, судороги) и кровоизлияниям.
Если человек принимает одновременно несколько лекарств, нужно быть особенно осторожным. Некоторые лекарства несовместимы друг с другом, и из-за этого могут произойти отравления. Ацетилсалициловая кислота увеличивает токсические эффекты сульфаниламидов, усиливает действие таких обезболивающих и противовоспалительных средств, как амидопирин, бутадион, анальгин.
Есть у этого лекарства и побочные эффекты. Так же, как и салициловая кислота, хотя и в значительно меньшей степени, оно приводит к раздражению слизистых оболочек желудка. Во избежание негативного воздействия на желудочно-кишечный тракт рекомендуется употреблять это лекарство после еды, запивая большим количеством жидкости. Раздражающее действие ацетилсалициловой кислоты усиливает винный спирт.
Во многом раздражающее действие аспирина проявляется из-за его плохой растворимости. Если глотать таблетку, она медленно усваивается, нерастворенная частичка вещества может на какое-то время «прилепиться» к слизистой оболочке, вызывая ее раздражение. Чтобы уменьшить этот эффект, достаточно просто растолочь таблетку аспирина в порошок и запить его водой, иногда рекомендуют для этой цели щелочную минеральную воду, или купить растворимые формы аспирина – шипучие таблетки. Однако следует иметь в виду, что эти меры не снижают риск развития желудочно-кишечных кровотечений из-за действия препарата на синтез «защитных» простагландинов в слизистой желудка. Поэтому ацетилсалициловой кислотой лучше не злоупотреблять, особенно людям, больным гастритом или язвой желудка.
Иногда может быть нежелателен или даже опасен эффект уменьшения свертываемости крови. В частности, препараты, содержащие ацетилсалициловую кислоту, не рекомендуется принимать в течение недели перед хирургическим вмешательством, так как она повышает риск нежелательного кровотечения. Не стоит без крайней необходимости принимать препараты ацетилсалициловой кислоты беременным женщинам и маленьким детям.
Несмотря на то, что ацетилсалициловая кислота так давно известна и очень широко применима в качестве лекарственного средства, объяснение механизма ее действия на организм появилось лишь в 1970-х. Британский ученый Дж.Вейн за свои работы по изучению физиологического действия ацетилсалициловой кислоты в 1982 получил Нобелевскую премию по физиологии и медицине и титул рыцаря от королевы Елизаветы II. Вейн обнаружил, что ацетилсалициловая кислота блокирует в организме синтез некоторых гормоноподобных веществ – простагландинов, ответственных за регуляцию многих функций организма, в частности, тормозит синтез простагландинов, вызывающих воспалительные явления. Побочные действия ацетилсалициловой кислоты объясняются замедлением синтеза других простагландинов, ответственных за свертываемость крови и регуляцию образования в желудке соляной кислоты.
Дальнейшие исследования показал, что далеко не все свойства данного вещества связаны с блокировкой синтеза простагландинов. Механизм действия ацетилсалициловой кислоты сложен и не до конца изучен, и ее свойства до сих пор являются объектом исследования многих научных коллективов. Только в 2003 было опубликовано около 4000 научных статей, посвященных тонкостям физиологического действия этого вещества. Ученые, с одной стороны, находят новые применения старому лекарству – например, недавние исследования выявили механизм влияния ацетилсалициловой кислоты на снижение уровня сахара в крови, что важно для больных диабетом. С другой стороны, на основе исследований разрабатываются новые лекарственные препараты ацетилсалициловой кислоты, побочные эффекты которых сведены к минимуму. Очевидно, ацетилсалициловая кислота обеспечит работой еще не одно поколение ученых – физиологов и фармацевтов.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Исследовательская работа по химии на тему «Аспирин и его свойства»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
муниципальное образовательное учреждение
средняя общеобразовательная школа № 29
Тракторозаводского района г. Волгограда
им. В.И. Вернадского
«Изучение свойств аспирина и его влияние на организм человека».
обучающиеся 11 класса
учитель химии МОУ СОШ №29
Травина Мария Евгеньевна.
ГЛАВА 1. Обзор литературы___________________________________5
1.1. История создания аспирина_________________________ ________5
1.2. Фармакологическое действие аспирина ______________________ 8
1.3. Химические свойства ацетилсалициловой кислоты ____________10
ГЛАВА 2. Экспериментальная часть____________________________12
2.1. Изучение растворимости аспирина в воде ____________________12
2.2. Определение рН растворов, содержащих ацетилсалициловую кислоту _________________________________________________________13
2.3. Определение растворимости аспирина в этиловом спирте______14
2.4. Определение фенолпроизводного в растворе _________________15
2.5. Изучение влияния аспирина на рост плесневых грибков ______16
Ацетилсалициловая кислота — это одно из самых известных и широко применяемых лекарственных средств в мире. Существует более 50 названий – торговых марок препаратов, основным действующим началом которых является это вещество. Ежегодно в мире употребляется свыше 40 000 тонн аспирина. Это необычное лекарственное средство можно назвать рекордсменом среди медикаментов. Ацетилсалициловая кислота – долгожитель в мире лекарств, в 1999 официально отметила свой столетний юбилей, и до сих пор это самый популярный медицинский препарат в мире.
Практически каждый человек хотя бы один раз в жизни применял данное лекарство. Изначально этот препарат предназначался для снижения температуры тела, затем нашли еще несколько эффектов: таких как обезболивающее, разжижающее кровь, противовоспалительное.
Несомненно, ацетилсалициловая кислота в жизни человека играет большую роль. Но в тоже время, существует впечатляющий список побочных действий на организм человека, которые возникают при приеме ацетилсалициловой кислоты. Проблема использования лекарственных препаратов заключается в разумности и грамотности их применения.
Объект исследования: лекарственные препараты, содержащие ацетилсалициловую кислоту.
Предмет исследования: физико-химические и фармакологические свойства аспирина.
изучить характерные физические и химические свойства, механизм действия и способы безопасного применения лекарственных препаратов, содержащих ацетилсалициловую кислоту.
Для осуществления поставленной цели были сформулированы следующие задачи:
ознакомиться с литературой, содержащей информацию об ацетилсалициловой кислоте;
провести химические эксперименты, доказывающие свойства ацетилсалициловой кислоты;
выяснить влияние ацетилсалициловой кислоты на организм человека;
опытно-экспериментальным путем проверить подавление роста плесневых грибков на продуктах питания с помощью ацетилсалициловой кислоты.
Глава 1. Обзор литературы.
1.1. История создания аспирина.
История препарата Аспирин — одна из самых продолжительных и красивых в фармакологии. Еще 2500–3500 лет назад, в древнем Египте и Риме, были известны целебные свойства ивовой коры, естественного источника салицилатов, как жаропонижающего и болеутоляющего средства. На папирусах, датируемых ІІ тысячелетием до н.э., найденных немецким египтологом Георгом Эберсом среди других 877 медицинских рецептов, описаны рекомендации по использованию листьев мирта (также содержащих салициловую кислоту) при ревматической боли и радикулите. Около тысячи лет спустя отец медицины Гиппократ в своих наставлениях рекомендовал использовать ивовую кору в виде отвара при лихорадке и родовых муках. В середине ХVIII в. преподобный Эдмунд Стоун, сельский викарий из Оксфордшира, представил президенту Лондонского королевского общества отчет об исцелении лихорадки ивовой корой. Часто для обезболивания отвар коры ивы применяли в сочетании с настойкой мака. В таком виде его использовали вплоть до середины XIX в., когда развитие химии позволило начать серьезные исследования состава лекарственных средств из растительного сырья.
Так, в 1828 году профессор химии Мюнхенского университета Йоган Бюхнер выделил из коры ивы активную субстанцию — горький на вкус гликозид, названный им салицин (от лат. Salix — ива). Вещество оказывало жаропонижающее действие и при гидролизе давало глюкозу и салициловый спирт.
В 1829 году французский аптекарь Анри Леруа произвел гидролиз салицилового спирта. В 1838 году итальянский химик Рафаэль Пириа разделил салицин на две части, выявив, что лечебными свойствами обладает его кислая составляющая. По сути, это была первая очистка субстанции для дальнейшей разработки препарата.
В 1859 году профессор химии Герман Кольбе из Марбургского университета раскрыл химическую структуру салициловой кислоты, что позволило открыть первую фабрику по ее производству в Дрездене в 1874 году.
Однако все существующие на то время терапевтические средства из коры ивы обладали очень серьезным побочным эффектом — они вызывали сильную боль в животе и тошноту.
В 1853 году французский химик Шарль Фредерик Жерар в ходе опытов нашел способ ацетилирования салициловой кислоты, однако не довел работу до конца. А в 1875 году для лечения ревматизма и в качестве жаропонижающего средства был применен салицилат натрия.
Огромная популярность салицилата натрия пробудила немецкого химика Феликса Хоффмана, работавшего на предприятии «Байер», в 1897 году продолжить исследования Ш.Ф. Жерара. В сотрудничестве со своим руководителем Генрихом Дресером на основании работ французского химика он разработал новый метод получения ацетилированной формы салициловой кислоты — ацетилсалициловую кислоту, которая обладала все теми же терапевтическими свойствами, но гораздо лучше переносилась больными. Это открытие вполне можно назвать фундаментом создания препарата.
Для оценки безопасности полученного препарата были проведены первые в мировой истории доклинические экспериментальные исследования на животных. Таким образом, изучение фармакологических свойств препарата стало началом клинических исследований лекарственных средств, которые с конца ХХ в. стали краеугольным камнем доказательной медицины.
Исследования завершились успешно — была доказана хорошая противовоспалительная активность препарата и он был рекомендован для терапевтического применения.
6 марта 1899 года, когда новое лекарственное средство было запатентовано в Кайзеровском патентном ведомстве, стало днем рождения препарата Аспирин.
В основе торгового наименования лежит латинское название растения — разновидности ивы таволги (Spiraea), из которой получали салицилаты для производства препарата.
27 февраля 1900 года Ф. Хоффман получил патент на свое изобретение ацетилсалициловой кислоты в США.
Более чем за 100 лет своего активного медицинского применения Аспирин не только не потерял своей актуальности, но и расширил сферу применения в таких разнообразных областях, как устранение боли, симптомов простуды, а также в профилактике сердечно-сосудистых заболеваний.
Видео:8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать

Лекция 19. Ароматические кислоты и их производные
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Видео:Это Знают Только Врачи! Как Ацетилсалициловая Кислота (Аспирин) Влияет на Кровь, Тромбозы, Вирусы...Скачать

Ароматические кислоты и их производные.
Ароматические кислоты – производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. В качестве лекарственных веществ и исходных продуктов их синтеза наибольшее значение имеют бензойная кислота и кислота салициловая (фенолокислота):
Наличие ароматического ядра в молекуле усиливает кислые свойства вещества. Константа диссоциации у бензойной кислоты имеет несколько меньшее значение ( К=6,3·10 -5 ), чем у уксусной (К=1,8·10 -5 ). Аналогичными химическими свойствами обладает и салициловая кислота, однако присутствие фенольного гидроксила в ее молекуле повышает константу диссоциации до 1,06·10 -3 и расширяет число аналитических реакций, которые могут быть использованы для качественного о количественного анализа. Бензойная и салициловая кислоты при взаимодействии со щелочами образуют соли.
Ароматические кислоты так же, как и неорганические или алифатические, проявляют антисептическое действие. Они могут оказывать на ткани также раздражающее и прижигающее действие, связанное с образованием альбуминатов. Фармакологический эффект зависит от степени диссоциации кислоты.
Натриевые соли бензойной и салициловой кислот в отличие от самих кислот легко растворимы в воде. В водных растворах они ведут себя как соли сильных оснований и слабых кислот. Фармакологическое действие солей и самих кислот одинаково, однако из-за большей растворимости раздражающее действие их ниже.
Бензойная кислота-Acidum benzoicum
Натрия бензоат-Natrii benzoicum
Свойства. Бензойная кислота – бесцветные игольчатые кристаллы или белый мелкокристаллический порошок с т.пл. 122-124,5°C. Бензоат натрия – белый мелкокристаллический порошок без запаха или с очень слабым запахом, сладко-соленого вкуса. Температура плавления не определяется.
Получение.
1. Окисление толуола перманганатом калия, двуокисью марганца, бихроматом калия.
2. Парофазный каталитический процесс окисления кислородом воздуха толуола до бензойной кислоты.
3. Декарбоксилирование фталевой кислоты до бензойной.
Подлинность. Из реакций подлинности специфичной для бензойной кислоты и ее солей является реакция образования комплексной соли телесного цвета при взаимодействии ее с раствором FeCl3. Для этого бензойную кислоту нейтрализуют щелочью по индикатору и затем добавляют несколько капель раствора Fe Cl3:
Необходимым условием проведения этой реакции является получение нейтральной натриевой соли бензойной кислоты, так как в кислой среде осадок комплексной соли будет растворяться, при избытке щелочи будет выпадать бурый осадок гидроокиси железа (III).
При действии на бензойную кислоту перекиси водорода в присутствии катализатора сульфата железа (II) она превращается в салициловую кислоту, которая может быть обнаружена по фиолетовому окрашиванию с раствором FeCl3:
В качестве одной из примесей в препарате может быть продукт неполного хлорирования исходного вещества синтеза (толуола), который обнаруживается по зеленому цвету пламени после внесения крупинки препарата на медной проволоке в бесцветное пламя горелки — реакция Белыитейна.
Количественное содержание препарата определяется методом нейтрализации в спиртовой среде по индикатору фенолфталеину:
Бензойная кислота применяется как слабый антисептик в мазевых основах, она действует и как отхаркивающее средство. Чаще бензойная кислота применяется в виде своей натриевой соли C6H5COONa. Введение катиона натрия уменьшает раздражающее действие бензойной кислоты и в то же время несколько уменьшает антисептическую активность препарата. Соли бензойной кислоты действуют как слабые диуретики и, подобно самой бензойной кислоте, применяются для консервации пищевых продуктов.
Бензойная кислота летуча, поэтому хранить ее следует в хорошо закупоренных склянках.
Бензоат натрия.
Получение. Получают по реакции нейтрализации бензойной кислоты содой или щелочью:
Подлинность препарата подтверждается образованием осадка телесного цвета при действии раствора FеСl3 .
Сухой остаток после прокаливания бензоата натрия окрашивает пламя горелки в желтый цвет (реакция на Na + ). Если этот остаток растворить в воде, реакция среды оказывается щелочной на лакмус (реакция на Na + ).
Характерной (но не официнальной) реакцией на бензоат натрия является реакция с 5% раствором сульфата меди — выпадает осадок бирюзового цвета. Этой реакцией удобно пользоваться во внутриаптечном контроле как быстро выполнимой и специфичной для данного препарата.
При действии на бензоат натрия минеральной кислоты выпадает осадок бензойной кислоты, который отфильтровывается, высушивается и подтверждается определением температуры плавления (122—124,5°). Эта реакция положена в основу количественного определения препарата: бензоат натрия растворяют в воде и в присутствии эфира, извлекающего бензойную кислоту, титруют кислотой при индикаторе метиловом оранжевом.
Применяется внутрь как отхаркивающее и слабо дезинфицирующее средство. Кроме того, применяется для исследования антитоксической функции печени. Находящаяся в печени аминоуксусная кислота глицин-1 вступает в реакцию с бензойной кислотой с образованием гиппуровой кислоты, которая выделяется с мочой. По количеству выделенной гиппуровой кислоты судят о состоянии печени.
Из эфиров бензойной кислоты в медицинской практике находит применение в настоящее время бензилбензоат.
Бензилбензоат медицинский –Benzylii benzoas medicinalis.
Свойства. Бесцветная маслянистая жидкость со слегка ароматическим запахом. Острого и жгучего вкуса. Практически не растворим в воде. Смешивается в любых соотношениях со спиртом, эфиром и хлороформом. Температура кипения 316-317°C, Т.пл. 18,5-21°C. Нормативный документ ФС 42-1944-89.
Получение. Взаимодействием хлористого бензоила и бензилового спирта в присутствии оснований.
Подлинность.
1. ИК спектр.
2. УФ-Спектр.
- Спектрофотометрия.
- Газожидкостная хроматография.
Применение. В качестве противочесоточного средства, против вшей. Применяется в ряде косметических средств.
Форма выпуска: гель 20%, крем 25%, мазь 10%, эмульсия.
ФЕНОЛОКИСЛОТЫ. Кислота салициловая. Acidum salicylicum.
Из трех возможных изомеров фенолокислот только салициловая или о-оксибензойная кислота проявляет наибольшую физиологическую активность.
Сама салициловая кислота в настоящее время малоприменима, однако ее производные являются одними из самых многотоннажных лекарственных средств. Сама салициловая кислота –игольчатые кристаллы или мелкокристаллический порошок. При нагревании способна возгоняться – этот факт используется для очистки салициловой кислоты при производстве ацетилсали-циловой кислоты. При нагревании свыше 160°C дексарбоксилируется с образованием фенола.
Впервые салициловая кислота была получена окислением феноло-спирта салигенина, который был получен при гидролизе гликозида салицина, содержащегося в коре ивы. От латинского названия ивы — Salix — и произошло название «салициловая кислота»:
В эфирном масле растения Gaulteria procumbens находится метиловый эфир салициловой кислоты, омылением которого может быть также получена салициловая кислота.
Однако природные источники салициловой кислоты не могут удовлетворить потребности в ее препаратах и поэтому кислоту и ее производные получают исключительно синтетическим путем.
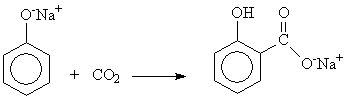
Наибольший интерес и промышленное значение имеет метод получения салициловой кислоты из фенолята натрия. Этот метод впервые применил Кольбе и усовершенствовал Р. Шмидт. Сухой фенолят натрия подвергают действию двуокиси углерода под давлением 4,5—5 атм. при температуре 120—135°. В этих условиях СО2 внедряется в молекулу фенолята в о-положение по отношению к фенольному гидроксилу:
Полученный фенолят салициловой кислоты тотчас же претерпевает внутримолекулярную перегруппировку, в результате получается натриевая соль салициловой кислоты, которая при подкислении выделяет салициловую кислоту:
Салициловая кислота проявляет одновременно свойства фенола и кислоты. Как фенол она дает типичную для фенола реакцию с раствором хлорного железа. Салициловая кислота в отличие от фенолов может растворяться не только в щелочах, но и в растворах карбонатов. При растворении в карбонатах она дает среднюю соль – салицилат натрия – применяемую в медицине:
В щелочах образуется динатриевая соль.
3.Температура плавления 158-161°C.
При наличии избытка брома происходит декарбоксилирование и образование трибромфенола. Этот метод используется также для количественного определения.
Количественное определение.
1. Методом нейтрализации в спиртовом растворе при индикаторе фенолфталеине ( фармакопейный метод).
2. Броматометрический метод.
Избыток брома определяется йодометрически.
Применение. Наружно как антисептическое и раздражающее средство.
Формы выпуска. Мази 4%, салициловой кислоты, бензойной кислоты и вазелина паста, салицилово-цинковая паста, спиртовые растворы 2%.
Хранение. В плотно закрытых склянках в защищенном от света месте.
Натрия салицилат
Natrii salicylas
Подлинность препарата.
1. По реакции с хлорным железом.
2. С реактивом Марки ( смесь серной кислоты с формалином) дает красное окрашивание.
3. Реакция окрашивания пламени на катион натрия.
4. Отстаток от сжигания дает щелочную реакцию на лакмус.
5. Образование интенсивного зеленого окрашивания с раствором медного купороса. Если к водному раствору салицилата натрия добавлять по каплям 5% раствор CuSO4, появляется интенсивное зеленое окрашивание.
Количественное определение.
1. Ацидиметрический метод прямого титрования. В качестве индикаторов используется смесь метилового оранжевого и метиленового синего.
2. Броматометрический метод.
Применение. Внутрь в порошках и таблетках в качестве болеутоляющего и противовоспалительного средства при ревматизме.Таблетки 0,25 и 0,5 г, Таблетки натрия салицилата 0,3 и кофеина 0.05 г..
Эфиры салициловой кислоты.
МЕТИЛСАЛИЦИЛАТ – Methylii salicilas
В природе встречается в эфирном масле растения Gaulteria procumbens, но в промышленности его получают синтетическим путем при нагревании салициловой кислоты с метиловым спиртом в присутствии серной кислоты. Метилсалицилат – бесцветная жидсть с ароматным запахом. Дает характерную реакцию с хлорным железом на фенолы. Для препарата определяется в качестве характеристического показателя – показатель преломления 1,535-1,538. Недопустимые примеси влага и кислота, так в этих условиях происходит гидролиз препарата.
Количественное определение. Проводят по количеству щелочи, затраченной на омыление эфира. К навеске препарата добавляют избыток титрованного раствора щелочи и нагревают, оставшуюся после омыления щелочь оттитровывают кислотой.
Применяется наружно как обезболивающее и противовоспалительное средство чаще всего в виде линиментов с хлороформом и жирными маслами.
Фенилсалицилат –Phenylii salicylas
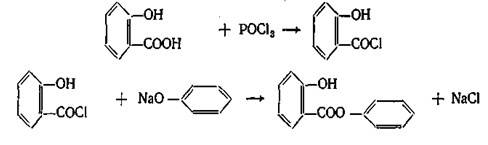
Фенилсалицилат (салол) является эфиром салициловой кислоты и фенола. Впервые он был получен М. В. Ненцким в 1886 г. Учитывая раздражающее действие салициловой кислоты, он стремился найти такой препарат, который бы, сохраняя антисептические свойства фенола, не обладал ядовитым свойством фенола и раздражающим действием кислоты. С этой целью он заблокировал карбоксильную группу в салициловой кислоте и получил эфир ее с фенолом. Исследования показали, что салол, проходя через желудок, не изменяется, а в щелочной среде кишечника омыляется с образованием натриевых солей салициловой кислоты и фенола, которые и оказывают лечебное действие. Так как омыление происходит медленно, продукты омыления салола поступают в организм постепенно и не накапливаются в больших количествах, что обеспечивает более длительное действие препарата. Этот принцип введения в организм сильнодействующих веществ в виде их сложных эфиров вошел в литературу как «принцип салола» М. В. Ненцкого и использовался в дальнейшем для синтеза многих лекарственных препаратов.
Свойства. Мелкие бесцветные кристаллы со слабым запахом. Температура плавления 42-43°C.
Получение. Фенилсалицилат получают синтетически. Наиболее распространенным и общепринятым методом является следующий:
Качественные реакции. В молекуле салола сохранилась свободная фенольная группа, поэтому реакция с раствором FeCl3 дает фиолетовое окрашивание. С реактивом Марки, подобно другим фенолам, препарат дает красноватое окрашивание.
Количественное определение.
1. Омылением с последующим титрованием избытка щелочи кислотой (фармакопейный метод).
2. Броматометрический метод.
3. Ацидиметрический по салицилату натрия. Для этого используется смесь индикаторов. Сначала до розового цвета с метиловым красным нейтрализуют избыток щелочи и фенолят и затем с метиловым оранжевым в присутствии эфира.
Форма выпуска. Таблетки 0,25 и 0,5 г., таблетки с экстрактом красавки и висмутом нитрата основным.
Применение. Антисептическое действие для лечения заболеваний кишечника.
Эфиры салициловой кислоты по ОН-группе. Кислота ацетилсалициловая –Acidum acetylsalicylicum.
о-Ацетилсалициловая кислота является природным продуктом и содержится в цветах растений вида спиреи (spiraea ulmaria). Этот эфир был введен в медицинскую практику лечения острого суставного ревматизма еще в 1874 г., а как синтетическое лекарственное вещество стал выпускаться в промышленных масштабах в конце прошлого века под названием аспирин (приставка “а” означала, что данное лекарственное вещество не добывается из спиреи, а делается химическим путем). Аспирин называют лекарством 20-го столетия. В настоящее время его производят в мире более 100 тысяч тонн в год.
Известны его противовоспалительные, жаропонижающие и болеутоляющие свойства. Обнаружено также, что он препятствует образованию тромбов, оказывает сосудорасширяющее действие и начинает применяться даже для профилактики и лечения инфарктов и инсультов. Считают, что весь потенциал лечебных свойств этого вещества еще не исчерпан. В то же время аспирин раздражает слизистую оболочку желудочно-кишечного тракта, что может вызывать кровотечения. Возможны также аллергические реакции. Аспирин в организме влияет на синтез простагландинов (контролирующих, в частности, образование тромбов) и гормона гистамина (расширяющего сосуды и вызывающего приток иммунных клеток к месту воспаления; кроме того, он может препятствовать при воспалительных процессах биосинтезу болевых веществ).
Свойства. Бесцветные кристаллы или белый порошок слабокислого вкуса. Мало растворим в воде(1:500), легко растворим в спирте.
Подлинность.
1. Омыление едким натром приводит к образованию салицилата натрия, который при обработке кислотой дает осадок салициловой кислоты.
2. По фиолетовому окрашиванию с хлорным железом после гидролиза и отщепления ацетильного фрагмента.
3. Салициловая кислота дает характерную реакцию образования ауринового красителя с реактивом Марки:
4.Температура плавления 133-136°C.
Специфической примесью, контролируемой согласно требований Фармакопейной статьи является салициловая кислота. Содержание салициловой кислоты должно быть не более 0,05%. Метод анализа спектрофотометричексий комплекса, образующегося при взаимодействии железоаммонийных квасцов с салициловой кислотой, окрашенного в синий цвет.
Количественное определение.
1. Метод нейтрализации по свободной карбоксильной группе (фармакопейный метод). Титрование проводят в спиртовой среде (во избежание гидролиза ацетильной группы), индикатор фенолфталеин.
2. Омылением с последующим титрованием избытка щелочи кислотой по метиловому оранжевому. Фактор эквивалентности равен ½.
3. Броматометрический метод.
4. ВЭЖХ в буферной среде.
Форма выпуска. Таблетки от 0,1 до 0,5 г. Известны таблетки с кишечнорастворимым покрытием, шипучие таблетки. Используется в композиционных лекарственных средствах в комбинации с кофеином, кодеином и другими веществами.
Применение – противовоспалительное, жаропонижающее, дезагрегант.
Хранение в укупоренных банках.
Ведутся работы по синтезу других производных с фрагментом салицилата. Так, получен препарат флюфенизал (11), который в четыре раза более активен, чем аспирин, по противовоспалительному действию (в ревматоидном артрите) и мягче в отношении слизистой оболочки желудка. Его получают фторсульфонированием производного дифенила (7) до соединения (8), в котором затем элиминируют SО2 в присутствии трифенилфосфинродийфторида. Образовавшийся фторид (9) гидрируют для снятия бензильной защиты, затем получают фенолят, который карбоксилируют по методу Кольбе до арилсалицилата (10). После ацилирования соединения (10) получают флюфенизал (11):
АМИДЫ САЛИЦИЛОВОЙ КИСЛОТЫ
САЛИЦИЛАМИД –Salicylamidum
Свойства. Белый кристаллический порошок с т.пл. 140-142°C.
Качественные реакции.
1.При щелочном гидролизе образуется салицилат натрия и выделяется аммиак.
2.С бромом дает дибромпроизводное.
Количественное определение проводят по выделившемуся аммиаку.
Форма выпуска. Таблетки 0,25 и 0,5 г. Жаропонижающее средство.
ОКСАФЕНАМИД Oxaphenamidum.
Свойства. Белый или белый с лиловато-серым оттенком порошок без запаха с т.пл. 175-178°C.
Получение. Сплавлением фенилсалицилата с п-аминофенолом.
Фенолы отгоняют. Оставшуюся смесь обрабатывают изопропанолом с соляной кислотой. Кристаллы отфильтровывают и перекристаллизовывают из амилового спирта.
Подлинность.
1. Спиртовый раствор дает с хлорным железом красно-фиолетовое окрашивание.
2. С соляной кислотой в присутствии резорцина образуется индофенол, дающий с едким натром красно-фиолетовое окрашивание:
1.Метод Кьельдаля
2.ВЭЖХ.
Форма выпуска. Таблетки 0,25 и 0,5 г.
Желчегонное средство (холециститы, желчекаменная болезнь).
ПРОИЗВОДНЫЕ ФЕНИЛПРОПИОНОВОЙ КИСЛОТЫ
ИБУПРОФЕН – Ibuprofenum
Бесцветные кристаллы, белый порошок, температура плавления 75-77°C, нерастворим в воде, растворим в спирте.
Нестероидное противовоспалительное средство. Препарат относительно малотоксичен, обладает выраженной противовоспалител-ной и болеутоляющей активностью, жаропонижающим действием, стимулирует образование эндогенного интерферона. Применяют для лечения ревматоидного артрита, других заболеваний суставов, для снижения температуры у больных.
Ниже приведен синтез, заключающийся в ацетилировании изобутилбензола по Фриделю-Крафтсу, получении циангидрина реакцией с цианистым натрием и восстановлении этого циангидрина под действием иодистоводородной кислоты и фосфора в п-изобутил-α-метилфенилуксусную кислоту — ибупрофен.
Подлинность.
1.УФ спектр.
2.ИК спектр
3.Осадок с хлорным железом.
4.Температура плавления субстанции 75-77°C.
Количественное определение нейтрализация спиртовым раствором едкого натра с фенолфталеином в спиртовом растворе.
Форма выпуска. Таблетки 0,2 г. покрытые оболочкой. Композиционные лекарственные формы с кодеином (нурофен) и др.
Примененние. Нестероидное противовоспалительное средство. Обладающее обезболивающим эффектом.
Среди других нестероидных противовоспалительных препаратов следует отметить следующие:
ДИКЛОФЕНАК НАТРИЯ, Ортофен, Вольтарен
Diclofenac sodium
Свойства. Белый или сероватый порошок, растворим в воде.
Препараты натрия диклофенак, мефенаминовая кислота и индометацин близки по противовоспалительному и болеутоляющему действию, последний обладает несколько более значительными эффектами в этом отношении, но первый менее токсичен и обладает лучшей переносимостью. Натрия диклофенак и мефенаминовая кислота хорошо проникает в полости суставов при ревматоидном артрите, его применяют при остром ревматизме, артрозах. Используется для купирования болей и при заболеваниях слизистой оболочки полости рта и пародонтите.
Получение.
Белый или сероватый порошок, растворим в воде. ПОДЛИННОСТЬ:
- осадок с FeCl3 – бурого цвета
- УФ спектр
- ИК спектр
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: Нейтрализация НСl. ПРИМЕНЕНИЕ:
Противовоспалительное, жаропонижающее, при ревматоидных артритах, 0,025, амп. 2,5% р-р, вольтарен-ретард 0,1.
КИСЛОТА МЕФЕНАМИНОВАЯ Acidum mephenaminicum
Кристаллический порошок серовато-белого цвета, без запаха, горького вкуса. Практически нерастворим в воде, плохо растворим в спирте.
Получение. Препарат получают конденсацией о-хлорбензойной кислоты с ксилидином в присутствии в качестве катализатора порошка меди.
Подлинность.
1.Температура плавления
2.УФ спектр
3.ИК спектр
Количественное определение.
Перевод в растворимую натриевую соль и титрование избытка едкого натра.
Форма выпуска. Таблетки 0,5 г, суспензия. Применение. Противовоспалительное, обезболивающее средство.
ГАЛОПЕРИДОЛ Haloperidolum
Галоперидол является производным 4-фторбутирофенона. Это одна из новейших групп нейролептиков с очень сильным действием
Получение. Синтез осуществляют по двум ниткам. Сначала по Фриделю-Крафтсу ацилируют фторбензол хлорангидридом γ-хлор-масляной кислоты с образованием 4-фтор- γ-хлорбутирофенона (А). Затем по схеме (В) из 4-хлорпропен-2-илбензола получают произ-водное 1,3-оксазина, которое далее в кислой среде трансформируют в 4-п-хлорфенил-1,2,5,6-тетрагидропиридин. Последний при обра-ботке бромистым водородом в уксусной кислоте превращается в 4-гидрокси-4-п-хлорфенилпиперидин (В). И, наконец, при взаимодей-ствии полупродуктов (А) и (В), получают галоперидол.
Белый или желтоватый порошок, мало растворим в воде, растворим в спирте.
ПОДЛИННОСТЬ:
1. ИК спектр
2. УФ спектр
3. Кипятят со щелочью и проводят реакцию на хлорид-ион.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ: ВЭЖХ
ПРИМЕНЕНИЕ: 0,0015 и 0,005 табл., 0,2% капли, 0,5% инъекционный р-р для купирования приступов шизофренических психозов, при белой горячке.
🔍 Видео
Загущение крови. Что делать? Почему нельзя пить Аспирин? #shortsСкачать

Получение САЛИЦИЛОВОЙ КИСЛОТЫ из АСПИРИНА. Гидролиз АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ. Опыты по химииСкачать

Правильные дозы аспиринаСкачать

АСПИРИН (ацетилсалициловая кислота) / история лекарственных препаратовСкачать

ЗАМЕНА АСПИРИНА НА КЛОПИДОГРЕЛ. В каких случаях это проводится?Скачать

Синтез АСПИРИНАСкачать

Даже рак и тромбы боятся "заменитель аспирина"! Смотрите, как с помощью питания получить аспирин в..Скачать

formation of Aspirin 🔥🔥 #shortsСкачать

Выделение салициловой кислоты из аспирина (synthesis of salicylic acid from aspirin)Скачать

Ацетилсалициловая кислота - это яд? Умереть от Аспирина? Аспирин - это безопасно или бессмысленно?Скачать

Разжижение крови, профилактика атеросклероза и тромбофлебита. Простые советы.Скачать

Аспирин. Ацетилсалициловый кислота. Польза и вред. Вопросы к врачу.Скачать

Химия - просто. Урок 1 "ПСЭ"Скачать

УСИЛЬТЕ ЛЮБОЙ ПРЕПАРАТ В 10 РАЗ и больше научным методом. Превращаем аспирин в салициловую кислоту.Скачать

Получение салициловой кислоты из ацетилсалициловой кислоты (аспирина)Скачать

Данилюк О.В. Химия 8 класс 4 четверть.Тема урока: «Кислоты»Скачать

Ацетилсалициловая кислота таблетки инструкция по применению препарата: Показания, как применятьСкачать