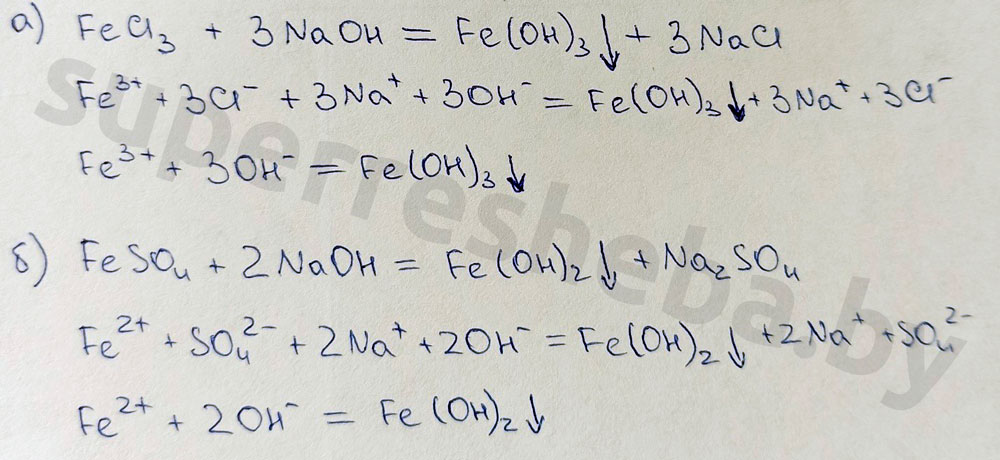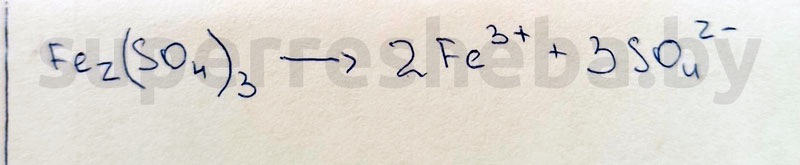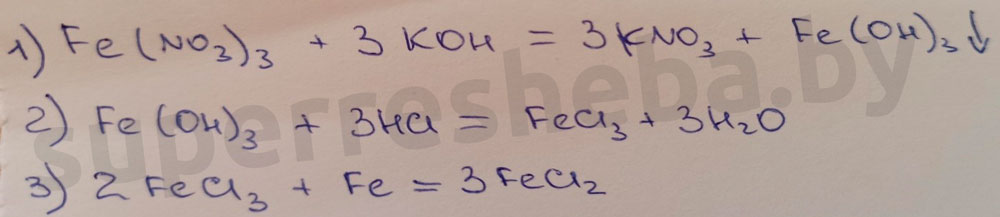а) Реакция с гексацианоферратом (II) калия — ферроцианидом калия K4[Fe(CN)6] (фармакопейная). Катионы Fe 3+ в кислой среде реагируют с ферроцианидом калия с образованием темно-синего осадка «берлинской лазури» – комплексного соединения гексацианоферрата (II) железа (III) Fe4[Fe(CN)6]3 х H2O с переменным количеством молекул воды. Показано, что в зависимости от условий осаждения, осадок «берлинской лазури», как и осадок «турнбулевой сини» (см. выше), увлекает из раствора другие катионы, так что его состав меняется и может соответствовать формуле KFe 3+ [Fe 2+ (CN)6]:
Реакция специфична. Проведению реакции мешают окислители, окисляющие реактив.
Выполнение реакции. В пробирку вносят 2-3 капли раствора соли железа (III), прибавляют 1-2 капли раствора HCI и 2 капли раствора K4[Fe(CN)6]. Раствор окрашивается в синий цвет и выпадает темно-синий осадок «берлинской лазури».
б) Реакция с тиоцианат-ионами (фармакопейная).Соли Fe 3+ образуют тиоцианат железа (III) красного цвета. Реакция проводится в кислой среде. Состав образующегося комплекса непостоянен и может в зависимости от концентрации ионов Fe 3+ и SCN — от [Fe(SCN)] 2+ до [Fe(SCN)6] 3- . Эта реакции иногда используется для обнаружения железа в комбинации с реакцией 1, с гексацианоферратом (II) калия. Сначала добавлением NH4SCN получают красный комплекс тиоцианата железа, который затем добавлением гексацианоферрата (II) калия переводят в синий осадок гексацианоферрата (II) железа (III) калия:
Чувствительность реакции 0,25мкг. Проведению реакции мешают анионы кислородных кислот (фосфорной, мышьяковой и др.), фториды, образующие соединения с Fe 3+ и NO2, дающий SCN — соединение NOSCN красного цвета.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 2-3 капли раствора тиоцианата аммония NH4NCS или калия KNCS. Раствор окрашивается в синий цвет.
в) Реакция с сульфидом натрия (фармакопейная).Сульфид натрия осаждает из нейтральных и слабощелочных растворов солей железа (III) осадок черного цвета Fe2S3:
Осадок Fe2S3 растворим в минеральных кислотах.
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 2-3 капли раствора сульфида аммония, либо сероводородной воды. Выделяется черный осадоксульфида железа (III).
г) Реакция с гидроксидами.Осадок гидроксида железа (III) Fe(OH)3, получающийся при взаимодействии Fe 3+ с гидроксид-ионами, нерастворим в растворах щелочей и поэтому по кислотно-основной классификации Fe 3+ относят к группе катионов, гидроксиды которых нерастворимы в щелочах. Осадок Fe(OH)3 растворим в разбавленных кислотах; не растворим в насыщенном растворе хлорида аммония (в отличие от белого осадка Fe(OH)2).
Выполнение реакции. В пробирку вносят 3-4 капли раствора соли железа (III) и прибавляют 3-4 капли NaOH. Выпадает красно-бурый осадок гидроксида железа (III) Fe(OH)3.
д) Реакция с сульфосалициловой кислотой (фармакопейная).Катион Fe 3+ реагирует в водных растворах с сульфосалициловой кислотой при рН ≈ 9-11,5 с образованием желтых комплексов:Fe 3+ + L 2- →[FeL3] 3- ,где L 2- — обозначение сульфосалицилат-аниона, образовавшегося из сульфосалициловой кислоты при отщеплении двух протонов предположительно от групп
–СООН и –SО3Н.
Наиболее устойчив комплекс желтого цвета, содержащий железо (III) и анионы сульфосалициловой кислоты в мольном соотношении железо (III): сульфосалицилат-анионы, равном 1:3, т.е. на один атом железа приходится три сульфосалицилатных лиганда. Этот комплекс доминирует в аммиачном растворе. Точное строение комплексов в растворе неизвестно. Чувствительность реакции 5-10мкг.
Выполнение реакции. В пробирку вносят
5 капель раствора соли железа (III), прибавляют
10 капель раствора сульфосалициловой кислоты и
0,5 мл концентрированного раствора аммиака. Раствор принимает желтую окраску.
Аналитические реакции катионов магния (II).
а) Реакция со щелочами.Растворы щелочей выделяют из растворов солей магния белый студенистый осадок гидроксида магния Mg(OH)2, легко растворимый в кислотах и растворах аммонийных солей:
Выполнение реакции.К 1—2 каплям раствора, содержащего ионы магния, прибавляют 2 — 3 капли 1М NaOH. Образуется белый студенистый осадок. Полученный осадок делим на 2 пробирки. В 1-ую пробирку прибавляем 3-4 капли HCl, осадок растворяется. Во 2-ую пробирку прибавляем 3-4 капли NH4Cl, осадок так же растворяется.
б) Реакция с гипоиодитом калия. При взаимодействии йода со щелочью образуется гипоиодит калия KIO; при этом равновесие в растворе смещается вправо и он обесцвечивается:
При добавлении соли магния ионы Mg 2+ образуют с ионами ОН — осадок Mg(OH)2, что вызывает смещение равновесия влево. Выделяющийся при это йод адсорбируется осадком Mg(OH)2 и окрашивает его в красно-бурый цвет.
Выполнение реакции.Раствор Люголя обесцвечивают прибавляя по каплям раствор КОН. К полученному бесцветному раствору прибавляют раствор соли магния. Тотчас выделяется аморфный осадок, окрашенный в красно-бурый цвет.
в) Реакция с гидрофосфатом натрия (фармакопейная).Гидрофосфат натрияобразует с ионами магния в присутствии NH3 при рН
9 белый кристаллический осадок 
При рН> 10 могут образоваться Mg(OH)2 и Mg3(PО4)2. Рекомендуется к кислому анализируемому раствору прибавлять NH3 до рН
9. Из за образования NH4C1 рН раствора поддерживается постоянным. Осадок растворяется в сильных кислотах и в уксусной кислоте:
Предел обнаружения магния — 10 мкг. Мешают ионы, образующие малорастворимые фосфаты; NH4 + , K(I) и Na(I) не мешают.
Выполнение реакции. К 1—2 каплям раствора, содержащего ионы магния, прибавляют 2 — 3 капли 2 М НСl, 1 каплю раствора Na2HPО4 и при перемешивании по каплям прибавляют 2 М NH3 до появления запаха аммиака (рН
9). Выпадает белый кристаллический осадок.
г) Реакция с 8-оксихинолином (люминесцентная реакция).8-Оксихинолин образует с ионами магния при рН 9 — 12 флуоресцирующий зеленым светом оксихинолинат:
 |
Предел обнаружения магния — 0,025 мкг. Интенсивность свечения повышается при обработке влажного пятна с оксихинолинатом магния раствором NH3. Мешают А1(III), Zn(II).
Выполнение реакции. На фильтровальную бумагу наносят каплю раствора, содержащего ионы магния, и каплю этанольного раствора реагента. Образующийся оксихинолинат магния обрабатывают каплей 10%-ного раствора аммиака. При рассмотрении влажного пятна в ультрафиолетовом свете наблюдается зеленое свечение.
д) Реакция с хинализарином (1,2,5,8-тетраоксиантрахи-нон)(I).Хинализарин (1,2,5,8-тетраоксиантрахинон)(I) с ионами магния образует в щелочном растворе малорастворимое соединение синего цвета, которому приписывают структуру (II):
 |
 |
Предполагают, что хинализариновый лак является адсорбционным соединением гидроксида магния с реагентом. Весьма вероятно образование хелатов переменного состава.
Предел обнаружения магния — 5 мкг. Обнаружению не мешают ионы щелочноземельных металлов; в присутствии достаточно большого количества щелочи не мешают ионы алюминия.
Ион аммония мешает обнаружению иона магния, так как препятствует образованию гидроксида магния. Раствор реагента в щелочной среде окрашен в фиолетовый цвет, поэтому необходимо проведение контрольного опыта.
Выполнение реакции. К 1 — 2 каплям раствора, содержащего ионы магния, добавляют 1 каплю раствора хинализарина и 2 капли 30%-ного раствора NaOH. Образуется осадок синего цвета. Для проведения контрольного опыта к 1 — 2 каплям воды добавляют одну каплю раствора хинализарина, 2 капли 30%-ного раствора NaOH. Раствор окрашивается в фиолетовый цвет.
4. Тест-контроль 1 по теме: «Аналитические реакции парвой, второй, третьей групп». Примерный вариант.
1. Предел обнаружения катионов Na + в водном растворе микрокристаллоскопической реакцией с комплексным октаацетатотриуранилатом цинка Zn[(UO2)3 (СН3СОО)8] — цинкуранилацетатом
равен m= 0,125 мкг = 0,125 g при Vmin = 0, 05 мл. Определите предельное разбавление Vlim для данной реакции.
2. Рассчитайте значение рН и рОН для водного раствора HNO3 с концентрацией С(HNО3) = 0,01 моль/л без учета и с учетом влияния ионной силы раствора.
3. Фармакопейной реакцией на Nа + является взаимодействие с:
а) гидротартратом натрия;
в) гидроксидом калия КОН;
г) гексагидроксостибатом (V) калия К[Sb(ОН)6].
Напишите уравнения соответствующих реакций и укажите эффект.
4. НС1 образует белые осадки с катионами:
а) Ag + , Hg2 2+ , Pb 2+ в) Hg2 2+ , Ba 2+ , Li +
б) Ag + , Ca 2+ , NH4 + г) Pb 2+ , Sr 2+ , Ca 2+
Напишите соответствующие уравнения реакций. Чем отличаются эти осадки?
5. Цвет пламени горелки кирпично-красный, карминово-красный, желто-зеленый соответственно дают катионы:
| a) Sr 2+ , Ca 2+ , Li + | в) Ca 2+ , Sr 2+ Ba 2+ , |
| б) Ba 2+ , Nа + , Pb 2+ | г) K + , Li + , Hg2 2+ |
V. Литература.
1. Ю. Я. Харитонов. Аналитическая химия ч. 1. Высшая школа, М., 2001, гл. З, с. 54-78.
2. В.П. Васильев. Аналитическая химия. Книга 1. Титриметрические и гравиметрический методы анализа. Высшее образование. М., 2004 г. С. 252-267.
3. Ю. Я. Золотов. Основы аналитической химии. Практическое руководство. Высшая школа, М., 2001. С. 25-35.
З А Н Я Т И Е № 4.
I. Тема: Аналитические реакции катионов шестой группы.
II. Цель: 1. Научиться производить расчеты по определению концентраций Н + , ОН — , рН, рОН, используя константы кислотности и основности в различных растворах.
2. Сформулировать системный подход к протолитическим равновесиям в аналитических реакциях и научиться рассчитывать константу гидролиза и степень гидролиза.
3. Научиться определять в пробах катионы VI группы.
Видео:Обнаружение ионов железа Fe3+ и Fe2+ в растворах. | Лабораторный опыт № 13. (Повышенный уровень)Скачать

Уравнения реакций обнаружения ионов fe3

Ионы железа ( III ) в растворе можно определить с помощью качественных реакций. Проведем некоторые из них. Возьмем для опыта раствор хлорида железа ( III ).
1. Качественная реакция на ион железа ( III )– реакция со щелочью.
Если в растворе есть ионы железа ( III ), образуется гидроксид железа ( III ) Fe(OH)3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа ( II ) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа ( III ).
Видео:Химия. 9 класс. Качественные реакции на катионы Fe2+, Fe3+, CU2+, взаимодействие со щелочамиСкачать

FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl
2. Качественная реакция на ион железа ( III ) – реакция с желтой кровяной солью.
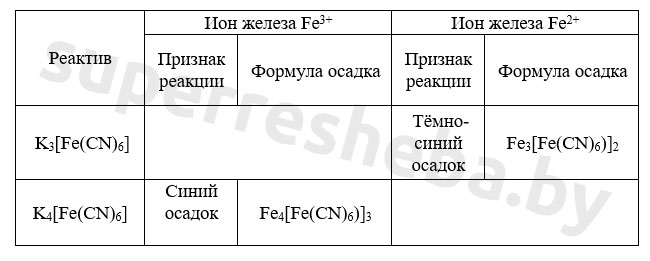
Желтая кровяная соль – это гексацианоферрат калия K 4 [ Fe ( CN )6]. (Для определения железа ( II ) используют красную кровяную соль K 3 [ Fe ( CN )6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа.
3. Качественная реакция на ион железа ( III ) – реакция с роданидом калия.
Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа ( III ) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа ( III ). Роданид от греческого «родеос» — красный.
Берлинская лазурь была получена случайно в начале 18 века в Берлине красильных дел мастером Дисбахом. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей: яркой, устойчивой и недорогой. Вскоре стал известен и рецепт получения краски: поташ сплавляли с высушенной кровью животных и железными опилками. Выщелачиванием такого сплава получали желтую кровяную соль. Сейчас берлинскую лазурь используют для получения печатной краски и подкрашивания полимеров .
Оборудование: колбы, пипетка.
Техника безопасности . Соблюдать правила обращения с растворами щелочей и растворами гексацианоферратов. Не допускать контакта растворов гексацианоферратов с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Видео:Обнаружение ионов в растворе. Качественные реакцииСкачать

Лаб. 13
Составьте уравнение химических реакций обнаружения ионов железа в молекулярном и ионном виде:
Составьте уравнения химических реакций в молекулярном виде, назовите продукты реакций.
В результате качественных реакций на ионы железа со щелочью мы наблюдаем выпадение бурого осадка гидроксида железа (III) и белого осадка гидроксида железа (II). А в результате реакций с гексацианоферратами калия образуются осадки синего цвета: турнбулева синь и берлинская лазурь. Все реакции протекают в растворе или расплаве.
1. Составьте уравнение электролитической диссоциации сульфата железа (III).
2. Укажите возможные степени окисления железа и приведите формулы соответствующих веществ.
+6 – H2FeO4 (в свободном виде не существует)
3. Как доказать качественный состав сульфата железа (II). Составьте уравнения химических реакций
4. Составьте уравнения химических реакций для осуществления превращений F e ( N O 3 ) 3 → F e ( O H ) 3 → F e C l 3 → F e C l 2 . mathrm. F e ( N O 3 ) 3 → F e ( O H ) 3 → F e C l 3 → F e C l 2 .
5. В пробирки с растворами солей по каплям добавили гидроксид натрия до появления признаков реакции. Заполните таблицу, указав признаки возможных реакций.
📽️ Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Катионы железа (III) Fe3+Скачать

Качественные реакции на катионы. 9 класс.Скачать

Качественные реакции на катионы меди (Cu2+) и железа (Fe3+;Fe2+)Скачать

Качественные реакции на Fe2+ и Fe3+Скачать

Качественные реакции на катионы и анионы. Практическая часть. 9 класс.Скачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Обнаружение ионов аммония в растворе. | Лабораторный опыт № 6.Скачать

Опыты по химии. Качественные реакции на ионы железа (II) и (III)Скачать

Химия 11 класс: Качественные реакции на ионы железа IIIСкачать

Реакции ионного обмена. 9 класс.Скачать

Обнаружение алюминияСкачать

Качественная реакция на ионы железа (III) №3Скачать

Качественная реакция ионов свинца с иодидом калияСкачать

Качественные реакции на анионы. 9 класс.Скачать
Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие с дифениламиномСкачать

Качественные реакции на ион аммонияСкачать