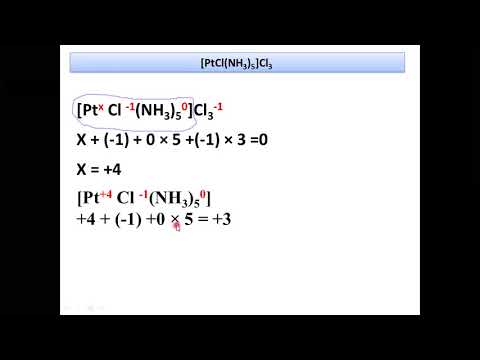
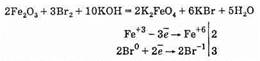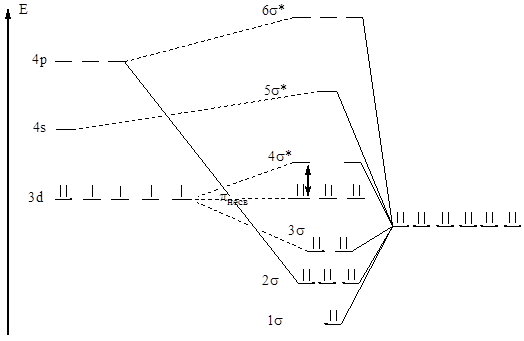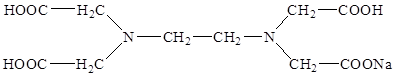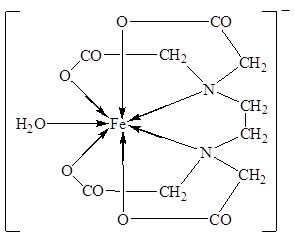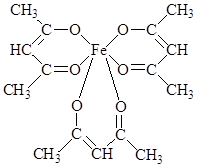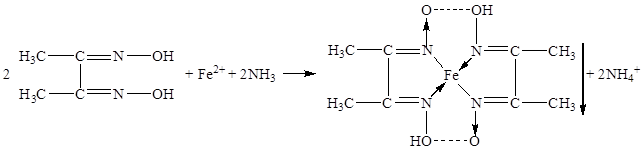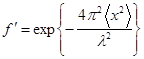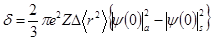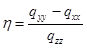Для железа наиболее характерны два ряда соединений: соединения железа (II) и железа (III). Известно также небольшое число соединений железа (VI).
Оксид железа (II) FeO — черный, легко окисляющийся порошок. Получают его восстановлением оксида железа (III) оксидом углерода (II) при 500°С:
FeO проявляет свойства основного оксида: легко растворяется в кислотах, образуя соли железа (II):
Оксид железа (III) Fe2O3 — самое устойчивое природное кислородсодержащее соединение железа.
Является амфотерным оксидом. При сплавлении Fe2O3 с оксидами, гидроксидами или карбонатами металлов образуются ферриты:
Растворяясь в кислотах, оксид железа (III) образует соли железа(III):
Оксид железа (II-III) Fe3O4 встречается в природе в виде минерала магнетита. Он хороший проводник тока, поэтому используется для изготовления электродов.
Получают взаимодействием железа с водяным паром ниже 570°С:
Оксид железа (II-III) Fe3O4 иным образом можно записать как FeO•Fe2O3.
Оксидам соответствуют гидроксиды железа.
Гидроксид железа (II) Fe(OH)2 представляет собой твердое вещество, но в чистом виде его можно получить лишь тогда, когда растворы реагирующих веществ не содержат растворенного кислорода и если реакцию вести в отсутствие кислорода воздуха:
На воздухе гидроксид железа (II) неустойчив, при соприкосновении с ним сначала зеленеет, затем буреет, переходя в гидроксид железа (III):
Гидроксид железа (II) Fe(OH)2 является нерастворимым гидроксидом и проявляет основные свойства, хорошо растворяясь в минеральных кислотах и образуя соли железа (II):
Гидроксид железа (III) Fe(OH)3 в виде красно-бурого осадка может быть получен окислением Fe(OH)2 либо действием щелочей на соли железа (III):
Гидроксид железа (III) трудно растворим, является более слабым основанием, чем гидроксид железа (II). Это объясняется тем, что у Fe 2+ меньше заряд иона и больше его радиус, чем у Fe 3+ , a значит, Fe 2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует. Гидроксид железа (III) обладает слабовыраженной амфотерностью: растворяется в разбавленных кислотах:
а при сплавлении со щелочами или основными оксидами образует ферриты:
Соли двухвалентного железа могут быть получены растворением металлического железа, гидроксида, карбоната или сульфида железа (II) в разбавленных кислотах без доступа воздуха:
Соли железа (II)гидролизуются незначительно: Fe 2+ +Н2О«Fe(OH) + +Н +
Среди солей железа (II) наибольшее значение имеет железный купорос FeSO4•7Н2О, в состав которого входит семь молекул кристаллизационной воды. Железный купорос хорошо растворяется в воде. Его применяют для борьбы с вредителями сельского хозяйства, а также для изготовления красителей.
Соли трехвалентного железа могут быть получены окислением порошка железа галогенами, окислением солей железа (II), растворением оксида или гидроксида железа (III) на воздухе:
Соли железа (III) сильно гидролизуются водой, и их водные растворы имеют кислую реакцию:
Из солей железа (III) наибольшее значение имеют хлорид железа (III) FeCl3, представляющий собой весьма гигроскопические оранжевые кристаллы, которые при хранении поглощают воду и расплываются в коричневую кашицу; ионагидрат сульфата железа (III) Fe2(SO4)3•9Н2О, используемый как коагулянт, а также для травления металлов; ионагидрат нитрата железа (III) Fe(NO3)3•9Н2О, используемый как протрава при крашении хлопчатобумажных тканей и утяжелитель шелка.
Соли железа (II) легко переходят в соли железа (III), например, при нагревании с азотной кислотой или с перманганатом калия в присутствии серной кислоты:
Окисление солей железа (II) в соли железа (III) может происходить под действием кислорода воздуха при хранении этих соединений, но только этот процесс очень длительный.
Кроме того, следует отметить также две важные комплексные соли, в которых железо входит в состав анионов: гексацианоферрат (II) калия K4[Fe(CN)6] и гексацианоферрат (III) калия K3[Fe(CN)6], которые являются реактивами на катионы Fe 3+ и Fe 2+ соответственно.
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная кровь) является важным реактивом для обнаружения ионов железа Fe 3+ в растворе:
Получающиеся ионы [Fe(CN)6] 4- могут взаимодействовать с ионами Fe 3+ , образуя характерный темно-синий осадок гексацианоферрата (II) железа (III), называемый часто берлинской лазурью:
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) является реактивом на катионы Fe 2+ :
и при взаимодействии иона [Fe(CN)6] 3- с катионами Fe 2+ выпадает темно-синий осадок гексацианоферрата (III) железа (II), называемый часто турнбулевой синью:
Катионы Fe 3+ могут быть обнаружены также с помощью бесцветного раствора роданида аммония NH4SCN:
Ионы SCN — образуют с катионом Fe 3+ соединение кроваво-красного цвета — роданит железа Fe(SCN)3 (плохо диссоциирующий):
Известно также небольшое число соединений железа (VI) — ферраты, например феррат калия K2FeO4, феррат бария BaFeO4, которые могут быть получены окислением оксида железа (III) при нагревании с нитратом и гидроксидом калия:
Ферраты в окислительно-восстановительных реакциях могут быть только окислителями.
- Железо. Свойства железа и его соединений
- Железо
- Положение в периодической системе химических элементов
- Электронное строение атома железа
- Физические свойства
- Нахождение в природе
- Способы получения
- Качественные реакции
- Химические свойства
- Оксид железа (II)
- Способы получения
- Химические свойства
- Оксид железа (III)
- Способы получения
- Химические свойства
- Оксид железа (II, III)
- Способы получения
- Химические свойства
- Гидроксид железа (II)
- Способы получения
- Химические свойства
- Гидроксид железа (III)
- Способы получения
- Химические свойства
- Соли железа
- Нитраты железа
- Гидролиз солей железа
- Окислительные свойства железа (III)
- Курсовая работа: Синтез и свойства комплексов железа (II) и железа (III)
- Оглавление
- Введение
- 1. Литературный обзор
- 1.1 Теория кристаллического поля
- 1.2 Мессбауэровская спектроскопия
- 1.3.1 Гексацианоферраты(II, III)
- 1.3.2 Дитиосульфатоферрат (III)
- 1.3.3 Дифосфатоферрат
- 1.3.4 Катион гексаамминжелеза (II)
- 1.3.5 Комплексы с другими лигандами
- 1.3.6 Триоксалатоферраты (III, II) калия
- 1.3.7 Хелаты
- 2. Практическая часть
- 2.1 Синтезы комплексов
- 2.1.1 Синтез триоксалатоферрата (III) калия
- 2.1.2 Синтез хелатного комплекса
- 2.1.3 Выращивание кристалла берлинской лазури
- 2.1.4 Выращивание кристалла турнбулевой сини
- Идентификация
- Выводы
- Список литературы
- Приложение
- 🎦 Видео
Видео:Комплексные соединенияСкачать

Железо. Свойства железа и его соединений
Железо Fe: химические свойства, способы получения железа, взаимодействие с простыми веществами (кислород, сера) и со сложными веществами (кислоты, вода, сильные окислители). Оксид железа (II) FeO, оксид железа (III) Fe2O3, железная окалина (Fe3O4) — способы получения и химические свойства. Гидроксид железа (II) Fe(OH)2, гидроксид железа (III) Fe(OH)3 — способы получения и химические свойства.
Железо
Положение в периодической системе химических элементов
Элемент железо расположен в побочной подгруппе VIII группы (или в 8 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение атома железа
Электронная конфигурация железа в основном состоянии :
+26Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Железо проявляет ярко выраженные магнитные свойства.
Физические свойства
Железо – металл серебристо-белого цвета, с высокой химической активностью и высокой ковкостью. Обладает высокой тепло- и электропроводностью.

Температура плавления 1538 о С, температура кипения 2861 о С.
Нахождение в природе
Железо довольно распространено в земной коре (порядка 4% массы земной коры). По распространенности на Земле железо занимает 4-ое место среди всех элементов и 2-ое место среди металлов. Содержание в земной коре — около 8%.
В природе железо в основном встречается в виде соединений:

Магнитный железняк Fe3O4 или FeO·Fe2O3 (магнетит).
(изображение с портала emchi-med.ru)
В природе также широко распространены сульфиды железа, например, пирит FeS2.

Встречаются и другие минералы, содержащие железо.
Способы получения
Железо в промышленности получают из железной руды, гематита Fe2O3 или магнетита (Fe3O4или FeO·Fe2O3).
1. Один из основных способов производства железа – доменный процесс . Доменный процесс основан на восстановлении железа из оксида углеродом в доменной печи.
В печь загружают руду, кокс и флюсы.
Шихта – смесь исходных материалов, а в некоторых случаях и топлива в определённой пропорции, которую обрабатывают в печи.
Каменноугольный кокс – это твёрдый пористый продукт серого цвета, получаемый путем коксования каменного угля при температурах 950—1100 °С без доступа воздуха. Содержит 96—98 % углерода.
Флюсы – это неорганические вещества, которые добавляют к руде при выплавке металлов, чтобы снизить температуру плавления и легче отделить металл от пустой породы.
Шлак – расплав (а после затвердевания – стекловидная масса), покрывающий поверхность жидкого металла. Шлак состоит из всплывших продуктов пустой породы с флюсами и предохраняет металл от вредного воздействия газовой среды печи, удаляет примеси.
В печи кокс окисляется до оксида углерода (II):
2C + O2 → 2CO
Затем нагретый угарный газ восстанавливает оксид железа (III):
Процесс получения железа – многоэтапный и зависит от температуры.
Наверху, где температура обычно находится в диапазоне между 200 °C и 700 °C, протекает следующая реакция:
Ниже в печи, при температурах приблизительно 850 °C, протекает восстановление смешанного оксида железа (II, III) до оксида железа (II):
Встречные потоки газов разогревают шихту, и происходит разложение известняка:
Оксид железа (II) опускается в область с более высоких температур (до 1200 o C), где протекает следующая реакция:
FeO + CO → Fe + CO2
Углекислый газ поднимается вверх и реагирует с коксом, образуя угарный газ:
CO2 + C → 2CO

2. Также железо получают прямым восстановлением из оксида водородом:
При этом получается более чистое железо, т.к. получаемое железо не загрязнено серой и фосфором, которые являются примесями в каменном угле.
3. Еще один способ получения железа в промышленности – электролиз растворов солей железа.
Качественные реакции
Качественные реакции на ионы железа +2.
– взаимодействие солей железа (II) с щелочами . При этом образуется серо-зеленый студенистый осадок гидроксида железа (II).
Например , хлорид железа (II) реагирует с гидроксидом натрия:
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Видеоопыт взаимодействия раствора сульфата железа (II) с раствором гидроксида натрия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Гидроксид железа (II) на воздухе буреет, так как окисляется до гидроксида железа (III):
– ионы железа +2 окрашивают раствор в светлый желто-зеленый цвет.
– взаимодействие с красной кровяной солью K3[Fe(CN)6] – также качественная реакция на ионы железа +2. При этом образуется синий осадок «турнбулева синь».
Видеоопыт взаимодействия раствора хлорида железа (II) с раствором гексацианоферрата (III) калия (качественная реакция на ионы железа (II)) можно посмотреть здесь.
Качественные реакции на ионы железа +3
– взаимодействие солей железа (III) с щелочами . При этом образуется бурый осадок гидроксида железа (III).

Например , хлорид железа (III) реагирует с гидроксидом натрия:
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гидроксида натрия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
– ионы железа +3 окрашивают раствор в светлый желто-оранжевый цвет.
– взаимодействие с желтой кровяной солью K4[Fe(CN)6] ионы железа +3. При этом образуется синий осадок «берлинская лазурь».
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором гексацианоферрата (II) калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
В последнее время получены данные, которые свидетельствуют, что молекулы берлинской лазури идентичны по строению молекулам турнбулевой сини. Состав молекул обоих этих веществ можно выразить формулой Fe4[Fe2(CN)6]3.
– при взаимодействии солей железа (III) с роданидами раствор окрашивается в кроваво-красный цвет.
Например , хлорид железа (III) взаимодействует с роданидом натрия:
FeCl3 + 3NaCNS → Fe(CNS)3 + 3NaCl
Видеоопыт взаимодействия раствора хлорида железа (III) с раствором роданида калия (качественная реакция на ионы железа (III)) можно посмотреть здесь.
Химические свойства
1. При обычных условиях железо малоактивно , но при нагревании, в особенности в мелкораздробленном состоянии, оно становится активным и реагирует почти со всеми неметаллами .
1.1. Железо реагирует с галогенами с образованием галогенидов. При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
2Fe + 3Cl2 → 2FeCl3
Менее активный йод окисляет железо до степени окисления +2:
1.2. Железо реагирует с серой с образованием сульфида железа (II):
Fe + S → FeS
1.3. Железо реагирует с фосфором . При этом образуется бинарное соединения – фосфид железа:
Fe + P → FeP
1.4. С азотом железо реагирует в специфических условиях.
1.5. Железо реагирует с углеродом и кремнием с образованием карбида и силицида.
1.6. При взаимодействии с кислородом железо образует окалину – двойной оксид железа (II, III):
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
2Fe + O2 → 2FeO
2. Железо взаимодействует со сложными веществами.
2.1. При обычных условиях железо с водой практически не реагирует. Раскаленное железо может вступать в реакцию при температуре 700-900 о С с водяным паром:
3 Fe 0 + 4 H2 + O → Fe +3 3O4 + 4 H2 0
В воде в присутствии кислорода или во влажном воздухе железо медленно окисляется (корродирует):
2.2. Железо взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль железа со степенью окисления +2 и водород.
Например , железо бурно реагирует с соляной кислотой :
Fe + 2HCl → FeCl2 + H2↑
2.3. При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
2.4. Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации. При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Железо может реагировать с щелочными растворами или расплавами сильных окислителей . При этом железо окисляет до степени окисления +6, образуя соль (феррат).
Например , при взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
2.6. Железо восстанавливает менее активные металлы из оксидов и солей .
Например , железо вытесняет медь из сульфата меди (II). Реакция экзотермическая:
Fe + CuSO4 → FeSO4 + Cu
Еще пример : простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
2FeCl3 + Fe → 3FeCl2
Оксид железа (II)
Оксид железа (II) – это твердое, нерастворимое в воде вещество черного цвета.
Способы получения
Оксид железа (II) можно получить различными методами :
1. Частичным в осстановлением оксида железа (III).
Например , частичным восстановлением оксида железа (III) водородом:
Или частичным восстановлением оксида железа (III) угарным газом:
Еще один пример : восстановление оксида железа (III) железом:
2. Разложение гидроксида железа (II) при нагревании :
Химические свойства
Оксид железа (II) — типичный основный оксид .
1. При взаимодействии оксида железа (II) с кислотными оксидами образуются соли.
Например , оксид железа (II) взаимодействует с оксидом серы (VI):
FeO + SO3 → FeSO4
2. Оксид железа (II) взаимодействует с растворимыми кислотами. При этом также образуются соответствующие соли .
Например , оксид железа (II) взаимодействует с соляной кислотой:
FeO + 2HCl → FeCl2 + H2O
3. Оксид железа (II) не взаимодействует с водой.
4. Оксид железа (II) малоустойчив, и легко окисляется до соединений железа (III).
Например , при взаимодействии с концентрированной азотной кислотой образуются нитрат железа (III), оксид азота (IV) и вода:
При взаимодействии с разбавленной азотной кислотой образуется оксид азота (II). Реакция идет при нагревании:
5. Оксид железа (II) проявляет слабые окислительные свойства .
Например , оксид железа (II) реагирует с угарным газом при нагревании:
FeO + CO → Fe + CO2
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
Оксид железа (III) – амфотерный .
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
Например , оксид железа (III) взаимодействует с азотной кислотой:
2. Оксид железа (III) взаимодействует с щелочами и основными оксидами. Реакция протекает в расплаве, при этом образуется соответствующая соль (феррит) .
Например , оксид железа (III) взаимодействует с гидроксидом натрия:
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Например , хлорат калия в щелочной среде окисляет оксид железа (III) до феррата:
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
5. Оксид железа (III) проявляет окислительные свойства .
Например , оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II) или железной окалины:
Также оксид железа (III) восстанавливается водородом:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Например , с гидридом натрия:
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например , из карбоната натрия:
Оксид железа (II, III)
Оксид железа (II, III) (железная окалина, магнетит) – это твердое, нерастворимое в воде вещество черного цвета.
Фото с сайта wikipedia.ru
Способы получения
Оксид железа (II, III) можно получить различными методами :
1. Горение железа на воздухе:
2. Частичное восстановление оксида железа (III) водородом или угарным газом :
3. При высокой температуре раскаленное железо реагирует с водой, образуя двойной оксид железа (II, III):
Химические свойства
Свойства оксида железа (II, III) определяются свойствами двух оксидов, из которых он состоит: основного оксида железа (II) и амфотерного оксида железа (III).
1. При взаимодействии оксида железа (II, III) с кислотными оксидами и кислотами образуются соли железа (II) и железа (III).
Например , оксид железа (II, III) взаимодействует с соляной кислотой. При это образуются две соли – хлорид железа (II) и хлорид железа (III):
Еще пример : оксид железа (II, III) взаимодействует с разбавленной серной кислотой.
2. Оксид железа (II, III) взаимодействует с сильными кислотами-окислителями (серной-концентрированной и азотной).
Например , железная окалина окисляется концентрированной азотной кислотой:
Разбавленной азотной кислотой окалина окисляется при нагревании:
Также оксид железа (II, III) окисляется концентрированной серной кислотой:
Также окалина окисляется кислородом воздуха :
3. Оксид железа (II, III) не взаимодействует с водой.
4. Оксид железа (II, III) окисляется сильными окислителями до соединений железа (VI), как и прочие оксиды железа (см. выше).
5. Железная окалина проявляет окислительные свойства .
Например , оксид железа (II, III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Также железная окалина восстанавливается водородом:
Оксид железа (II, III) реагирует с более активными металлами .
Например , с алюминием (алюмотермия):
Оксид железа (II, III) реагирует также с некоторыми другими сильными восстановителями (йодидами и сульфидами).
Например , с йодоводородом:
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
Соли железа
Нитраты железа
Нитрат железа (II) при нагревании разлагается на оксид железа (III), оксид азота (IV) и кислород:
Нитрат железа (III) при нагревании разлагается также на оксид железа (III), оксид азота (IV) и кислород:
Гидролиз солей железа
Растворимые соли железа, образованные кислотными остатками сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. частично:
I ступень: Fe 3+ + H2O ↔ FeOH 2+ + H +
II ступень: FeOH 2+ + H2O ↔ Fe(OH )2 + + H +
Однако сульфиты и карбонаты железа (III) и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
При взаимодействии соединений железа (III) с сульфидами протекает ОВР:
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Окислительные свойства железа (III)
Соли железа (III) под проявляют довольно сильные окислительные свойств. Так, при взаимодействии соединений железа (III) с сульфидами протекает окислительно-восстановительная реакция.
Например : хлорид железа (III) взаимодействует с сульфидом натрия. При этом образуется сера, хлорид натрия и либо черный осадок сульфида железа (II) (в избытке сульфида натрия), либо хлорид железа (II) (в избытке хлорида железа (III)):
2FeCl3 + 3Na2S → 2FeS + S + 6NaCl
2FeCl3 + Na2S → 2FeCl2 + S + 2NaCl
По такому же принципу соли железа (III) реагируют с сероводородом:
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
Соли железа (III) также вступают в окислительно-восстановительные реакции с йодидами .
Например , хлорид железа (III) взаимодействует с йодидом калия. При этом образуются хлорид железа (II), молекулярный йод и хлорид калия:
2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl
Интерес представляют также реакции солей железа (III) с металлами. Мы знаем, что более активные металлы вытесняют из солей менее активные металлы . Иначе говоря, металлы, которые стоят в электрохимическом ряду левее, могут взаимодействовать с солями металлов, которые расположены в этом ряду правее . Исходя из этого правила, соли железа могут взаимодействовать только с металлами, которые расположены до железа. И они взаимодействуют.
Однако, соли железа со степенью окисления +3 в этом ряду являются небольшим исключением. Ведь для железа характерны две степени окисления: +2 и +3. И железо со степенью окисления +3 является более сильным окислителем. Таким образом, условно говоря, железо со степенью окисления +3 расположено в ряду активности после меди. И соли железа (III) могут реагировать еще и с металлами, которые расположены правее железа! Но до меди, включительно. Вот такой парадокс.
И еще один момент. Соединения железа (III) с этими металлами реагировать будут, а вот соединения железа (II) с ними реагировать не будут. Таким образом, металлы, расположенные в ряду активности между железом и медью (включая медь) при взаимодействии с солями железа (III) восстанавливают железо до степени окисления +2. А вот металлы, расположенные до железа в ряду активности, могут восстановить железо и до простого вещества.
Например , хлорид железа (III) взаимодействует с медью. При этом образуются хлорид железа (II) и хлорид меди (II):
А вот реакция нитрата железа (III) с цинком протекает уже по привычному механизму. И железо восстанавливается до простого вещества:
Видео:9 класс. Железо. Соединения железа. Ч2Скачать

Курсовая работа: Синтез и свойства комплексов железа (II) и железа (III)
| Название: Синтез и свойства комплексов железа (II) и железа (III) Раздел: Рефераты по химии Тип: курсовая работа Добавлен 05:06:28 25 февраля 2011 Похожие работы Просмотров: 4683 Комментариев: 16 Оценило: 2 человек Средний балл: 5 Оценка: неизвестно Скачать | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация координ. иона | Ион-комплексообразователь | P, см –1 | Лиганды | Δ , см –1 | Электр. конфигурация октаэдр. иона | Спиновое состояние |
| d 4 | Cr 2+ | 23500 | H2 O | 13900 | 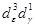 | BC |
| Mn 3+ | 28000 | H2 O | 21000 | 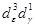 | BC | |
| d 5 | Mn 2+ | 25200 | H2 O | 7800 | 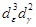 | BC |
| Fe 3+ | 30000 | H2 O | 13700 | 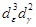 | BC | |
| d 6 | Fe 2+ | 17700 | H2 O | 10400 | 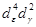 | BC |
| 17700 | CN – | 33000 | 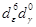 | HC | ||
| Co 3+ | 21000 | F – | 1300 | 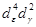 | BC | |
| 21000 | NH3 | 23000 | 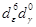 | HC | ||
| d 7 | Co 2+ | 22500 | H2 O | 10100 | 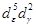 | BC |
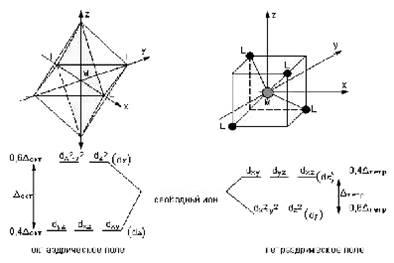
В рамках ТКП высокоспиновый комплекс [Fe(H2 O)6 ] 2+ с электронной конфигурацией 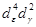
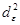
Распределение электронов между нижним (dγ ) и верхним (dε ) уровнями в тетраэдрических комплексах также зависит от соотношения Δ и P , но поскольку Δтетр 0 и d 10 , однако существование подобных комплексов легко объяснимо с позиций метода молекулярных орбиталей.
Таблица 2. Физические свойства элементов триады железа [2].
| Свойства | 26 Fe | 27 Co | 28 Ni |
| Атомная масса | 55,85 | 58,93 | 58,70 |
| Электронная конфигурация | [Ar]3d 6 4s 2  | [Ar]3d 7 4s 2  | [Ar]3d 8 4s 2  |
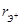 , нм , нм | 0,126 | 0,130 | 0,124 |
 , нм , нм | 0,08 | 0,08 | 0,079 |
| Энергия ионизации Э 0 → Э + , эВ | 0,58 | 0,94 | 1,28 |
| Возможные степени окисления | +2, +3, +6 | +2, +3 | +2, +3, +4 |
| кларк, ат.% (распространенность в природе) | 1,5 | 1∙10 -3 | 3∙10 -3 |
| Агрегатное состояние (н. у.) | Т В Е Р Д Ы Е В Е Щ Е С Т В А | ||
| Цвет | серебристо-серый | серо-стальной | серебристо-белый |
| tпл , 0 С | 1539 | 1493 | 1455 |
| Tкип , 0 С | 3070 | 2880 | 2800 |
| Плотность d , г/см 3 | 7,87 | 8,9 | 8,91 |
Стандартный электродный потенциал 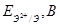 | -0,440 | -0,277 | -0,250 |
| Фото |  |  |  |
Видео:Получение комплексных соединенийСкачать

1.2 Мессбауэровская спектроскопия
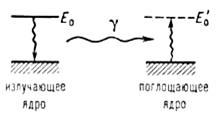
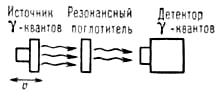
Мессбауэровская спектроскопия (гаммарезонансная спектроскопия), основана на явлении излучения и резонансного поглощения γ-квантов атомными ядрами в твердых телах без потери части энергии на отдачу ядра. При этом внутренняя энергия решетки твердого тела не изменяется (не происходит возбуждения фотонов — колебательных квантов). Это явление названо эффектом Мессбауэра. Эффект Мессбауэра позволяет наблюдать ядерное резонансное поглощение (рассеяние) со спектральными линиями естественной ширины Г, которая обычно лежит в интервале от 10 -9 до 10 -5 эВ, что соответствует временам жизни первых возбужденных (так называемых мессбауэровских) ядерных уровней 10 -6 ≥ t ≥10 -10 с. Резонансное поглощение γ -квантов возможно лишь при Е0 = Е’0 (где Е0 и Е’0 — энергии возбужденных состояний излучающего и поглощающего ядер соответственно) [3] (рис. 2).
Рис. 2. Схематическое изображение процессов излучения и резонансного поглощения γ-квантов.
Для наблюдения спектра поглощения необходимо контролируемым образом изменить энергию γ-квантов DЕ и найти зависимость интенсивности прошедшего через поглотитель пучка γ-квантов как функцию этого изменения. Наиболее удобный и обычно применяемый способ — доплеровское изменение энергии DЕД , возникающее при перемещении источника излучения (или поглотителя) с варьируемой скоростью u. Тогда DEД = E0 u/c (с-скорость света). Величины электрон-ядерных взаимодействий, обусловливающих различие Е0 и Е’0 для одинаковых нуклидов, соответствуют диапазону u в интервале — 10 см/с ≤ u ≤ 10 см/с и обычно составляют менее 10 -6 эВ. Измеряя интенсивность прошедшего через поглотитель γ-излучения как функцию скорости u, получают мессбауэровской спектр, характеристиками которого являются положение линий в шкале скоростей, их число, относительная интенсивность, форма и площадь. Для измерения зависимости резонансного поглощения от u используют мессбауэровской спектрометр, упрощенная схема которого представлена на рис. 3 [4]. Все нерезонансные процессы поглощения γ -квантов в веществе от u не зависят. Естественно, что в случае наличия различных изотопов в источнике излучения и поглотителе невозможно компенсировать различие Е0 и Е’0 , которое, как правило, более 10 эВ и обусловлено не электрон-ядерными взаимодействиями, а различиями в ядерном строении. Таким образом, мессбауэровская спектроскопия обладает свойством абсолютной избирательности: резонансное поглощение возможно лишь в случае, когда в источнике излучения и поглотителе существуют ядра одного и того же изотопа (в возбужденном и основном состояниях соответственно). Другие элементы и изотопы не оказывают на него влияние. Количество спектральных линий поглощения и их положение в энергетической шкале зависят от значений спинов ядер в основном и возбужденном состояниях и природы электрон-ядерных взаимодействий в данном веществе, наличия внутриатомных магнитных полей, градиентов электрических полей, природы химической связи.
Рис. 3. Упрощенная схема мессбауэровского спектрометра; источник γ-квантов с помощью механического или электродинамического устройства приводится в возвратно-поступательное движение со скоростью u относительно поглотителя. С помощью детектора измеряется зависимость интенсивности потока γ-квантов, прошедшего через поглотитель от скорости [3].
Эффект Мессбауэра открыт Р. Мессбауэром в 1958 г., в 1961 г. за это открытие автор удостоен Нобелевской премии.
Магнитное дипольное взаимодействие обычно наблюдается в магнитоупорядоченных веществах (ферро-, антиферро-, ферримагнетиках), в которых на ядра действуют сильные магнитные поля от электронных оболочек. Оно приводит к расщеплению основного и возбужденного состояний ядер, в результате чего в спектре поглощения появляется несколько спектральных линий, число которых определяется величинами спинов ядер в этих состояниях и правилами отбора (например, для ядра 57 Fe равно 6).
Энергия магнитного дипольного взаимодействия пропорциональна произведению напряженности магнитного поля (Н) на ядре на магнитный момент m ядра. Измерение (Н) дает возможность изучать электронное и спиновое строение исследуемого соединения и релаксационные эффекты.
Магнитное дипольное взаимодействие широко используется для изучения электронной и спиновой структуры химических соединений (высокоспиновые, низкоспиновые соединения), при исследовании магнитных свойств вещества в зависимости от характера химических связей. Важной особенностью мессбауэровской спектроскопии при изучении магнитных дипольных взаимодействий является высокая чувствительность спектров к локальному окружению мессбауэровских атомов. Поэтому эта область развита для изучения металлов, сплавов, твердых растворов, включая вопросы исследования фазового состава, дефектности, фазовых переходов, упорядочения [3].
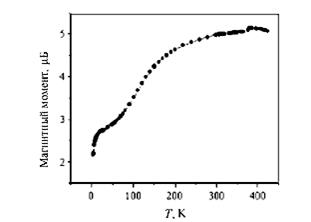
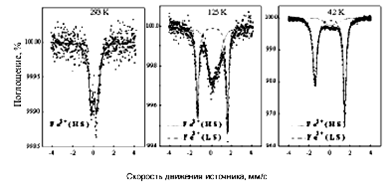
Рис. 4. Температурная зависимость магнитного момента комплекса [Fe(RSalen)2 ] + PF6 — (А) и мессбауэровские спектры комплекса Fe при температурах 293, 125 и 4,2 К (Б)[5].
Уникальная информативность мессбауэровской спектроскопии, относительная простота эксперимента и разработанные теоретические основы обусловили широкое применение мессбауэровской спектроскопии в физике и химии твердого тела, ядерной физике, геологии и археологии, аналитической химии, химической технологии.
1.3 Комплексные соединения железа в растворе
Железо, будучи переходным элементом, является типичным комплексообразователем. Железо образует устойчивые КС, находясь в валентном состоянии Fe (III) и Fe (II). Комплексообразование стабилизирует соединения малоустойчивой для железа степени окисления +2.
Железо образует достаточно большое количество комплексных соединений. Наиболее характерным для железа (II) и железа (III) является координационное число (КЧ) = 6 (реже 4 и 5). Способность к комплексообразованию более характерна для железа в С/О = +3. Рассмотрим некоторые комплексы железа и методы их получения.
1.3.1 Гексацианоферраты(II, III)
Для железа (II) очень устойчивы цианидные комплексы (цианоферраты (II)). Наиболее известным из них является гексацианоферрат (II) калия — желтая кровяная соль.
Желтая кровяная соль (гексацианоферрат (II) калия — K4 [Fe(CN)6 ]) известна с середины XVIII века. Первоначально ее получали сплавлением отходов скотобоен (например, крови животных, копыт, кож и т. п.) с поташем (К2 СO3 ) и железными обрезками. После остывания расплава и выщелачивания его водой получали желтую кровяную соль.
Сейчас гексацианоферрат (II) калия получают, действуя избытком KCN на соли двухвалентного железа:
При добавлении к раствору солей трехвалентного железа раствора желтой кровяной соли образуется темно-синий осадок, называемый берлинской или npyccкой лазурью [13]:
Фото. 2. Берлинская лазурь
Это — качественная реакция на соли Fe 3+ .
Если на желтую кровяную соль подействовать окислителем (хлором, перманганатом калия), то получается комплексная соль трехвалентного железа гексацианоферрат (III) калия — K3 [Fe(CN)6 ], которая окрашена в красный цвет и называется красной кровяной солью.
Фото. 1. Красная кровяная соль.
Красная кровяная соль (комплекс [Fe(CN)6 ] 3- ), менее устойчива, чем желтая (комплекс [Fe(CN6 )] 4- ), и поэтому очень ядовита.
Рис. 5. Энергетическая диаграмма [Fe(CN6 )] 4- (метод МО).
При взаимодействии растворов солей двухвалентного железа с красной кровяной солью образуется темно-синий осадок, называемый турнбулевой синью:
Это — качественная реакция на соли Fe 2+ .
Ранее считалось, что при этом образуется гексацианоферрат (III) железа (II), то есть Fe II 3 [Fe(CN)6 ]2 , именно такую формулу предлагали для «турнбулевой сини». Теперь благодаря исследованиям по методу мессбауэровской спектроскопии известно, что турнбулева синь и берлинская лазурь — одно и то же вещество, а в процессе реакции происходит переход электронов от ионов Fe 2+ к гексацианоферрат (III)- иону [6]:
Fe 2+ + [Fe 3+ (CN)6 ] 3- → Fe 3+ + [Fe 2+ (CN)6 ] 4- .
Этот процесс происходит практически мгновенно, а обратную реакцию можно осуществить лишь в вакууме при 300 0 С [6]. Этот факт объясняется, по-видимому, тем, что комплекс [Fe II (CN)6 ] 4- более устойчив, чем [Fe III (CN)6 ] 3- .
Турнбулева синь и берлинская лазурь плохо растворимы в воде, что затрудняет их использование в виде красок. Для повышения растворимости гексацианоферратов вводят ионы калия вплоть до состава KFe[Fe(CN)6 ] (последнее соединение называется растворимой берлинской лазурью). По мере увеличения содержания ионов калия цвет соединений меняется от темно- до светло-синего.
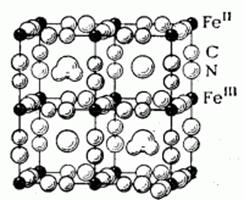
Схема структуры растворимой «берлинской лазури» – «турнбулевой сини» (кристаллогидрат вида KFe III [Fe II (CN)6 ]·H2 O) приведена на рисунке 6 [6].
Рис. 6. Кристаллическая решетка «берлинской лазури»
Из неё видно, что атомы Fe 2+ и Fe 3+ располагаются в кристаллической решётке однотипно, однако по отношению к цианидным группам они неравноценны, преобладает тенденция к размещению Fe 2+ между атомами углерода, Fe 3+ — между атомами азота, ионы К + и молекулы H2 O располагаются в пустотах кристаллической решетки.
Хотя состав, структура и кристаллические решетки берлинской лазури и турнбулевой сини идентичны, различные исторические названия продолжают сохраняться, отражая химию ионов железа в различных степенях окисления.
1.3.2 Дитиосульфатоферрат (III)
Это комплексное соединения образуется при взаимодействии железа 3+ с тиосульфатом натрия. Комплексное соединение окрашено в интенсивный фиолетовый цвет [8].
Далее окраска исчезает вследствие восстановления данной соли до бесцветной соли железа (II) тиосульфата и тетратионата [9].
1.3.3 Дифосфатоферрат
В кислой среде фосфаты и фосфорная кислота с ионами железа образуют бесцветные комплексы [Fe(PO4 )2 ] 3- [12]:
1.3.4 Катион гексаамминжелеза (II)
Катион [Fe(NH3 )6 ] 2+ малоустойчив и водой мгновенно разлагается [14]:
1.3.5 Комплексы с другими лигандами
К числу высокоспиновых комплексов Fe 2+ , образованных монодентантными лигандами, относятся акваионы [Fe(H2 O)6 ] 2+ , КС с галогенид-ионами, например, K2 [FeF4 ], в структуре которого зафиксированы конденсированные октаэдры [FeF6 ] [12].
Железо (II) в КС с полидентантными лигандами неустойчиво, так как быстро окисляется кислородом воздуха и водой, переходя в более термодинамически стабильные КС железа (III) [10].
1.3.6 Триоксалатоферраты (III, II) калия
Триоксалатоферрат (III) калия получают при взаимодействии сульфата железа (III), оксалата бария, и оксалата калия в водном растворе:
Под действием света с длиной волны меньше 490 нм Fe(III) количественно восстанавливается до Fe(II) за счет окисления части ионов C2 O4 2- до CO2 [14]:
Образующийся при этом оксалатный комплекс железа (II) хорошо растворим в воде, и выделяется из раствора в виде кристаллогидрата K2 [Fe(C2 O4 )2 ] ∙6H2 O золотисто-желтого цвета.
Фото. 3. Триоксалатоферрат (II) калия
1.3.7 Хелаты
Термин хелат (англ. chelate от греческого «клешня») принят для обозначения циклических структур, которые образуются в результате присоединения катиона к двум или более донорным атомам, принадлежащим одной молекуле комплексона. В соответствии с термином хелат эти соединения следует представлять в виде какого-то краба, который своими полидентатными клешнями прочно захватывает ион металла, и чем больше клешней, тем прочнее захват. Как буквальный перевод слова chelate в литературе до сравнительно недавнего времени для обозначения комплексных соединений с циклическими структурами использовался термин «клешневидные соединения» [16].
Замыкание циклов при образовании хелатных соединений является важным фактором, обусловливающим высокую устойчивость комплексонатов. Комплексные соединения, содержащие циклические группировки, отличаются более высокой прочностью, чем соединения, не содержащие циклов, а наибольшей устойчивостью обладают комплексы с пяти- и шестичленными циклами.
Хелатные комплексы наиболее характерны для комплексонов. Термин «комплексоны» предложен в 1945 году профессором Цюрихского университета Г. Шварценбахом (1904 — 1978) для органических лигандов группы полиаминополикарбоновых кислот [16].
Наиболее часто используемым комплексоном является этилендиаминтетраацетат (ЭДТА, трилон-Б).
Комплекс железа с ЭДТА ([Fe(ЭДТА)(H2 O)] — ) относится к числу низкоспиновых[14]. В нем лиганд ЭДТА 4- , как обычно, гексадентантен. Однако, КЧ иона Fe 3+ равно 7, поскольку, кроме четырех атомов кислорода и двух атомов азота, ЭДТА 4- во внутреннюю сферу КС входит атом кислорода внутрисферной гидратной воды:
Образование хелатных структур характерно не только для комплексонов, но для других органических соединений. Например, очень устойчивы КС железа с бета-дикетонами. Простейший из бета-дикетонов железа – трисацетилацетонат Fe(AcAc)3 [14].
При нагревании сублимируется без разложения. В его молекуле имеются 3 шестичленных хелатных цикла. Несмотря на принадлежность к высокоспиновым соединениям, трисацетилацетонат железа (III) ведет себя как соединение с молекулярной структурой: ионная составляющая связи Fe III – лиганд экранируется углеводородными радикалами лиганда, в результате чего для соединения характерно слабое «органоподобное» межмолекулярное взаимодействие. Это объясняет его способность растворяться в малополярных растворителях и легко сублимироваться (150 0 С).
В качестве неофициальных реакций наиболее чувствительным реактивом на железо (II) является спиртовой раствор диметилглиоксима, который образует с железа (II) ионом комплексное хелатное соединение красного цвета, нерастворимое в растворе аммиака [11]:
Производное гексацианоферрата (III) железа, называемое нитропруссидом натрия Na2 [Fe(NO) + (CN)5 ]∙2H2 O (кристаллы темно-красного цвета), можно получить, например, по реакции [14]:
Таблица 3. Характеристика комплексных соединений железа.
| Название | Формула | Валентность железа | P | Δ | Спиновое состояние | Схема расщепления d-орбиталей |
| Тетрафтороферрат (II) | [FeF4 ] 2- | 2 | 209,9 | 106,2 | ВС |  |
| Нитропруссид | [Fe(NO)(CN)5 ] 2- | 2 | 209,9 | НС |  | |
| Гексаакважелезо (II) | [Fe(H2 O)6 ] 2+ | 2 | 209,9 | 124,1 | ВС | 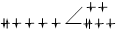 |
| [Fe(C2 (CH3 )2 N2 OH(OH))2 ] | 2 | 209,9 | НС | 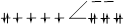 | ||
| Гексаамминжелезо (II) | [Fe(NH3 )6 ] 2+ | 2 | 209,9 | 153,9 | ВС | 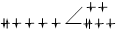 |
| гексацианоферрат(II) | [Fe(CN)6 ] 4- | 2 | 209,9 | 403,2 | НС | 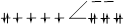 |
| гексацианоферрат(III) | [Fe(CN)6 ] 3- | 3 | 357,9 | 417,6 | НС | 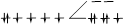 |
| Дитиосульфатоферрат (III) | [Fe(S2 O3 )2 ] — | 3 | 357,9 | ВС | 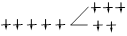 | |
| Дифосфатоферрат (III) | [Fe(PO4 )2 ] 3- | 3 | 357,9 | ВС | 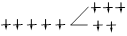 | |
| Триоксалатоферрат (III) | [Fe(C2 O4 )3 ] 3- | 3 | 357,9 | ВС | 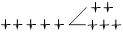 | |
| Комплекс с ЭДТА | [Fe(ЭДТА)H2 O] — | 3 | 357,9 | НС | 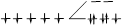 |
Видео:Соединения железаСкачать

2. Практическая часть
Видео:Составление уравнений химических реакций в схеме превращений соединений железа.Скачать

2.1 Синтезы комплексов
2.1.1 Синтез триоксалатоферрата (III) калия
Вначале необходимо приготовить оксалат бария, для чего к раствору 1,5 г оксалата натрия в 40 мл воды прилить раствор 2,5 г дигидрата хлорида бария в 6 мл воды. Выпавшие кристаллы отфильтровать на воронке Бюхнера и промыть несколько раз холодной водой [7].
Для получения триоксалатоферрата (III) калия в стакан емкостью 50-100 мл поместить 1,25 г сульфата железа (III), полученный оксалат бария, 1,5 г оксалата калия и 30 мл воды. Нагревать смесь в течение нескольких часов на водяной бане, поддерживая постоянный объем. После отделения осадка сульфата бария упарить фильтрат до объема 5 мл и охладить. Кристаллы триоксалатоферрата (III) калия отфильтровать, промыть небольшим количеством воды, а затем спиртом и высушить в вакуум-эксикаторе над серной кислотой. Препарат следует защищать от солнечного света, сушку лучше производить в темном месте.
2.1.2 Синтез хелатного комплекса
Приготовить раствор 4 г FeCl3 в 3,5 мл воды и раствор 9,3 г ЭДТА в 30 мл воды. Нагревать смесь в течение нескольких часов на плитке, затем дать остыть. Выпавшие кристаллы отфильтровать и высушить.
2.1.3 Выращивание кристалла берлинской лазури
При выращивании кристаллов необходимо учитывать, что если кристаллизация идет очень медленно, получается один большой кристалл если быстро — множество мелких кристаллов. Вещества, состоящие из одного кристалла, — монокристаллы.
Выращивают кристаллы разными способами: например, охлаждая насыщенный раствор. С понижением температуры растворимость большинства веществ уменьшается, и они, как говорят, выпадают в осадок. Сначала в растворе и на стенках сосуда появляются крошечные кристаллы-зародыши, а затем идет кристаллизация по всему объему раствора. Когда охлаждение медленное, а в растворе нет твердых примесей (скажем, пыли), зародышей образуется немного, и постепенно они превращаются в красивые кристаллы правильной формы [17].
Приготовить горячие насыщенные растворы FeCl3 и желтой кровяной соли. Растворы смешать в химическом стакане, выпавший осадок отфильтровать на воронке Бюхнера и поместить в чистую фильтровальную бумагу для получения затравки. Через неделю выбрать самый большой кристалл для затравки, обвязать его лавсановой нитью и поместить в маточный раствор. Через 14 дней были получены более крупные кристаллы.
2.1.4 Выращивание кристалла турнбулевой сини
Приготовить горячие насыщенные растворы FeSO4 и красной кровяной соли. Растворы смешать в химическом стакане, выпавший осадок отфильтровать на воронке Бюхнера и поместить в чистую фильтровальную бумагу для получения затравки. Через неделю выбрать самый большой кристалл для затравки, обвязать его лавсановой нитью и помещают в маточный раствор. Через 14 дней получают более крупный кристалл, в форме куба.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Идентификация
1) выращенные кристаллы имеют кубическую форму, что соответствует литературным данным. При рассматривании через микроскоп подтверждается кубическая структура кристалла.
2) окраска кубических кристаллов «турнбулевой сини»-«берлинской лазури» очень близка, что указывает на идентичность их структуры.
3) поскольку более устойчивым является цианидный комплекс Fe (II), то при образовании «турнбулевой сини» происходит валентный переход:
4) таким образом, осуществляется переход к более устойчивому цианидному комплексу Fe (II), т. е. к «берлинской лазури».
5) окраска полученного комплексного соединения железа (III) с ЭДТА соответствует литературным данным (желтая).
6) окраска полученного триоксалатоферрата (III) калия соответствует литературным данным (оранжево-коричневая).
Видео:Химия 9 класс : Соединения железаСкачать

Выводы
1) целью данной работы было установить кубическую структуру и идентичность «турнбулевой сини»-«берлинской лазури».
2) выращены кристаллы турнбулевой сини и берлинской лазури.
3) визуальный осмотр полученных кубических кристаллов свидетельствует о близости формы и окраски этих кристаллов, в том числе и при осмотре через микроскоп.
4) сделан вывод на основании литературных данных, что за счет валентного перехода Fe II 3 [Fe(CN)6 ]2 превращается в Fe4 [Fe(CN)6 ]3 , т. е. процесс идет в направлении создания более устойчивого комплекса Fe (II).
5) получено 2,32 грамма триоксалатоферрата Fe(III), что составляет 85% от теоретического выхода
6) получен комплекс железа (III) с ЭДТА
Видео:Константа нестойкости и диссоциация комплексных соединенийСкачать

Список литературы
1. Теория кристаллического поля.
http://www.college.ru/chemistry/course/content/theory.html — WWW, курс «Открытая Химия 2.5», 2007
2. Налбандян В. Б. Курс лекций по общей и неорганической химии. – WWW.: Химический факультет РГУ, 2002.
3. Гольданский В.И. Эффект Мёссбауэра. М.: Изд-во АН СССР, 1963;
4. Мёссбауэр Р.Л. Резонансное ядерное поглощение квантов в твердых телах без отдачи. Успехи физических наук, 1960, т. 72, вып. 4, с. 658–671.
5. И.В. Овчинников, Ю.Г. Галяметдинов. Магнитные жидкие кристаллы на основе координационных соединений. // Рос. хим. ж. (Ж. Рос. хим. об-ва им. Д.И. Менделеева). – 2001. – т. XLV, №3. – С. 74-79.
6. Леенсон И. Лазурь берлинская.
http://www.krugosvet.ru/articles/111/1011153/1011153a1.htm — WWW, энциклопедия «Кругосвет», 2007.
7. Практикум по неорганической химии: Учеб. пособие /под ред. В.П. Зломанова. – М.: Изд-во МГУ, 1994 – 320с.
8. Мелентьева Г.А. Фармацевтическая химия: В 2 т. – М.: “Высшая школа”, 1976. – Т.1 – 780 с.; Т. 2. – 827 с.
9. Беликов В.Г. Фармацевтическая химия: Учеб. для фармац. ин-тов и фак. мед. ин-тов. – М.: “Высшая школа”, 1985. – 768 с.
10. Максютина Н.П и др. Методы анализа лекарств, — Киев: Здоровье,1987
11. Пономарев В.Д. Аналитическая химия. – М.: Химия,1982
12. Крамаренко В.Ф. Токсикологическая химия. – Киев: Выща школа, 1989 г. — 447 с.
13. Справочник школьника по химии 8-11 класс. / под ред. Н.Е. Кузьменко, В.В. Еремина — М.: ООО «Издательский дом «ОНИКС 31 век»:ООО «Издательство «Мир и Образование», 2003. — 624 с.
14. Третьяков Ю.Д. Неорганическая химия. Химия элементов: учебник для вузов. В 2 книгах. — М.: Химия, 2001 — 472с.
15. Химическая энциклопедия. В 5 томах. Том 1. / под ред. Кнунянца И.Л., Зефирова Н.С., Кулова Н.Н. – М.: Большая российская энциклопедия, 1988 – 624 с.
16. В.П. Васильев. Комплексоны и комплексонаты. // Соросовский образовательный журнал. – 1996. – № 4. – с. 39-44.
17. Энциклопедия для детей. Том 17. Химия. / глав. ред. В. А. Володин. – М.: Аванта+, 2000. – 640 с.
18. Турова Н.Я., Неорганическая химия в таблицах. – М.: Высш. хим. колл. РАН, 1999. – 140 с.
Видео:Комплексные соединенияСкачать

Приложение
Параметры мёссбауэровских спектров:
1) Вероятность эффекта Мёссбауэра в общем случае записывается в виде [3]:
где 2 >- средний квадрат смещения ядер в поглотителе из положения равновесия при твердотельных колебаниях в направлении пучка γ-квантов, l -длина волны γ-кванта. Величина 2 > зависит от фононного спектра твердого тела и его абсолютной температур Т. С ростом температуры 2 > растет, а f’ падает. Вероятность эффекта Мёссбауэра падает также с уменьшением порядкового номера элемента, так как при этом сильно возрастает энергия первого возбужденного ядерного состояния Е0 и на ядрах легких элементов эффект не наблюдается. Пока он отмечен для 103 нуклидов 44 элементов.
Исследования зависимостей f’ от температуры используют при установлении координационных чисел, для определения фазовых переходов и изучения характерных динамических параметров твердых тел до и после фазового перехода. Особенно эффективен этот метод в области низких и сверхнизких температур и для некристаллических веществ, когда, как правило, затруднены рентгеноструктурные исследования.
Площади спектральных линий, наблюдаемые экспериментально, пропорциональны концентрации исследуемого атома в образце при фиксированной температуре. На измерении этих площадей основано применение мессбауэровской спектрометрии для решения некоторых задач аналитической химии и фазового анализа вещества [4].
2)Энергетический сдвиг спектра излучения относительно спектра поглощения вычисляется как сумма температурного сдвига dT и изомерного сдвига d .
Температурный (доплеровский) сдвиг линии возникает вследствие изменения энергии γ-квантов при их излучении и поглощении в результате релятивистского изменения массы излучающих и поглощающих ядер соответственно («красное смещение»). Например, для 57 Fe ожидаемое смещение при переходе от комнатной температуры к Т → 0 близко к естественной ширине линии. Поскольку различие в температурах источника и поглотителя более 300 К встречается редко, вклад dT мал и обычно маскируется более сильным сдвигом, который от температуры не зависит.
Для тождественных ядер в отсутствии электрических и магнитных полей спектр представляет собой одиночную линию (рис. 7, а).
Изомерный (химический) сдвиг связан с электрическим монопольным кулоновским взаимодействием между ядром с зарядовым радиусом r и электронами атома [3]:
где е -элементарный заряд, Z -атомный номер, ∆ -изменение среднего квадрата радиуса ядра при его возбуждении (ядерный параметр), 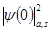
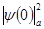
Рис. 7. Схематическое изображение спектров мёссбауэровского резонансного поглощения γ-квантов: I-интенсивность потока γ-квантов, прошедших через поглотитель, u -скорость движения источника γ-квантов относительно поглотителя; а — резонансная линия при u = 0; б, в, г — соответственно изомерный сдвиг (d), квадрупольный дублет (DEQ ), магнитная сверхтонкая структура для ядер 57 Fe.
Значения δ отсчитывают от стандарта, который принят для спектроскопии данного ядра. При этом выбирают соединения, стабильное химически и дающее простой мёссбауэровский спектр. Например, в случае 119 Sn δ отсчитывается от значения, соответствующего соединению 119 SnO2 , а для 57 Fe в качестве стандарта используют нитропруссид натрия.
По величине химического сдвига можно судить о различии в характере химических связей. С помощью мессбауэровской спектроскопии изучено большое число соединений, составлены номограммы, с помощью которые по δ определяют валентность элемента в неизученных соединениях. В зависимости от конфигурации валентных электронных оболочек атомов и ионов могут быть проведены квантовомеханические расчеты 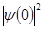
3) Электрическое квадрупольное взаимодействие возникает вследствие взаимодействия квадрупольного момента ядра Q с градиентом электрического поля q, создаваемого электронной оболочкой атома или кристаллической решеткой твердого тела, в результате чего в спектрах поглощения наблюдается не одна, а несколько линий. Если спин ядра I > 1/2, a q ≠ 0, это взаимодействие приводит к «расщеплению» ядерного энергетического уровня на подуровни, расстояние между которыми определяется, например, для ядра 57 Fe выражением [4]:
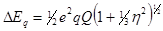
qxx , qyy , qzz — градиенты электрического поля на ядре вдоль соответствующих осей. Величина q характеризует отклонение распределения электронного заряда от сферического.
🎦 Видео
Тест№13 и 14. Лабораторная работа "Получение и свойства комплексных соединений"Скачать

9 класс. Химия. Железо и его соединенияСкачать

Разрушение комплексных соединенийСкачать

Видео поведение комплексных соединений в растворах.Скачать
Комплексные соединения. Определяем заряд комплексного иона и валентность комплексообразователя.Скачать

Комплексные соединенияСкачать